Ценность воды в жизнедеятельности человека неоспорима. Наличие централизованного водоснабжения частично решает насущную проблему ее повсеместного загрязнения. Вода из крана проходит первичную очистку, для улучшения качества в квартирах устанавливают различные фильтры. А если обнаружены нитраты в воде из скважины, что делать? Для начала стоит разобраться во вредном влиянии нитратов на здоровье и источниках их поступления в воду. Также расскажем, как бороться с возникшей проблемой.
Нитратами именуют производные соли азотной кислоты. Своему широкому применению они обязаны селитре, которая активно задействована при возделывании сельскохозяйственных культур в качестве удобрения. Дешевизна химиката и эффективное влияние на рост и созревание растений зачастую приводят к его передозировке. Как результат – препарат вместе с осадками проникает в грунтовые воды, после чего вода попадает в колодец или скважину.
Существуют и другие причины, из-за которых в скважине или колодце находится вода с нитратами с превышенным уровнем допустимых норм. Источником заражения выступают:
- Недопустимо близкое соседство скважины с частным туалетом, септиком, баней или выгребной ямой.
- Применение бытовой химии, после чего раствор воды сливают в грунт поблизости скважины.
- Обустройство скважины неподалеку от массовых захоронений.
- Завышенная концентрация удобрений для роста огородных культур.
Нитраты входят в 3 класс опасности, по нормам Евросоюза их содержание не должно превышать 50 мг/дм 3 , регламент СанПин установил предел в 45 мг/дм 3 . Еще большую опасность для здоровья представляют производные нитратов – нитриты. Химическое соединение относится ко 2 классу опасности, уровень содержания примесей по директивам Евросоюза и СанПин не должно превышать 0,5 и 3,0 мг/дм 3 соответственно.
Употребление пищи, приготовленной на воде из скважины, и банальное питье – не единственный способ попадания в организм нитратов. Вредное соединение способно проникнуть через кожу в процессе принятия ванны. Поэтому рекомендуется регулярно следить за качеством воды из скважины.
Находясь в организме, нитраты взаимодействуют с гемоглобином. В результате химической реакции гемоглобин в крови человека замещается метгемоглобином. Новое соединение не способно насытить клетки тела необходимым кислородом, что вызывает ряд негативных последствий.
Кислородное голодание сопровождается рядом неприятных симптомов:
- развивается анемия;
- человека сопровождает постоянное чувство усталости;
- длительное воздействие нитратов в дозах, значительно превосходящих нормы, провоцирует обмороки и в крайних случаях заканчивается летальным исходом.
Кроме этого, регулярное употребление воды из скважины, в которой содержание нитратов выше установленных значений, может спровоцировать:
- развитие злокачественных образований;
- появление аллергических реакций;
- всевозможные раздражения на поверхности кожи и слизистых оболочках;
- оказывать угнетающее действие на функционирование щитовидной железы;
- нарушить работу нервной системы;
- проблемы с ЖКТ.
Еще большую опасность представляют нитраты в воде из скважины для здоровья младенцев и детей, не достигших подросткового возраста. Допустимые показатели содержания в организме нитратов для малышей в 4 раза меньше, нежели для взрослого человека.
Но спешить отказываться от пользования водой из скважины при обнаружении в ней вредных веществ, включая нитраты, не стоит. Учеными разработано два эффективных способа, как сделать воду из скважины пригодной для питья. Это ионный обмен и обратный осмос. Рассмотрим подробно, в чем заключается принцип действия обоих способов.
Очистка воды из скважины с применением обратного осмоса считается чрезвычайно эффективным процессом. Принцип действия основан на перегонке загрязненной воды через полупроницаемую мембрану. Устройство успешно задерживает вредные примеси, свободно пропуская молекулы воды.
Мембраны обратного осмоса для обработки воды из скважины представлены различными видами. Для самой очистки мембраны применяется перекрестное течение. С одной стороны, вода направляется через мембрану по дальнейшему пути водопровода. С другой – вода движется обратно и очищает саму мембрану.
Для обеспечения движения воды из скважины через мембрану в обратном направлении применяется помпа. Важным элементом в процедуре обратного осмоса при удалении из воды нитратов является ограничитель течения. На устройство возложена функция контроля над перекрестным течением. Ограничитель отслеживает объем воды, очищенной от нитратов и количество поступившей жидкости в систему канализации.
Помимо достоинств, способ очистки воды из скважины с применением обратного осмоса обладает рядом негативных моментов:
- Перед поступлением на мембрану, вода из скважины с содержанием нитратов нуждается в предварительной механической очистке.
- Очистительный процесс касается всех примесей, и не только вредных. Поэтому вода со скважины лишается всех солей и минералов в целом. Такая глубокая и неразборчивая очистка нивелируют пользу от употребления воды из скважины.
- Применение обратного осмоса с целью удаления из воды нитратов – занятие дорогостоящее. Целесообразно стать обладателем компактной установки, очищающей воду для питья и приготовления пищи. Для бытовых нужд вполне приемлемо пользоваться водой с содержанием нитратов.
Перед приобретением устройства обратного осмоса стоит взвесить все выигрышные и негативные стороны, чтобы понять целесообразность выбора.
Метод основывается на химическом процессе, когда вредные ионы воды из скважины замещаются полезными частицами. Нитраты, растворенные в жидкости, представлены нитрат-анионами, то есть элементами с отрицательным зарядом. Чтобы удалить их из жидкости, применяют селективные смолы, которым свойственны анионообменные функции. Подобная смола извлекает из воды исключительно ионы нитратов.
Если рассматривать смолу на уровне молекул, она представлена активным ядром с плюсовым зарядом, по краям которого движутся ионы со слабым отрицательным зарядом. Когда вода из скважины пропускается через смолу, происходит процесс замены ионов смолы с минусовым зарядом на ионы нитратов.
Перед окончательным решением остановиться на каком-либо из двух предложенных способов очистки от нитратов воды, необходимо организовать два мероприятия:
- Провести санитарное обследование скважины, с целью определения источника загрязнения. Если он будет установлен, по возможности нейтрализовать или ослабить его воздействие.
- Сдать воду из скважины в лабораторию для проведения бактериологических и химических анализов.
Проведенные исследования дадут основание для выбора того или иного способа. Первоначально выявить в воде содержание нитратов помогут химические тестеры одноразового действия или специальные приборы, именуемые нитратомерами. Большая точность и удобство применения свойственна электронным аппаратам. Всего за несколько секунд потребитель получит информацию с минимальным уровнем погрешности.
источник
Качество питьевой воды определяется ее органолептическими характеристиками. Одной из самых серьезных проблем является высокая концентрация нитратов — солей азотной кислоты, поступающих в воду из стоков от промышленной, бытовой и сельскохозяйственной деятельности. Определить нитраты в воде можно путем проведения химического анализа жидкости. При этом важным шагом является дальнейшая качественная очистка водного источника.
Избыток нитратов встречается в подземных и поверхностных водных источниках, реже — в скважинах глубиной до 35 метров. В артезианских водах соли азотной кислоты содержатся в минимальных количествах или почти отсутствуют.
Существует три уровня токсичности соединений, способных нанести вред человеку. Первый уровень — это нитрат, второй — нитрит, третий — опасный нитрозамин.
Негативное влияние на организм человека и домашних животных проявляется в следующем:
- Нитраты способствуют образованию опасного вещества в крови — метгемоглобина, который приводит к кислородному голоданию. Если показатель метгемоглобина составляет 15 %, это проявляется быстрой утомляемостью, вялостью и головокружением. Увеличение метгемоглобина до 60 % приводит к летальному исходу.
- Снижение уровня гемоглобина приводит к ухудшению работы сердечной и сосудистой системы, закупорке сосудов и капилляров, инсульту.
- Недостаточность кислородного питания вызывает сильные головные боли, мигрени, обмороки и тошноту.
- Превышение концентрации нитратов в воде становится причиной отравления, нарушения в работе ЖКТ, выделительной и эндокринной системы, разрушения зубной эмали и появления кариеса.
- Опасно давать воду, перенасыщенную нитратами, домашним животным. Ведь подобная жидкость не проходит термической обработки, поэтому может привести к серьезным нарушениям в работе внутренних органов.
Скважина и колодец — главные источники воды для частных домовладений, которая используется в бытовых, хозяйственных и сельскохозяйственных нуждах.
Водный источник может загрязняться в следующих случаях:
- при использовании бытовой химии, сливаемой в грунт вблизи гидротехнического сооружения;
- при проведении сельскохозяйственных работ с применением удобрений, в состав которых входит азот и магний в высокой концентрации;
- при обустройстве кладбищ домашних животных и скота возле водозаборных точек.
Это приводит к насыщению почвы нитратами, которые вначале проникают в водные горизонты, а затем в частные гидросооружения.
Чтобы выбрать эффективный способ водоочистки, необходимо знать норматив, который установлен ВОЗ по ПДК (предельно-допустимой концентрации) нитратов.
Норма нитратов в воде составляет 45 мг на литр, в некоторых европейских государствах норма может быть увеличена до 50 мг на литр. Вода для приготовления пищи и напитков не должна содержать больше 10 мг/л нитратов.
В природных водных источниках содержание солей азотной кислоты не превышает 2 мг/л.
Быстро и качественно удалить нитраты из воды можно профессиональными очистными установками обратного осмоса и ионного обмена.
Подобный метод позволяет убрать большую часть нитратов в воде, добытой из скважины при помощи особых очистных элементов, которые эффективно фильтруют поступающую жидкость. Глубокая фильтрация позволяет задерживать вредные вещества и примеси на мембранах-перегородках.
Процесс очистки повторяется циклично до получения чистой воды, которая выводится в специальный бак, а осадок — в сточный резервуар.
Принцип осмоса основан на разделении жидкого вещества на два раствора, имеющих различную концентрацию. В рабочей системе поддерживается постоянное давление осмоса, которое определяет скорость прохождения жидкости через фильтрующие мембраны.
Система обратного осмоса — инновационный способ фильтрации воды, который позволяет снизить повышенное содержание имеющихся нитратов в воде до нормальных показателей.
Главное преимущество обратного осмоса — надежность конструкции, доступная установка и простота эксплуатации. Установить и настроить подобную систему достаточно просто, кроме того, она не требует больших энергетических и финансовых затрат на свое обслуживание.
Обратный осмос эффективен для снижения уровня нитратов, который превышает 35 г/л, а также для уменьшения сухой остаточной массы в воде.
Главный недостаток подобного способа очистки — высокая цена на готовый комплект. Малогабаритные установки предназначены для монтажа под кухонной мойкой, стандартные установки — для размещения в специальных помещениях. Системы обратного осмоса не менее востребованы в городских квартирах для фильтрации водопроводной воды.
Принцип ионного обмена предусматривает многоступенчатую фильтрацию поступающей жидкости, в результате чего опасные ионы вытесняются полезными соединениями.
Ионообменный фильтр позволяет быстро и качественно очистить воду от нитратных и прочих примесей, а также уменьшить ее жесткость.
Подобная фильтрация успешно используется в промышленности, сельском хозяйстве и быту.
В частном домовладении часто используется одноступенчатая схема ионообменной очистки воды, которая имеет ряд недостатков. В ней задействуется небольшое количество реагентов, которые при этом требуют больших водных ресурсов для промывки ионита от образовавшегося осадка. Кроме того, подобная установка не гарантирует высокое качество фильтрации в отличие от многоступенчатых схем, эффективное воздействие которых зависит от применения кислотных водородных катионов.
Чтобы выбрать наиболее подходящий вариант очистки воды от нитритов, проводятся следующие мероприятия:
- санитарная экспертиза водозаборной точки для выявления возможных источников загрязнения воды, а также способов их нейтрализации;
- лабораторный анализ на определение нитратов в воде, а также полного химического и бактериологического состава.
На основании полученных данных принимается решение о выборе лучшего способа решения подобной проблемы.
От нитратных соединений в воде можно избавиться и другими доступными способами, но указанные в статье, являются самыми результативными. Чтобы обеспечить дом чистой водой и оградить себя от негативного влияния нитратов, стоит заранее позаботиться об установке эффективной и безопасной водоочистной системы.
источник
Цель работы: ознакомление с фотометрическим методом определения нитратов в питьевой, сточной и других видах вод.
1.1. Общие сведения и характеристика метода определения нитратов
Нитраты – соли азотной кислоты, например NaNO3,KNO3, NH4NO3, Mg(NO3)2. Они являются нормальными продуктами обмена азотистых веществ любого живого организма – растительного и животного, поэтому «безнитратных» продуктов в природе не бывает.
Нитраты встречаются почти во всех видах вод. Большое количество нитратов в поверхностных и подземных водах указывает иногда на загрязнение в прошлом фекальными водами. Значительные количества нитратов содержат некоторые промышленные сточные воды. При современной технологии внесения удобрений в почву растения усваивают только 50 % их, остальные уходят со стоком. Азот поступает в почву в нескольких формах. Нитратная форма вследствие подвижности легко вымывается из почвы. Вода с повышенным содержанием нитратов — потенциальная опасность для здоровья животных и человека. Для воды питьевой (ГОСТ 2874-82) содержание нитратов (NO3) должно составлять не более 45 мг/л. Предельно допустимая концентрация (ПДК) нитратов (по азоту) в воде водоемов хозяйственно-питьевого и культурно-бытового водопользования составляет (по ЛПВ)
В производственных сточных водах, а также сельскохозяйственных водах (стоки от животноводческих ферм) содержание нитратов может достигать до 1000 мг/л. Такая сточная вода должна подвергаться очистке на сооружениях перед ее сбросом в поверхностный водоем или повторном использовании в производстве. Внесение больших доз нитратов при несбалансированности по фосфору, калию, молибдену и др. приводит к накоплению нитратов в растениях.
Определение нитратов в грунтовых водах может служить оценкой характера процессов минерализации при фильтровании воды через почвенные соли. При исследовании поверхностных вод по содержанию нитратов можно судить о протекающих процессах самоочищения, а при биологической очистке сточных вод – о процессе нитрификации.
Содержание нитратов в растениях выше 0,5 % представляет потенциальную опасность отравления животных. В кишечнике нитраты способны под действием бактерий переходить в нитриты, которые характеризуются значительной токсичностью. Они способны соединяться с гемоглобином крови вместо кислорода, переводя его в метгемоглобин, препятствующего переносу кислорода кровеносной системой. Это заболевание называется метгемоглобинемией. Поэтому для профилактики загрязнения окружающей среды, особенно в районах высоких норм применения азотных удобрений, необходимо наблюдение за составом грунтовых и поверхностных вод и содержанием в них нитратов.
Вода, забираемая в водопроводную сеть в качестве питьевой, а также для нужд производства, контролируется на содержание нитратов.
В производстве вода, используемая в водооборотных системах, также должна контролироваться на содержание нитратов. Их высокая концентрация может спровоцировать рост водорослей и микроорганизмов в трубопроводах (застойные зоны) и вторичное загрязнение циркулируемой воды в системе продуктами их жизнедеятельности и, соответственно, инициировать процессы биохимической коррозии. Кроме того, биообрастание внутри систем теплообмена снижает теплопередачу и эффективность их работы.
Разработано и применяется несколько способов определения нитратов в воде. Выбор метода зависит от концентрации нитратов и цели исследования.
Хорошие результаты даёт фотометрический метод с применением химического реагента — салицилата натрия. Интервал определяемых концентраций нитратов — 0,1-20 мг/л. Это определение основано на реакции взаимодействия нитратов с салицилатом натрия в среде концентрированной серной кислоты. При этом образуется смесь 3-нитросалициловой и 5-нитросалициловой кислот, соли которых в щелочной среде имеют жёлтую окраску. Фотометрирование желтоокрашенных растворов проводят при длине волны = 410 нм.При необходимости мешающее влияние окрашенных органических веществ устраняют предварительной обработкой пробы суспензией гидроксида алюминия и ее последующего осветления (фильтрования).
1.2. Фотометрический метод анализа
Фотоколориметрический метод анализа основан на измерении интенсивности светового потока, прошедшего через окрашенный раствор (предложен русским ученым В.М. Севергиным, 1795 г.).
Сущность анализа заключается в переводе различных исследуемых соединений (в составе газов, воды и почвы) в раствор с последующим их окрашиванием. Через окрашенный раствор пропускают световой поток и по светопоглощению такого окрашенного раствора определяют содержание окрашенного исследуемого соединения в анализируемом растворе.
Зависимость между интенсивностью окрашивания раствора и содержанием в нем окрашенного соединения может быть выражена зависимостью
| (закон Бугера-Ламберта-Бера), где, | (1) |
— интенсивность света, прошедшего через окрашенный раствор;
— интенсивность падающего света;
— коэффициент поглощения света (зависит от природы окрашенного вещества);
— концентрация окрашенного вещества в растворе;
— толщина слоя светопоглощающего раствора, см.
Если прологарифмировать уравнение (1) и изменить знаки на обратные, то уравнение примет вид:
| (2) |
— называют оптической плотностью (Д) раствора, которая прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
Прибор для фотоколориметрии – ФЭК (фотоэлектроколориметр).
В состав прибора КФК-2 входятLоптическая система) — источник света, светофильтры, линзы, фотоэлемент, преобразователь светового потока в электросигнал на гальванометре, гальванометр, кюветодержатель, ручки (чувствительность и длина волны), набор кювет для растворов.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Устройство и принцип работы фотоэлектроколориметра (КФК-2)
КФК-2 является однолучевым прибором и предназначен для измерения коэффициентов пропускания (в диапазоне длин волн 315-980 нм) и абсорбционности растворов. Пределы измерения коэффициентов пропускания от 100 до 5 % .
На рис. 1 приведена оптическая схема КФК-2.
Рис. 1 Оптическая схема КФК-2
1 — лампа накаливания ; 2 — конденсоры; 3 — диафрагма; 4,5 — объективы; 6,7,8 – светофильтры; 9,11 – защитные стекла ; 10 – кювета с раствором; 12 – фотодиод ; 13 – светофильтр ; 14 – делительная пластина ;15 – фотоэлемент.
Колориметр включают в сеть за 15 минут до начала измерений (кюветное отделение открыто).
Кюветы установленного размера подготавливают к работе следующим образом: рабочие поверхности кювет протирают обезжиривающей смесью. После каждого определения на приборе, кюветы промывают от рабочей смеси дистиллированной водой не менее трех раз и тщательно протирают фильтровальной бумагой.
В приборе КФК используют для измерения две кюветы. Одна – с «холостой» пробой и вторая – для анализа исследуемой пробы. Измерение оптической плотности начинают с «холостой» пробы (Д1), после нее измеряют оптическую плотность окрашенного исследуемого раствора (Д2). Разница между показаниями фиксируется в виде показателя Д – светопропускания. Данная величина будет расти по мере увеличения разницы концентраций «холостой» и контрольной пробами. Графическая зависимость оптической плотности (светопропускания) Д от концентрации анализируемого соединения называется калибровочным графиком. На нем принято указывать дату калибрования на приборе, чувствительность, светофильтр, размер кюветы для раствора.
На приборе левой ручкой устанавливают заданную измерением длину волны (светофильтр), а верхней правой — минимальную чувствительность прибора. В кюветодержатель прибора вставляют кювету с «холостой» пробой (дистиллированная вода + реактивы для определения анализируемого вещества), закрывают крышку кюветного отделения и ручками «чувствительность», «установка 100», «грубо» и «точно» устанавливают ноль по шкале абсорбционности (Д – оптическая плотность). Поворотом ручки кюветодержателя (снизу) кювету с «холостой» пробой заменяют на кювету с рабочим окрашенным раствором. Снимают отсчет по шкале микроамперметра. Измерения одной пробы проводят не менее 3-х раз и окончательное значение измеренной абсорбционности определяют как среднее арифметическое из полученных значений.
2.2. Методика проведения работы
2.2.1. Построение калибровочного графика.
Используя рабочий раствор нитрата калия, согласно таблице 1 готовят серию стандартных растворов, содержащих NO3. Рабочий раствор KNO3 содержит 10 мг/л . Для этого в мерные колбы на 50 мл вносят определенное количество рабочего раствора и доводят дистиллированной водой до метки.
Растворы для приготовления шкалы стандартов при определении
| № колбы | Количество рабочего раствора, мл | Содержание , мг/л |
| 1. | ||
| 2. | 0,2 | |
| 3. | 0,4 | |
| 4. | 0,6 | |
| 5. | 1,0 | |
| 6. | 2,0 | |
| 7. | 3,0 | |
| 8. | 4,0 | |
| 9. | 5,0 | |
| 10. | 6,0 | |
| 11. | 7,0 | |
| 12. | 8,0 | |
| 13. |
В фарфоровые чашки отбирают пробы по 20 мл с различным содержанием NO3, добавляют по 2 мл салицилата натрия и выпаривают на песчаной бане досуха. Затем охлаждают чашки с осадком, добавляют в них по 2 мл концентрированной серной кислоты и оставляют на 10 минут. По истечении этого времени в чашки приливают 15 мл дистиллированной воды, 15 мл раствора едкого натра и сегнетовой соли. Внимание. Реагенты приливать в указанном порядке! Далее полученную смесь количественно переносят в мерные колбы ёмкостью 50 мл, обмывая стенки чашек дистиллированной водой, колбы охлаждают до комнатной температуры.
После охлаждения доводят объём дистиллированной водой до метки и измеряют оптическую плотность растворов при длине 410 нм (фиолетовый фильтр) в кюветах толщиной слоя 5 см. Измерение нужно проводить не позднее, чем через 10 мин. после приливания гидрооксида натрия, в противном случае окраска раствора изменяется.
Для построения калибровочного графика можно сократить количество замеров (колб с пробами) до 4-5 штук.
Калибровочный график строят в координатах: оптическая плотность Д – концентрация нитрат-ионов ( )
2.2.2. Определение нитратов в пробах воды
Проводят анализ проб воды различных источников (по заданию преподавателя).
Перед началом работы необходимо внимательно осмотреть пробу. Если очевидно, что в ней присутствуют окрашенные органические соединения, необходимо отобрать 150 мл пробы, прибавить к ней 3 мл суспензии гидроксида алюминия. После тщательного перемешивания пробу воды отстаивают, затем фильтруют, отбрасывая первые порции фильтрата.
Затем отбирают 20 мл фильтрата и анализируют пробу как указано выше (см. п. 2.2.1.).
Параллельно проводят холостую пробу с 20 мл дистиллированной воды. Результаты анализов заносят в таблицу 2.
2.3. Обработка результатов эксперимента
Обработка результатов измерений ведется МНК с использованием ПЭВМ и представляется в графическом виде (см. рисунок 1) с указанием ошибки в определении ( ).
По полученным данным строится график зависимости оптической плотности Д от концентрации нитратов в пробах (шкала стандартов). На графике приводят данные по условиям анализа (номер светофильтра, толщина кюветы, чувствительность и дату выполнения калибровочного графика).
Рис.2. Калибровочный график
По оптической плотности анализируемых проб воды на калибровочном графике находят содержание нитратов в растворе. По найденным значениям рассчитывают содержание нитрат-ионов в исследуемых пробах (мг/л):
,
где С – концентрация нитрат-ионов, найденная по калибровочной кривой, мг/л;
V – объём пробы, взятой для анализа, мл.
Результаты анализа и расчета концентрации нитратов в пробах воды приводят в таблицу 2.
Результаты анализа воды различного происхождения
| № п/п | Образец пробы воды | Оптическая плотность, Д | Концентрация нитратов, , мг/л |
| Вода водопроводная сырая | |||
| Вода водопроводная кипяченая | |||
| Сточная вода НПЗ | |||
| Сточная вода химкомбината |
1. Построить калибровочный график.
2. Провести анализ проб воды различных источников (по заданию преподавателя).
3. На основании результатов анализа сделать вывод о качестве воды и ее пригодности для целевого использования (питьевое снабжение, водооборотная система производства, сброс в поверхностный водоем).
1. Опасно ли использовать воду как питьевую, если в ней содержание нитратов 35 мг/л?
2. Устройство и принцип работы фотоэлектроколориметра.
3. Теоретические основы колориметрии.
4. Принцип построения калибровочного графика. Точность определения анализируемого компонента.
5. С каким содержанием нитратов (после сооружений очистки сточных вод) можно сбрасывать очищенную сточную воду в поверхностный водоем?
6. Почему вводят ограничения на содержание в воде нитратов?
1. Перед работой ознакомиться с устройством и принципом работы фотоэлектроколориметра (КФК).
2. Всю работу с фарфоровыми чашками проводить только в вытяжном шкафу при включенной тяге.
3. С реактивами работать в резиновых перчатках.
4. Отбор серной кислоты проводить под тягой с помощью пипетки.
5. Реагенты приливать в строго указанном порядке.
6. По окончании работы вымыть руки с мылом.
ОПРЕДЕЛЕНИЕ ФОСФАТОВ В ПРИРОДНОЙ И СТОЧНОЙ ВОДЕ
В сточных водах, как и в природных водах, фосфор может присутствовать в различных видах. В жидкой фазе анализируемой воды он может быть в виде ортофосфорной кислоты и её ионов ( ), в виде мета-, пиро- и полифосфатов органических соединений (нуклеиновых кислот, нуклеопротеиды, фосфоролипиды и др.)
При взаимодействии ортофосфат-ионов с молибдатом в кислой среде образуется жёлтая гетерополикислота, которая под действием восстановителей превращается в интенсивно окрашенное синее соединение. Восстановление можно проводить оловом или аскорбиновой кислотой.
Восстановление аскорбиновой кислотой, сравнительно слабым восстановителем, происходит только при повышенной температуре, т.е. в условиях, когда полифосфат и органические эфиры фосфорной кислоты гидролизуются с образованием ортофосфорной кислоты. Для ускорения реакции при комнатной температуре и интенсификации окраски вводят соль сурьмы (антимонилтартрат калия – КSbH4O6·0,5H2O).
Мешающие вещества. Сильнокислые и сильнощелочные пробы предварительно нейтрализуют. Определению мешают сульфиды и Н2S, в концентрации, превышающих 3 мг/л. Мешающие влиянию можно устранить, прибавляя несколько мг КMnО4 на 100 мл пробы и встряхивая 1-2 мин; раствор должен быть розовым. Затем прибавляют требуемые для определения реактивы, но в обратном порядке: сначала раствор аскорбиновой кислоты, перемешивают и вливают раствор молибтана.
Для устранения влияния нитритов вводят сульфаминовой кислоты, которую вводят в состав применяемого реактива. При большом содержании железа следует ввести эквивалентное количество ЭДТА.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Концентрацию фосфатов определяем в питьевой и сточной воде.
К 50 мл пробы, профильтрованной в день отбора через мембранный фильтр № 1 или через плотный бумажный фильтр (синяя лента), приливают 2 мл смешанного раствора через короткое время – 0,5 мл раствора аскорбиновой кислоты (в присутствии мешающих веществ, реактивы приливают в обратном порядке). Смесь перемешивают. Одновременно проводят холостое определение с 50 мл дистиллированной воды. Через 15 мин (20 мин.) определяют оптическую плотность. Измерение проводят при = 800 нм или при максимально возможном для данного прибора значении.
Содержание растворённых неорганических фосфатов (мг/л) ( ) определяют по формуле:
где С – концентрация фосфатов, определённая по калибровочной кривой, мг/л;
V – объём пробы, взятой для анализа, мл.
В диапазоне концентраций до 1 мг/л результаты округляют до сотых долей мг/л, свыше 1 мг/л – до десятых долей мг/л.
Построение калибровочного графика
Берут 0; 1,0; 2,5; 5,0…..50,0 мл рабочего стандартного раствора 2 фосфата калия, разбавляют каждый раствор до 50 мл дистиллированной Н2О и далее продолжают, как в ходе определения (общее содержание растворённых ортофосфатов, найденных экспериментально, выражают в мг/л ).
Измеряют оптическую плотность и строят график зависимости оптической плотности от концентрации ионов фосфорной кислоты.
Построение калибровочной кривой.
| Реактивы | Номер мерной колбы | |||||
| Количество ст. раствора 2, мл | 1,0 | 2,5 | 5,0 | 10,0 | ||
| Количество дист. Н2О, мл | 49,0 | 47,5 | 45,0 | 40,0 | 25,0 | |
| Содержание , мг/л | 0,02 | 0,05 | 0,1 | 0,2 | 0,5 | 1,0 |
1. Построить калибровочную кривую в диапазоне 0-1 мг/л (табл.1).
2. Провести определение фосфата в водопроводной воде (сравнить данные с ГОСТ на воду питьевую).
3. Рассчитать и построить калибровочную кривую на содержание фосфатов до 50 мг/л.
4. Провести определение содержание в пробе сточной воды (с учётом мешающего влияния отдельных компонентов сточной воды).
Давление насыщенного водяного пара
при температурах от 10 до 39 °С
| , °C | , мм.рт.ст. | , °C | , мм.рт.ст. | , °C | , мм.рт.ст. |
| 9.2 9.8 10.5 11.2 12.0 12.8 13.6 14.5 15.5 16.5 | 17.5 18.7 19.8 21.1 22.4 23.8 25.2 26.7 28.3 30.0 | 31.8 33.7 35.7 37.7 39.9 42.2 44.6 47.1 49.7 52.4 |
| Формула | Плотность, г/см 3 | Формула | Плотность, г/см 3 | Формула | Плотность, г/см 3 |
| Al Be Cd Co Cr Cu Fe | 2.70 1.85 8.64 8.80 7.16 8.93 7.86 | Mg Mn Mo Nb Ni Pb Si | 1.74 7.30 10.23 8.56 8.90 11.34 2.00 | Sn Ta Ti V W Zn Zr | 7.30 16.60 4.54 6.11 19.3 7.14 6.50 |
Десятибалльная шкала коррозионной стойкости металлов
| Группа стойкости | Скорость коррозии металла, мм/год | Балл |
| Совершенно стойкие Весьма стойкие Стойкие Пониженно-стойкие Малостойкие Нестойкие | Менее 0,001 Свыше 0,001 до 0,005 Свыше 0,005 до 0,01 Свыше 0,01 до 0,05 Свыше 0,05 до 0,1 Свыше 0,1 до 0,5 Свыше 0,5 до 1,0 Свыше 1,0 до 5,0 Свыше 5,0 до 10,0 Свыше 10,0 |
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Как то на паре, один преподаватель сказал, когда лекция заканчивалась — это был конец пары: «Что-то тут концом пахнет». 8103 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Фотометрический метод определения массовой концентрации нитрат-иона основан на взаимодействии нитрат-ионов с салициловой кислотой с образованием желтого комплексного соединения.
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведенных в таблице 1.
Диапазон измерений, значения показателей точности, повторяемости и воспроизводимости
Показатель точности (границы относительной погрешности при вероятности Р = 0,95), ± d , %
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости) s r, %
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости), s R, %
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
Спектрофотометр или фотоэлектроколориметр, позволяющие измерять светопоглощение при значениях l = 410 нм.
ГСО c аттестованным содержанием нитрат-ионов.
Кюветы кварцевые с толщиной поглощающего слоя 20 мм.
Весы лабораторные, 2 кл. точности ГОСТ 24104.
Колбы мерные наливные 2-50-2
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Стаканчики для взвешивания СВ ГОСТ 25336.
Стаканы термостойкие В-1-1000
Пробирки колориметрические П-2-10-0,1 ХС ГОСТ 1770.
3.2 . Вспомогательное оборудование, материалы
Сушильный шкаф электрический ОСТ 16.0.801.397.
Чашки выпарительные фарфоровые ГОСТ 9147.
Фильтры обеззоленные ТУ 6-09-1678.
Бутыли из стекла или полиэтилена с притертыми или винтовыми пробками вместимостью 500 — 1000 см 3 для отбора и хранения проб.
Активированный уголь БАУ-Э, ТУ 6-16-3075.
Натрий салициловокислый ГОСТ 17628 G ) .
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Калий-натрий виннокислый 4-водный (Сегнетова соль) ГОСТ 5845.
Серебро сернокислое ТУ 6-09-3703.
Все реактивы должны быть квалификации х.ч. или ч.д.а. и не содержать примесей нитрат-ионов.
4.1 . При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007 .
4.2 . Электробезопасность при работе с электроустановками по ГОСТ 12.1.019 .
4.3 . Организация обучения работающих безопасности труда по ГОСТ 12.0.004 .
4.4 . Помещение лаборатории должно соответствовать пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009 .
Выполнение измерений может производить химик-аналитик, владеющий техникой фотометрического и спектрофотометрического анализов, изучивший инструкцию по работе с соответствующими приборами.
Измерения проводятся в следующих условиях:
температура окружающего воздуха (20 ± 5) °С;
относительная влажность (80 ± 5) %;
атмосферное давление (84 — 106) кПа (630 — 800 мм рт.ст.);
частота переменного тока (50 ± 1) Гц;
напряжение в сети (220 ± 10) В.
7.1 . Подготовка посуды для отбора проб
Бутыли для отбора и хранения проб воды обезжиривают раствором CMC, промывают водопроводной водой, хромовой смесью, опять водопроводной водой, а затем 3 — 4 раза дистиллированной водой.
Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб». G )
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Пробы воды (объем не менее 200 см 3 ) отбирают в стеклянные или полиэтиленовые бутыли, предварительно ополоснутые отбираемой водой.
Если определение нитратов производят в день отбора пробы, то консервирование не требуется.
Если проба не будет проанализирована в день отбора, то ее консервируют добавлением концентрированной серной кислоты (на 1 дм 3 воды — 1 см 3 H 2 SO 4 конц.). Консервированная проба может храниться не более 2 суток при температуре (3 — 4) °С.
Проба воды не должна подвергаться воздействию прямого солнечного света. Для доставки в лабораторию сосуды с пробами упаковывают в тару, обеспечивающую сохранность и предохраняющую от резких перепадов температуры. При отборе проб составляют сопроводительный документ по утвержденной форме, в котором указывают:
— цель анализа, предполагаемые загрязнители;
— должность, фамилия отбирающего пробу, дата.
7.3 . Подготовка прибора к работе
Подготовку спектрофотометра или фотоэлектроколориметра к работе проводят в соответствии с рабочей инструкцией по эксплуатации прибора.
7.4 . Освобождение от мешающих влияний
1. Взвешенные, окрашен. органические вещества. Железо(> 5 мг/дм 3 )
К 150 см 3 пробы добавить 3 см 3 гидроксида алюминия, пробу перемешивают, дают отстояться и фильтруют через фильтр «белая лента», отбрасывая первую порцию фильтрата.
В ходе анализа добавляют сернокислое серебро в количестве, эквивалентном содержанию хлорид-иона. Осадок хлорида серебра отфильтровывают через фильтр «белая лента».
К 20 см 3 пробы добавляют 0,05 г сернокислого аммония и упаривают досуха на водяной бане, доводят до первоначального объема дистиллированной водой.
Основной раствор нитрат-ионов.
Навеску (0,1631 г) калия азотнокислого, предварительно высушенного при 105 °С, помещают в стакан вместимостью 100 см 3 , растворяют в 50 см 3 дистиллированной воды, переносят в мерную колбу вместимостью 1000 см 3 и доводят до метки дистиллированной водой.
1 см 3 содержит 0,1 мг нитрат-ионов. Раствор устойчив в течение 3 мес.
При наличии ГСО: раствор готовят в соответствии с прилагаемой к образцу инструкцией.
1 см 3 раствора должен содержать 0,1 мг нитрат-ионов.
Рабочий раствор нитрат-ионов.
10 ,0 см 3 основного раствора нитрат-ионов переносят в мерную колбу на 100 см 3 и доводят до метки дистиллированной водой.
1 см 3 раствора содержит 0,01 мг нитрат-ионов. Раствор готовят в день проведения анализа.
Раствор гидроксида натрия и сегнетовой соли.
400 г гидроксида натрия и 60 г сегнетовой соли помещают в стакан вместимостью 1000 см 3 , растворяют в 500 см 3 дистиллированной воды, охлаждают, переносят в мерную колбу вместимостью 1000 см 3 G ) и доводят до метки дистиллированной водой G ) .
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Раствор салициловой кислоты (о-гидроксибензойной).
Навеску (1,0 г) салициловой кислоты помещают в стакан вместимостью 100 см 3 , растворяют в 50 см 3 этилового спирта, переносят в мерную колбу вместимостью 100 см 3 , доводят до метки этиловым спиртом. Раствор готовят в день использования.
Навеску (0,5 г) натрия салициловокислого растворяют в 100 см 3 дистиллированной воды. Раствор готовят в день использования G ) .
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Суспензия гидроксида алюминия.
125 г алюмоаммонийных или алюмокалиевых квасцов растворяют в 1 дм 3 дистиллированной воды, раствор нагревают до 60 °С и медленно при непрерывном перемешивании прибавляют 55 см 3 концентрированного раствора аммиака. Дают смеси отстояться около 1 часа, фильтруют и промывают осадок гидроксида алюминия многократной декантацией дистиллированной водой до полного удаления свободного аммиака.
7.6 . Приготовление градуировочных растворов
В ряд колориметрических пробирок на 10 см 3 отбирают последовательно пипеткой 0,1; 0,5; 1,0; 2,0; 4,0; 6,0; 10,0 см 3 рабочего раствора нитрат-иона (0,01 мг/см 3 ) и доводят дистиллированной водой до метки. G ) Содержание нитрат-ионов в растворах соответственно равно 0,1; 0,5; 1,0; 2,0; 4,0; 6,0; 10,0 мг/дм 3 G ) .
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Растворы переносят в фарфоровые чашки, добавляют 2 см 3 раствора салициловой кислоты (или 2 см 3 раствора натрия салициловокислого) и выпаривают в фарфоровой чашке на водяной бане досуха. После охлаждения сухой остаток смешивают с 2 см 3 серной кислоты и оставляют на 10 мин. Затем содержимое чашки разбавляют 10 — 15 см 3 дистиллированной воды, приливают приблизительно 15 см 3 раствора гидроксида натрия и сегнетовой соли, переносят в мерную колбу вместимостью 50 см 3 , смывая стенки чашки дистиллированной водой, охлаждают колбу в холодной воде до комнатной температуры, доводят дистиллированной водой до метки и полученный окрашенный раствор сразу фотометрируют при l = 410 нм в кюветах с толщиной поглощающего слоя 20 мм. Одновременно с обработкой градуировочных растворов проводят «холостой опыт» с дистиллированной водой, который используют в качестве раствора сравнения.
Градуировочный график строят методом наименьших квадратов в координатах: А — оптическая плотность; С — концентрация нитрат-ионов в градуировочном растворе (мг/дм 3 ).
7.7 . Контроль стабильности градуировочной характеристики
Контроль стабильности градуировочной характеристики проводят не реже одного раза в квартал или при смене партий реактивов. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в п. 7.6).
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
где Х — результат контрольного измерения массовой концентрации нитрат-ионов в образце для градуировки;
С — аттестованное значение массовой концентрации нитрат-ионов;
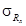
Примечание . Допустимо среднеквадратическое отклонение внутрилабораторной прецизионности при внедрении методики в лаборатории устанавливать на основе выражения: 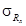
Значения s R приведены в таблице 1.
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
Пробу объемом 150 см 3 обрабатывают как указано в п. 7.4. Для анализа используют фильтрат. Его объем может составлять 5,0 — 10 см 3 в зависимости от концентрации нитрат-ионов в воде. Далее поступают, как описано в пункте 7.6. При анализе пробы воды выполняют не менее двух параллельных определений.
Содержание нитрат-ионов, X , мг/дм 3 вычисляют по формуле:
где С — содержание нитрат-ионов, найденное по графику, мг/дм 3 ;
V — объем исследуемой пробы, взятой на анализ, дм 3 .
За результат анализа Хср принимают среднее арифметическое значение двух параллельных определений Х1 и X 2
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 2.
Значения предела повторяемости при вероятности Р = 0,95
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
источник
Нитраты – это соли азотной кислоты.
Повышенное содержание данной примеси чаще всего встречается в колодцах, неглубоких скважинах, реках и озерах. Нитраты не располагаются на глубоких уровнях, они практически отсутствуют в артезианской воде. Перед использованием такой воды в хозяйственных нуждах убедитесь в том, что содержание нитратов не превышает норму. В противном случае возникает риск для здоровья и жизни человека.
- Поступление в грунт отходов от бытовой химии
- Поступление в почву отходов от удобрений с высоким содержанием азота
- Процесс разложения захороненных животных около водоемов
Сами по себе нитраты не опасны. Главная опасность связана с переходом нитратов нитриты, которые, взаимодействую с гемоглобином (образуя метгемоглобин), препятствуют нормальному дыханию и приводят в кислородному голоданию.
Если метгемоглобин в плазме крови превышает 30%, то возникает сильное отравление организма, больше 50% — смерть.
Нормы нитратов в воде определены ВОЗ. Предельно допустимое содержание нитратов в воде составляет 45 мг на литр. Нитратов в питьевой воде не должно быть более 10 мг на литр.
Определить нитраты в воде можно при помощи специального оборудования. Рассмотрим основные способы:
- Спектрофотометрия – изучение спектров материала и их способности к поглощению излучения
- Флуориметрия – определение концентрации вещества путем облучения
- Потенциометрия – измерение электродвижущих сил
- Кондуктометрия – измерение электропроводности растворов
- Хроматография – разделение и анализ смеси
- Слить воду сильным напором в течении 5-10 минут
- Промыть тару несколько раз без моющего средства
- Настроить напор тонкой струей и отобрать 1,5-2 литра исходной воды в емкость
- Наполнить тару до краев и закрыть крышкой
- Оперативно доставить в лабораторию
- Очистка обратным осмосом – очистные элементы убирают большую часть нитратов в воде, вредные вещества задерживаются на мембранных перегородках
- Очистка ионным обменом – многоступенчатая фильтрация жидкости с вытеснением вредных элементов
Лаборатория «ИОН» проводит анализ в Москве и Московской области, благодаря которому вы сможете узнать состояние вашей воды и способы улучшения ее качества.
- Работаем более 20 лет
- Выполняем химический и микробиологический анализ
- Ведем деятельность по разработке новых методов диагностики веществ и материалов
- В штат лаборатории входят лучшие специалисты страны
- Располагаем самым современным приборным парком
- Сотрудничаем с крупнейшими разработчиками аналитического оборудования
- Занимаемся исследованием всех видов вод: талой, морской, речной, озерной, питьевой, технологической, для хозяйственных нужд и из мест общего пользования
Мы гарантируем качественную работу в установленные сроки!
© 1997-2019 — Лаборатория ИОН. Все права защищены.
Для химического анализа необходимо заполнить водой чистую пластиковую тару (оптимально 1,5 л). Использовать бутылки из-под сладких, газированных или ароматизированных напитков, а также солёной или минеральной воды недопустимо.
Если выбранный Вами анализ включает определение содержания нефтепродуктов, необходимо заполнить дополнительную стеклянную тару объемом 0,2 л.
Если выбранный Вами анализ включает определение содержания сероводорода, необходимо заполнить дополнительную стеклянную тару объемом 0,5 л (необходимо использовать консервант).
При отборе воды из проточного источника, непосредственно перед отбором необходимо пролить воду сильной струёй в течение 3-5 минут. Перед отбором проб ёмкости и крышки необходимо 3 раза промыть изнутри водой, подлежащей анализу. Использование моющих средств недопустимо. Наполнять тару необходимо тонкой струёй по стенке сосуда «под горлышко». Это снижает насыщение воды кислородом и предотвращает протекание реакций.
Для микробиологического анализа необходимо использовать стерильный контейнер для биоматериалов объемом 150-200 мл.
Перед взятием пробы необходимо протереть водопроводный кран спиртовой салфеткой, уделив особое внимание месту выхода воды.
При отборе воды из водопровода, скважины или колонки необходимо пролить воду сильной струёй в течение 3–5 минут.
При отборе воды из колодца с помощью ведра необходимо обдать ведро кипятком для дезинфекции. Отбор пробы через поливочные шланги и предметы, контактирующие с почвой, не допускается.
Для отбора пробы необходимо надеть перчатки и вскрыть упаковку стерильного контейнера. Не касаясь внутренней поверхности ёмкости, отобрать образец воды (2/3 объема контейнера) и закрыть крышкой.
Рекомендуем доставлять пробу сразу после отбора.
Если сразу после отбора нет возможности доставить пробу в лабораторию, допускается хранение образцов при температуре 2–10 °C в течение 1 суток.
Съезд на ул. Руставели, на первом светофоре поворот налево на ул. Яблочкова.
Через 300 м поворот направо на ул. Гончарова, через 500 м поворот налево (напротив дома №6), через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Поворот на ул. Руставели, на светофоре поворот направо на ул. Добролюбова, через 300м на светофоре поворот налево на ул. Гончарова, напротив дома №6 поворот направо, через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Двигаясь по ул. Милошенкова, поворачиваем на ул. Добролюбова
Через 150 метров поворот направо, за домом 21АкБ поворот налево, через 100-120 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Ближайшее станция метро – Фонвизинская (600 м)
Последний вагон из центра. Выход в сторону улицы Фонвизина. Из стеклянный дверей направо. Перейти через пешеходный переход и идти через дворы в соответствии со схемой. Пункт назначения — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Анализ «Минимальный» содержит минимальный и обязательный перечень загрязнителей, часто встречающихся в питьевой воде, и включает 16 показателей:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний;
- анионы: нитраты, карбонат, гидрокарбонат.
Данный набор рекомендуется для исследования воды хозяйственно-бытового назначения. Анализ «Минимальный» не обладает достаточной информативностью для подбора системы водоочистки, так как не позволяет получить полную картину о безопасности воды. Если Вы планируете использовать воду в питьевых целях, рекомендуем обратить внимание на наборы, содержащие большее число параметров.
- Точность определения
- Подходит для воды, применяемой в хоз-бытовом назначении
- Срок выполнения — 3-4 рабочих дня
- Не подходит для воды, применяемой в питьевых целях
- Не подходит для корректного подбора фильтров
- Не содержит определения опасных загрязнителей
Анализ «Начальный» предназначен для выявления наиболее часто встречающихся вредных веществ в питьевой воде и включает 23 параметра: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность свободная, щелочность общая, железо, марганец, калий, магний, кальций, фториды, хлориды, нитраты, сульфаты, карбонат, гидрокарбонат, аммоний Данный анализ рекомендуется для оценки качества воды из колодцев, скважин, родников. По протоколу анализа «Начальный» возможен подбор системы водоочистки и типа фильтрующей загрузки. В перечень определяемых параметров входят органолептические показатели, общие химические показатели, а также содержание катионов и анионов
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
- Не содержит перечень тяжелых металлов
- Не содержит перечень всех опасных загрязнений
- Срок выполнения исследований 5-6 рабочих дней
Анализ «Расширенный» содержит перечень наиболее часто встречающихся загрязнителей воды, вне зависимости от источника, и включает 31 показатель: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, алюминий, железо общее, магний, кальций, калий, натрий, марганец, медь, мышьяк, свинец, кадмий, цинк, стронций, фториды, хлориды, нитраты, сульфаты, гидрокарбонат, карбонат. Данный набор рекомендуется, в первую очередь, владельцам колодцев и скважин. Содержит перечень основных тяжелых металлов. Перед покупкой системы водоподготовки рекомендуем провести исследование воды с данным перечнем загрязнителей. Ориентируясь на полученную информацию, Вы сможете подобрать оборудование водоочистки с эффективностью до 98%, а так же корректно его настроить.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Содержит перечень тяжелых металлов
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
Анализ «Максимальный» содержит полный перечень опасных для здоровья человека веществ, встречающихся в воде, поступающих из скважин или колодцев, включая ионы тяжелых металлов и органические вещества, а именно: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, натрий, калий, магний, кальций, алюминий, железо, марганец, литий, барий, бериллий, бор, ванадий, молибден, кобальт, цинк, никель, хром, стронций, кадмий, мышьяк, медь, свинец, кремний, серебро, титан, ртуть, гиброкарбонат, карбонат, нитрат, хлорид, сульфат, фосфат, фторид, нитрит, сероводород, сульфид, гидросульфид, хлор общий, хлор остаточный, хлор остаточный свободный, АПАВ, нефтепродукты, фенол, формальдегид, бензол, толуол, о-ксилол, п-ксилол, м-ксилол, стирол Данное исследование рекомендуется для клиентов, которые серьезно относятся к выбору питьевой воды. Протокол анализа «Максимальный» позволяет со 100% уверенностью сделать вывод о пригодности воды для питья и приготовления пищи. Результаты исследования позволяют выбрать схему водоочиски, а также оценить эффективность уже установленного оборудования.
Воды, применяемой в хозяйственно-бытовом назначении; оценки работы системы водоочистки.
пластиковая бутылка 1,5 — 2 л.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для любых источников воды
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Включает полный перечень тяжелых металлов
- Позволяет корректно и экономично настроить водоочистное оборудование
- Содержит полный перечень опасных органических веществ
Помимо хичиеского анализа воды мы настоятельно рекомендуем провести микробиологическое исследование Вашей воды. Микробиологический анализ воды включает определение общего микробного числа (ОМЧ), количества общих колиформных и колиформных термотолерантных бактерий.
источник