Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
6) состав растворенных газов.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей.
Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или
12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO3 2 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO3 2 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общая жесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам:
Общая жесткость
Карбонатная жесткость равна концентрации (мг/л) [HCO3 – ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:

Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК = ЖО – ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Окисляемостьхарактеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества.
Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме
требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л.
При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Солевой состав.При анализе природных вод определяют содержание в них преимущественно главных ионов: Cl – , SO4 2– , HCO3 – , CO3 2– , Ca 2+ , Mg 2+ , K + , Na + .
Определение ионаCl – .В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO4 2– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO4 2– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO4 2– .
Определение ионов CO3 2– иHCO3 – . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии.
Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO3 2 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО3 2– и НСО3 – , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния:
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)


образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет.
Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:
Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна:
rNa + + rK + + rCa 2+ + rMg 2+ = rCO3 2- + rHCO3 – + rSO4 2 + rCl –
rNa + + rK + = rCO3 2– + rHCO3 – + rSO4 2 + rCl – – rCa 2+ – rMg 2+
С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка.
Растворенные в воде газы определяют химическими методами или газовой хроматографией.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
Определение растворенного кислорода производится йодометрическим методом.
Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом:
Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе:
Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия:
I2 + 2Na2S2O3
Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II):
Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску.
В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания.
Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом.
В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом:
К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе.
Дата добавления: 2016-07-29 ; просмотров: 824 | Нарушение авторских прав
источник
Определение концентрации водородных ионов (рН). Определение рН в полевых условиях проводят колориметрическим методом. Этот метод основан на свойствах индикаторов принимать определенную окраску в зависимости от концентрации рН в растворе. Опыт показывает, что лучше всего для этих целей применять универсальный индикатор. Для определения рН полоску индикаторной бумаги пропитывают исследуемой водой и появившееся окрашивание сравнивают со стандартной цветовой шкалой.
В лабораторных условиях можно также измерить рН с помощью рН-метра (потенциометрический метод). Этот метод определения рН растворов основан на измерении с помощью потенциометра и двух электродов э. д. с. концентрационной цепи. Причем шкала потенциометра проградуирована и в единицах рН, и в милливольтах.
Для измерения рН в интервале 1-14 используют потенциометры различных типов со стеклянными измерительными электродами. Стеклянный электрод представляет собой стеклянную трубочку, заканчивающуюся стеклянным шариком, заполненным HCl с молярной концентрацией эквивалента о,1 моль/л, в которую погружена серебряная проволочка, покрытая AgCl (хлорсеребряный электрод). На границе раздела стекло-раствор возникает скачок потенциала, величина которого зависит от состава стеклянного шарика и активной концентрации водородных ионов в растворе. Ионы щелочных металлов, входящих в состав электродного стекла, могут обмениваться на ионы водорода в растворе. При определенных условиях устанавливается равновесие между ионами водорода, вошедшими в поверхностный слой стекла, и ионами водорода в испытуемом растворе. Величина потенциала будет определяться соотношением активностей ионов водорода в стекле и растворе.
В качестве внутреннего вспомогательного электрода используют хлорсеребряный электрод в стандартном растворе соляной кислоты.
Открытие катионов аммония (NH4+). Для определения катионов аммония на предметное стекло помещают несколько капель проверяемой воды и добавляют 2-3 капли раствора щелочи (NaOH или KOH). Держа стекло высоко над пламенем, раствор слегка нагревают. При нагревании со щелочами аммонийные соли, содержащиеся в природной воде, выделяют аммиак, который легко обнаруживают по характерному запаху:
NH4OH + NaOH > NH3^ + H2O + NaCl;
Для определения аммиака можно использовать также влажную красную лакмусовую бумажку (ее посинение означает наличие аммиака).
Открытие катионов меди (Сu2+). В пробирку с 5 мл раствора бромистого калия осторожно приливают равный объем концентрированной серной кислоты. После охлаждения пробирки к содержимому добавляют 5 мл исследуемой воды. При наличии в воде катионов меди в растворе образуется сине-фиолетовое кольцо:
CuSO4 + 2KBr > CuBr2v + K2SO4;
Открытие катионов кальция (Ca2+). К 5 мл исследуемой воды прибавить каплю уксусной кислоты. После непродолжительного нагревания добавить три капли раствора щавелевокислого аммония и каплю водного раствора аммиака. При наличии катионов кальция выпадает белый кристаллический осадок кальций оксалата, нерастворимый в воде и в уксусной кислоте:
(NH4)2С2О4 + СaСl2 > 2NH4Сl +СaС2О4v;
Открытие катионов двухвалентного железа (Fe2+). К 5 мл исследуемой воды прибавляют 0,1 г калий сульфата и около 1 г красной кровяной соли ( K3[Fe(CN)6] ). В присутствии ионов двухва-лентного железа появляется сине-зеленое окрашивание:
3Fe2+ + 2K3[Fe(CN)6] > Fe3[Fe(CN)6]2v + 6K+.
Примерное содержание двухвалентного железа определяется по цвету раствора (табл.6).
источник
Химический анализ подземных вод может служить качественным показателем использования воды для хозяйственно-питьевого водоснабжения, бальнеологических, промышленных и хозяйственных целей, а также диагностическим признаком при гидрохимических методах поисков и разведки месторождений полезных ископаемых.
Результаты химического анализа подземных вод могут быть выражены в табличной или сокращенной отчетной форме в виде формулы Курлова.
1). Табличная форма выражения химического анализа.
Количественно концентрация катионов и анионов выражается в г/дм 3 , мг/дм 3 , а эквивалентное содержание – миллимолях (ммоль) и процентах (%).
Пример расчета химического анализа воды в табличной форме приводится ниже.
| Ионы | Содержание, мг/дм 3 | Эквивалентное содержание | |
| ммоль | % | ||
| Na + Ca 2+ Mg 2+ | 88,04 22,75 15,62 | 69,9 17,6 12,5 | |
| Сумма катионов | — | 126,41 | |
| Cl — SO4 2 — HCO3 — | 98,40 17,43 3,51 | 82,5 14,5 3,0 | |
| Сумма анионов | — | 119,34 | |
| М (сухой остаток) | — | — | |
| СО2(свободный) | — | — | |
| рН водородный показатель | 5,3 | — | — |
| Т воды, градус С | — | — |
Эквивалентное (молярное) содержание определяется путем умножения каждого иона на пересчетный коэффициент, учитывающий его атомный вес и валентность и представляющий собой величины, обратные эквивалентным массам ионов (таблица 2).
| Катионы | Коэффициент | Анионы | Коэффициент |
| Na + Ca 2+ Mg 2+ | 0,0435 0,0499 0,08222 | Cl — SO4 2- HCO3 — | 0,0282 0,0208 0,0164 |
Для пересчета в %-эквивалентную форму суммы катионов и анионов в миллимолях принимаются за 100%, а затем определяется доля каждого катиона и аниона в % от соответствующей суммы катионов и анионов.
Химический анализ считается достоверным, если ошибка анализа не превышает 5%.
В нашем случае С = 2,88%. Анализ достоверен.
2) Сокращенная форма выражения химического анализа (формула М.Г. Курлова)
Формула Курлова представляет собой псевдодробь, в числителе которой в порядке убывания в %-эквивалентной форме располагаются анионы, а в знаменателе – катионы. Ионы, содержание которых менее 1%, в формулу не включаются. Проценты округляют до целых чисел.
Слева от дроби указывается содержание газов в мг/дм 3 и минерализация (М) в г/дм 3 , за которую принимается сухой остаток. Справа записывают значение (рН), температуру воды (Т) в градусах Цельсия, дебит источника в м 3 /сут и содержание микроэлементов, если такие имеются.
В нашем случае формула Курлова (таблица 1):
3) Наименование воды по химическому составу.
Наименование химического типа подземных вод должно состоять из двух частей, отражающих преобладающий анионный и катионный состав воды. Наименование химического типа воды начинается с ее анионного, а затем катионного состава в %-эквивалентной форме, превышающего 20% от суммы миллимолярной концентрации. Перечисление ионов производится в порядке возрастания концентрации – от меньшего значения к большему.
В сокращенном анализе анионы представлены хлоридами, сульфатами и гидрокарбонатами, а катионы – натрием, кальцием и магнием. В нашем случае вода хлоридно-натриевая.
4) Классификация воды по минерализации.
В зависимости от величины минерализации, за которую принимается сухой остаток, подземные воды классифицируются в соответствии с приведенной таблицей 3.
| Минерализация М, г/дм 3 | Подгруппа | Группа |
| £ 0,5 >0,5-1,0 | Весьма пресные Пресные | Пресные |
| >1,0-1,5 >1,5-3,0 >3,0-5,0 >5,0-10,0 >10,0-25,0 | Весьма слабосолоноватые Слабо солоноватые Умеренно солоноватые Солоноватые Сильно солоноватые | Солоноватые |
| >25,0-36,0 >36,0-50,0 | Слабосоленые Сильносоленые | Соленые |
| >50,0-150,0 >150,0-350,0 >350,0 | Рассолы слабые Рассолы крепкие Рассолы весьма крепкие (рапа) | Рассолы |
В нашем случае М = 6,9 г/дм 3 . Вода солоноватая.
Реакция воды обусловлена величиной концентрации водородных ионов рН, которая представляет собой обратный логарифм концентрации ионов водорода. Классификация воды по водородному показателю приведена в таблице 4.
| Водородный показатель рН при Т22 о С | Подгруппа | Группа |
| £ 3,5 >3,5-4,5 >4,5-5,5 >5,5-6,0 | Весьма кислая Кислая Умеренно кислая Слабокислая | Кислая |
| >6,0-8,0 | Нейтральная | Нейтральная |
| >8,0-8,5 >8,5-9,0 >9,0-9,5 >9,5 | Слабощелочная Умеренно щелочная Щелочная Весьма щелочная | Щелочная |
В нашем случае рН = 5,3. Вода умеренно кислая.
6) Классификация подземных вод по температуре воды.
Классификация воды по температуре приведена в таблице 5.
| Температура, Т о С | Наименование |
| 0-4 >4-20 >20-37 >37-50 >50-75 >75-100 >100-200 >200-374 | Переохлажденная Очень холодная Холодная Теплая Очень теплая Горячая Очень горячая Слабо перегретая Весьма перегретая |
Примечание: воды с температурой от 20 до 100 о С называются термальными.
В нашем случае Т15 о С. Вода холодная.
Жесткость воды имеет большое значение при использовании подземных вод для питьевого водоснабжения, промышленных и хозяйственных целей. Жесткость воды обусловливается содержанием в ней солей кальция и магния. Измеряется в миллимолях (мг-экв/дм 3 ).
Различают общую жесткость (ОЖ), устранимую или временную жесткость (УЖ) и постоянную жесткость (ПЖ).
Общая жесткость обусловлена присутствием в воде гидрокарбонатов, хлоридов и сульфатов кальция и магния и равняется сумме устранимой и постоянной жесткости.
Устранимая жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния. Такая жесткость получила название карбонатной (КЖ) и может быть устранена при кипячении
Карбонат кальция и магния выпадает в осадок, образуя накипь. При использовании такой воды для промышленных и коммунальных целей происходит отложение карбоната кальция и магния на стенках котлов и трубопроводов, что приводит к выводу их из эксплуатации.
При высоком содержании НСО3 — в воде, превышающем суммарную концентрацию кальция и магния, вся жесткость считается карбонатной.
Постоянная жесткость обусловлена наличием в воде сульфатов и хлоридов кальция и магния и равняется разности между общей и карбонатной жесткостью.
Классификация воды по общей жесткости приводится в таблице 6 (ГОСТ 6055-86).
| Содержание в ммоль | Группа жесткости |
| £ 1,5 >1,5-3,0 >3,0-6,0 >6,0-9,0 >9,0 | Очень мягкая Мягкая Умеренно жесткая Жесткая Очень жесткая |
Подземные воды, жесткость которых превышает 7 ммоль, не могут быть использованы для питьевого и промышленного водоснабжения.
В нашем случае общая жесткость составляет 38,37 ммоль, устранимая (карбонатная) – 3,50 ммоль, постоянная – 34,86 ммоль. Вода очень жесткая, непригодная для питьевого и промышленного водоснабжения.
8) Пригодность для питьевого водоснабжения.
Пригодность воды для питьевого водоснабжения нормируется ГОСТ 6055-86 «Вода питьевая». В рамках сокращенного гидрохимического анализа нормативными являются минерализация, общая жесткость, содержание Cl — и SO 2- 4 , а также величина рН с предельно допустимыми концентрациями, приведенными в таблице 7.
| Наименование показателей | ПДК | Содержание в нашем примере | Степень пригодности |
Минерализация М, мг/дм 3 Общая жесткость ОЖ, ммоль 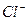 , мг/дм 3 , мг/дм 3 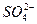 , мг/дм 3 рН , мг/дм 3 рН | 6,5-8,5 | 38,37 5,3 | Не пригодна Не пригодна Не пригодна Не пригодна Не пригодна |
В нашем случае вода по всем компонентам не пригодна для водоснабжения.
9) Пригодность для ирригационных целей.
Пригодность использования подземных вод, в том числе и шахтных, для ирригационных целей в сельском хозяйстве нормируется степенью минерализации воды и расчетным ирригационным коэффициентом. Классификация воды по минерализации, нормирующая степень пригодности для орошения сельскохозяйственных угодий, приведена в таблице 8.
| Минерализация, г/дм 3 | Степень пригодности для орошения |
| £1,7 >1,7-5,0 >5,0 | Пригодна Пригодна условно (возможно засоление) Не пригодна |
В нашем случае минерализация 6,9 г/дм 3 . Вода для орошения не пригодна.
Расчет ирригационного коэффициента выполняется в зависимости от соотношения ионов натрия, хлора и сульфатов в эквивалентной форме в миллимолях.


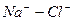
 |
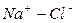

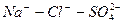
Во втором случае избыточное содержание катионов натрия может быть нейтрализовано содержащимся в воде сульфат-ионом. В третьем случае избыток натрия накапливается в почве в виде поглощенных катионов.
В первых двух случаях вода улучшению не подлежит, в третьем случае воду можно улучшить добавкой гипса. Классификация воды по ирригационному коэффициенту приведена в таблице 9.
| Ирригационный коэффициент | Характеристика воды | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| >18 >6-18 ³1,2-6,0 + — , Кир= 0,58. Вода очень плохая и улучшению не подлежит. 10) Агрессивность подземных вод. Подземные воды в зависимости от состава могут оказывать разрушающее действие на бетоны, цементы и металлы. Оценка агрессивности подземных вод по отношению к бетонам марки W4 и металлам производится на основании таблиц 5-7 и 26 СНиП 2.03.11-85 «Защита строительных конструкций от коррозии» (в скобках указаны номера таблиц согласно СНиП). Дата добавления: 2015-04-18 ; просмотров: 71 ; Нарушение авторских прав источник Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды. К химическим показателям качества воды относятся: состав растворенных газов. Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей. Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям. Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или 12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную. Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка: Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO32 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO32 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается. Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов. Общаяжесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод: Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам: Общая жесткость Карбонатная жесткость равна концентрации (мг/л) [HCO3– ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК= ЖО– ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов. Окисляемость характеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества. Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л. При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК. Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами. Определение иона Cl – . В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра: Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды. Определение иона SO42– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO42– = BaSO4↓ По массе образовавшегося осадка рассчитывают содержание иона SO42– . Определение ионов CO32– и HCO3– . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии. Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион: Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO32 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов: Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода. При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО32– и НСО3– , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю. Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция: После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния: Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости. Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б) N
образовывать с ионами кальция и магния прочные комплексные соединения. При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет. Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую: По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции: Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12. Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна: С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка. Растворенные в воде газы определяют химическими методами или газовой хроматографией. Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина: Определение растворенного кислорода производится йодометрическим методом. Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом: Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе: Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия: I2+ 2Na2S2O3 Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II): Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску. В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания. Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом. В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом: К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе. источник Определение катионов аммония (NH4 + ). Для определения катионов аммония на предметное стекло помещают несколько капель проверяемой воды и добавляют 2–3 капли раствора щелочи (NaOH или KOH). Держа стекло высоко над пламенем, раствор слегка нагревают. При нагревании со щелочами аммонийные соли, содержащиеся в природной воде, выделяют аммиак, который легко обнаруживают по характерному запаху: Для определения аммиака можно использовать также влажную красную лакмусовую бумажку (ее посинение означает наличие аммиака). Определение катионов меди (Сu 2+ ).В пробирку с 5 мл раствора бромистого калия осторожно приливают равный объем концентрированной серной кислоты. После охлаждения пробирки к содержимому добавляют 5 мл исследуемой воды. При наличии в воде катионов меди в растворе образуется сине-фиолетовое кольцо: Определение катионов кальция (Ca 2+ ). К 5 мл исследуемой воды приливают каплю уксусной кислоты. После непродолжительного нагревания необходимо добавить три капли раствора щавелевокислого аммония и каплю водного раствора аммиака. При наличии катионов кальция выпадает белый кристаллический осадок – кальций оксалата, не растворимый в воде и уксусной кислоте: Определение катионов двухвалентного железа (Fe 2+ ).К 5 мл исследуемой воды прибавляют 0,1 г калий сульфата и около 1 г красной кровяной соли ( K3[Fe(CN)6] ). В присутствии ионов двухва-лентного железа появляется сине-зеленое окрашивание: Примерное содержание двухвалентного железа определяется по цвету раствора (табл. 1). Таблица 1.Шкала оценки содержания Fe 2+
Определение катионов трехвалентного железа (Fe 3+ ). К 5 мл природной воды добавляют 1–2 капли концентрированной соляной кислоты и 5 капель 10%-ного раствора роданистого аммония NH4CNS. При наличии ионов Fe 3+ появляется красное окрашивание: Примерное содержание трехвалентного железа определяется по цвету раствора (табл.2). Таблица 2. Шкала оценки содержания Fe 3+
Определение сульфат-ионов (SO4 2- ). К 5 мл исследуемой воды приливают 4 капли 10%-ного раствора HCl и столько же капель 5%-ного раствора BaCl2. Содержимое пробирки нагревают на пламени спиртовки. В присутствии сульфат-иона выпадает осадок белого цвета или появляется муть:Ba 2+ + SO4 2- → BaSO4↓. Примерное содержание сульфат-ионов определяется по шкале (табл.3). Таблица 3. Шкала оценки содержания SO4 2-
Определение хлорид-ионов (Cl — ).К 5 мл исследуемой воды приливают три капли 10%-ного раствора азотнокислого серебра, подкисленного азотной кислотой. Появление осадка или мути указывает на наличие анионов хлора (табл.4): Таблица 4. Шкала оценки содержания Cl –
Определение сульфид-ионов (S 2– ). Присутствие сероводорода легко определить по характерному запаху и почернению свинцовой бумажки. Для этого необходимо в пробирку взять 10 мл исследуемой воды и закрыть отверстие пробирки кусочком фильтровальной бумаги, смоченной раствором Pb(CH3COO)2. Содержимое пробирки слегка подогревают. В присутствии сероводорода бумага чернеет: Pb(CH3COO)2 + H2S → PbS↓ + 2CH3COOH. Определение нитрат-ионов (NO3 – ). К 5 мл исследуемой воды осторожно по стенкам пробирки прилить около 1 мл раствора дифениламина в серной кислоте. При наличии нитрат-ионов на границе соприкосновения жидкостей появляется синее окрашивание. Эта реакция является настолько чувствительной, что дает возможность открыть ничтожные следы нитрит-иона. Для того чтобы удалить его, к исследуемой порции воды добавляют несколько кристаллов хлорида аммония и кипятят 2-3 минуты. При этом образовавшийся аммоний нитрит полностью разрушается с выделением свободного азота. После удаления нитрит-иона реакцию проводят с дифениламином. Определение нитрит-ионов (NO2 — ). Для анализа берут 10 мл исследуемой воды, к ней прибавляют две капли серной кислоты (конц. 1:3), 3 капли 3%-ного раствора йодистого калия. Образующийся при реакции йод выпадает в виде темно-серого осадка и окрашивает раствор в бурый цвет: 2I — + 2NO2 — + 4H + → I2+ 2NO + 2H2O. Для того чтобы подтвердить наличие йода, к образовавшемуся бурому раствору прибавляют три капли крахмального клейстера. При этом раствор окрашивается в интенсивный синий цвет вследствие образования адсорбированного соединения йода с крахмалом. При нагревании раствора окраска исчезает, а при охлаждении – появляется. Определение фосфат-ионов (РO4 3– ). Фосфаты определяются, как правило, колориметрическим методом (ГОСТ 18309, ИСО 6878) по реакции с молибдатом аммония в кислой среде: Для анализа берут 20 мл исследуемой воды, к ней прибавляют пипеткой-капельницей 10 капель раствора для связывания нитритов и затем шприцем-дозатором 1 мл раствора молибдата. Склянку закрыть пробкой и встряхнуть для перемешивания раствора. Оставить пробу на 5 мин для полного протекания реакции. Затем добавить к пробе пипеткой-капельницей 2-3 капли раствора восстановителя. При наличии в воде ортофосфатов раствор приобретает синюю окраску. Проведите визуальное колориметрирование пробы. Для этого мерную склянку поместите на белое поле контрольной шкалы и, освещая склянку рассеянным белым светом достаточной интенсивности, определите ближайшее по окраске поле контрольной шкалы и соответствующее ему значение концентрации ортофосфатов (табл.5). Таблица 5. Шкала оценки содержания РO4 3–
Дата добавления: 2018-06-01 ; просмотров: 155 ; ЗАКАЗАТЬ РАБОТУ источник КАЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ КАТИОНОВ И АНИОНОВ Под качественным химическим анализом вещества понимают определение его качественного состава, т.е. открытие (идентификацию) атомов, атомных групп, ионов и молекул в анализируемом веществе. Существует два метода качественного анализа: дробный и систематический. Дробный качественный анализ предполагает обнаружение иона или вещества в анализируемой пробе с помощью специфического реагента в присутствие всех компонентов пробы. Примером такой реакции может служить обнаружение ионов аммония при подщелачивании раствора: Групповые реагенты используются в систематическом качественном анализе, который предусматривает разделение смеси анализируемых ионов по аналитическим группам, после чего внутри каждой группы с помощью тех или иных реакций разделяют и открывают индивидуальные ионы. I. Качественный анализ катионов. В основу той или иной аналитической классификации катионов по группам положены их сходства или различия по отношению к действию определенных аналитических реагентов и свойства образующихся продуктов аналитических реакций (растворимость в воде, кислотах и щелочах, способность к комплексообразованию, окислительно-восстановительные свойства). Существует ряд классификаций катионов по группам (или химических методов качественного анализа катионов). Наиболее распространенными среди них являются три классификации: сероводородная, аммиачно-фосфатная и кислотно-основная, причем сероводородный метод анализа в настоящее время практически не используется, т.к. требует применения токсичного сероводорода и довольно продолжителен. Применение групповых реагентов позволяет подразделить многие катионы по аналитическим группам, однако не существует классификации, охватывающей все известные катионы или, по крайней мере, катионы всех металлов. В таблицах 1.1, 1.2 и 1.3 представлены катионы в соответствии с сероводородной, аммиачно-фосфатной и кислотно-основной классификациями. В этих таблицах перечислены не все катионы, входящие в группу, а только те из них, которые наиболее часто встречаются в фармацевтическом анализе. Нужно отметить, что в водных растворах «голые» индивидуальные катионы металлов не существуют, поскольку они термодинамически неустойчивы и образуют комплексы различного состава. Поэтому используемая в дальнейшем форма написания катионов Mg 2+ , Bi 3+ и т.д. означает лишь, что речь идет о соединениях элементов в соответствующих степенях окисления, а не о действительном существовании таких ионов. Таблица 1.1 Сероводородная классификация катионов. Групповой реагент Al 3+ , Cr 3+ , Zn 3+ , Mn 3+ , Fe 2+ , Fe 3+ , Co 2+ , Ni 2+ Cu 2+ , Cd 2+ , Mg 2+ , Bi 3+ , Sn 3+ , Sn 4+ , Sb 5+ , As 3+ , As 5+ Таблица 1.2. Аммиачно-фосфатная классификация катионов. Групповой реагент Li + , Mg 2+ , Са 2+ , Sr 2+ , Ba 2+ , Mn 2+ , Fe 2+ , Al 3+ , Bi 3+ , Cr 3+ , Fe 3+ * Cu 2+ , Zn 2+ , Cd 2+ , Mg 2+ , Ni 2+ Раствор (NH4)2HPO4; фосфаты растворимы в водном аммиаке Sn 2+ , Sn 4+ , As 3+ , As 5+ , Sb 3+ , Sb 5+ * Фосфаты двухзарядных катионов растворимы в уксусной кислоте (2 моль/л), трехзарядных — нет. Таблица 1.3. Кислотно-основная классификация катионов. Групповой реагент Zn 2+ , Al 2+ , Sn 2+ , Sn 4+ , As 3+ , As 5+ , Cr 3+ Раствор NaOH в присутствии Mg 2+ , Sb 3+ , Sb 5+ , Bi 2+ , Mn 2+ , Fe 2+ , Fe 3+ Раствор NaOH или раствор Cu 2+ , Cd 2+ , Hg 2+ , Co 2+ , Ni 2+ II. Кислотно-основная классификация катионов. 2.1. Кислотно-основная классификация катионов. Данная классификация катионов основана на использовании и качестве групповых реагентов водных растворов кислот и оснований — HCl, H2SO4, NaOH или KOH, NH3*H2O. К первой аналитической группе относят катионы Li + , Na + , К + , NH4 + . Групповой реагент отсутствует. Вторая аналитическая группа представлена катионами Ag + , Hg2 2+ , Pb 2+ . Групповой реагент — раствор НСl (обычно с концентрацией 2 моль/л). Групповой реагент осаждает из водных растворов катионы второй аналитической группы в виде осадков малорастворимых в воде AgCl, Hg2Cl2, РbСl2. Их произведения растворимости при комнатной температуре равны соответственно 1,8*10 -10 , 1,3*10 -18 , 1,6*10 -5 . При действии группового реагента катионы Рb 2+ осаждаются не полностью — частично они остаются в растворе. К третьей аналитической группе относят катионы Са 2+ , Sr 2+ , Ba 2+ (Рb 2+ иногда). Групповой реагент — раствор H2SO4. Катионы осаждаются в виде малорастворимых CaSO4 (ПР = 2,5*10 -5 ), SrSO4 (ПР = 3,2*10 -7 ), BaSO4 (ПР = 1,1*10 -10 ), PbSO4, (ПР = 1,6*10 -8 ). При действии группового реагента ионы Са 2+ осаждаются не полностью. Для более полнго осаждения ионов кальция в форме CaSО4 к раствору прибавляют этанол, в присутствие которого растворимость сульфата кальция уменьшается. Осадки CaSО4, SrSО4, BaSО4 практически нерастворимы в разбавленных кислотах и щелочах. Сульфат кальция растворим в водном растворе (NH4)2SО4 с образованием комплекса (NH4)2[Ca(SО4)2]. Четвертая аналитическая группа включает катионы Аl 3+ , Cr 3+ , Zn 2+ , As 3+ , As 5+ , Sn 2+ , Sn 4+ . Иногда сюда же относят катионы Sb 3+ . Групповой реагент — водный раствор NaOH (или КОН) в присутствии Н2О2 (обычно избыток 2 моль/л раствора NaOH в присутствии Н2О2(%)), иногда — без Н2О2. При действии группового реагента катионы IV аналитической группы осаждаются из водного раствора в виде амфотерных гидроксидов, растворимых в избытке группового реагента с образованием гидроксомплексов:
2. Открытие NH4 + : II. Систематический анализ смеси катионов (см. схему 1). 2.2.2. Анализ смеси катионов второй аналитической группы: Ag + ,Hg 2+ ,Pb 2+ . Открыть ионы дробно в смеси невозможно, т.к. нет избирательного реагента, поэтому проводят систематический анализ. К анализируемому раствору прибавляют на холоде групповой реагент-раствор (2 моль/л) HCI до полного выделения осадка, состоящего из AgCl, Hg2CI2, РиСl2 (если раствор остается прозрачным при добавлении 2 капель НCl, осаждение считается полным). Ход систематического анализа смеси катионов данной группы представлен в схеме 2. 2.2.3. Анализ смеси катионов третьей аналитической группы: Сa 2+ , Sr 2+ , Ba 2+ . Анализ раствора, содержащего смесь катионов третьей аналитической группы, обычно проводят по следующей схеме. Вначале проводят предварительные испытания: в отдельных небольших пробах анализируемого раствора дробно открывают катионы, присутствующие в растворе, учитывая их взаимное влияние друг на друга. Часто этим ограничиваются. При необходимости проводят систематический анализ, как описано в схеме 3. I. Предварительные испытания. 1. Открытие катионов бария (II): Ва 3+ + К2Сr2O7 (в прис. СН3СОО — ) → ВаСrО4 ↓ — желтый, осадок не растворяется в разбавленной уксусной кислоте; 2. Sr 2+ и Са 2+ может открыть, только если нет Ва 2+ . 3. Если нет Ва 2+ и Sr 2+ , то Са 2+ + Na2C2O4 → СаС2O4 ↓ белый Осадки гидроксидов не растворяются в полном аммиаке, за исключением Zn(OН)2, который образует аммиачный комплекс [Zn(NH3)4] 2+ . В присутствии H2О2 катионы Cr 3+ , As 3+ , Sn 2+ окисляются соответственно до СrO4 2- , AsO4 3- , [Sn(ОH)6] 2- ионов. Мышьяк (III) и мышьяк (V) считаются катионами As 3+ , As 5+ условно, т.к. в полных растворах они присутствуют и виде ионов AsO3 3- и AsO4 3- соответственно. В пятую аналитическую группу входят катионы Mg 2+ , Мn 2+ , Sb 3+ , Sb 5+ , Bi 3+ , Fe 2+ , Fe 3+ . Групповой реагент — водный раствор NaOH (обычно 2 моль/л) или 25%-ый водный раствор аммиака. Под действием группового реагента катионы осаждаются в виде соответствующих гидроксидов, которые не растворяются в избытке группового реагента. На воздухе гидроксиды Mn(OH)2 и Fe(ОН)2 постепенно окисляются кислородом до МnО(ОH)2 и Fe(ОН)3. К шестой аналитической группе относятся катионы Сu 2+ , Cd 2+ , Hg 2+ , Co 2+ , Ni 2+ . Групповой реагент — 25%-ый водный раствор аммиака. При действии группового реагента на водные растворы, содержащие хлориды катионов данной группы, сначала выделяются осадки различного состава: CuOHCl, CoOHCl, NiOHCI, Cd(OH)2, HgNH2CI. Осадки растворяются в избытке группового реагента с образованием соответствующих аммиачных комплексов. Осадки, выпавшие из растворов солей Со 2+ и Hg 2+ , растворяются в избытке аммиака только в присутствии солей аммония. Аммиачный комплекс кобальта (II) грязно-желтого цвета окисляется па воздухе до аммиачного комплекса кобальта (III) вишнево-красного цвета. 2.2. Систематический анализ катионов по кислотно-основному методу. Сначала будут рассмотрены схемы анализа смесей катионов каждой аналитической группы, а затем — ход анализа смеси катионов всех аналитических групп. 2.2.1. Анализ смеси катионов первой аналитической группы: Li + , Na + , К + , NН + . Катионы первой аналитической группы не имеют группового реагента. Катионы Li + и NH4 + мешают открытию катионов Na + и К + , поэтому из анализируемого раствора их нужно удалять. Вначале в отдельных пробах анализируемого раствора открывают катионы Li + и NН4 + , после чего эти ноны удаляют, а в остатке открывают К + , Nа + . I. Предварительные испытания (проводят в отдельной порции анализируемого раствора). 1. Открытие катионов Li + : 2.2.4. Анализ смеси катионов четвертой аналитической группы: При анализе раствора, содержащего катионы четвертой аналитической группы, сначала целесообразно провести предварительные испытания, а затем систематический анализ. I. Предварительные испытания. 1. Открытие Сr 3+ (если они присутствуют, раствор должен быть сине-зеленым): 2. Открытие Sn 2+ : 3. Открытие As 3+ (AsO3 3- в растворе): 4. Открытие As 5+ (AsO4 3- в растворе): II. Систематический анализ (см. схему 4). 2.2.5. Анализ смеси катионов пятой аналитической группы: Некоторые катионы данной аналитической группы удобнее открыть в предварительных испытаниях. Систематический анализ смеси катионов проводят по схеме 5. 1. Предварительные испытания. 1. Открытие ионов Fe 2+ : 2. Открытие ионов Fe 3+ (если ионы присутствуют в растворе, последний имеет желтоватую окраску): 3. Открытие ионов Мn 2+ : 4. Открытие ионов Bi 3+ (реакцию проводят о щелочной среде, рH=10): 2.6. Анализ смеси катионов шестой аналитической группы: Сu 2+ , Сd 2+ , Hg 2+ , Cо 2+ , Ni 2+ . Перед проведением систематического анализа в отдельных пробах анализируемого раствора можно открыть некоторые катионы с помощью характерных для них реакций. Отдельную порцию раствора можно обработать водным раствором аммиака и проанализировать окраску раствора, зная, что водные растворы аммиачных комплексов металлов окрашены следующим образом: 2.2.7. Анализ смеси наиболее распространенных катионов всех шести аналитических групп: Примерная схема анализа такого раствора заключается в следущем. Анализируемый раствор может быть окрашенным или бесцветным. По окраске раствора высказывают предположение о присутствии или отсутствии катионов, имеющих характерную окраску. Например, если раствор прозрачный и бесцветный, можно предположить, что он не содержит катионы Сr 3+ , Fe 3+ , Сu 2+ , Со 2+ , Ni 2+ . Некоторые предположения можно сделать и на основании измерения рН pacтвора (например, с помощью универсальной индикаторной бумаги). Если значение pН раствора находится в пределах рН = 2 — 4 и раствор не содержит осадка, то о нем отсутствуют Sn(II), Sn(IV), Sb(III), Sb(V), Bi(III), Hg(II), Fe (III), т.к. в противном случае продукты их гидролиза выделились бы в форме осадков. Анализируемый раствор обычно делят на 3 части. Одну часть используют для предварительных испытании, другую — для проведения систематического анализа, третью оставляют для контроля. I. Предварительные испытания. В отдельных небольших порциях анализируемого раствора (объемом примерно 0,3 — 0,5 мл) определяют наличие катионов II — VI аналитических групп действием групповых реагентов. 1. Открытие катионов II аналитической группы (Ag + , Pb 2+ ): анализируемый раствор + HCl → образование осадка белого цвета. 2. Открытие катионов III аналитической группы (Са 2+ , Sr 2+ , Ba 2+ , Pb 2+ ) (свинец (II) относится ко II аналитической группе, но дает осадок PbSO4): анализируемый раствор + H2SO4 → образование осадка белого цвета. 3. Открытие катионов IV, V, VI аналитических групп: анализируемый раствор + NaOH + Н2О2, t°→ образование осадка. Если при добавлении избытка NaOH осадок полностью растворяется, значит, анализируемый раствор содержит катионы IV аналитической группы (Zn 2+ , Al 3+ , Sn 2+ , Cr 3+ ) и не содержит катионы V и VI аналитических групп. Также в предварительных испытаниях в отдельных порциях раствора открывают некоторые индивидуальные катионы. 4. Открытие катионов NH4 + : 6. Открытие ионов Na (если NH4 + удалены): 7. Открытие ионов Fe 2+ : 8. Открытие ионов Fe 3+ : 9. Открытие ионов Мn 2+ : 10. Открытие ионов Сr 3+ : 11. Открытие ионов Bi 3+ : 12. Открытие ионов Сu 2+ : 13. Открытие ионов Ni 2+ : 14. Открытие ионов Со 2+ : II. Систематический анализ. Определив наличие катионов различных групп, приступают к их разделению помощью групповых реагентов. Ход выполнения систематического анализа описан в схеме 7. 2.2.8. Анализ раствора с осадком. Если анализируемый объект представляет собой раствор с осадком, то вначале эту смесь центрифугируют, отделяют осадок от раствора и обе фазы анализируют отдельно. Наличие осадка свидетельствует о присутствии в нем малорастворимых в воле соединений, например, хлоридов катионов второй аналитической группы (AgCl, РbСl), сульфатов катионов II и III аналитической группы (CaSO4, SrSO4, SrSO4. BaSO4, PbSO4, Ag2SO4), продуктов гидролиза катионов других групп и т.д. Осадок испытывают на растворимость в разбавленном растворе уксусной кислоты (растворятся фосфаты двухзарядных катионов: Mg 2+ , Са 2+ , Сr 2+ , Ва 2+ , Мn 2+ ); в разбавленном растворе хлороводородной кислоты (растворятся фосфаты трехзарядных катионов Fe 3+ , Сr 3+ , Bi 3+ , Al 3+ и карбонаты всех катионов); в разбавленной и более концентрированной (1:1) азотной кислоте (растворятся BiOCl, РbС12), в водном растворе винной кислоты (растворится SbOCl), в водном 30%-м растворе ацетата аммония (растворится PbSO4). III. Качественный анализ анионов. Аналитическая классификация анионов но группам. Обычно открытие анионов в фармацевтическом анализе осуществляют с использованием разных качественных аналитических реакций в растворах на тот или иной аннон. Разумеется, не исключается применение и других методов анализа (оптических, хроматографических, электрохимических и др.). Аналитическая классификация анионов по группам, в отличие от аналитической классификации катионов, разработана не столь подробно. Не существует общепризнанной и повсеместно принятой классификации анионов по аналитическим группам. Описаны различные классификации анионов. Чаще всего принимают во внимание растворимость солей бария и серебра тех или иных анионов и их окислительно-восстановительные свойства в водных растворах. В любом случае удастся логически разделить на группы только часть известных анионов, так что всякая классификация анионов ограничена и не охватывает все анионы, представляющие аналитический интерес. В табл. 3.1 и 3.2. приведены примеры классификации анионов по аналитическим группам. По аналитической классификации анионов, основанной на образовании малорастворимых солей бария и серебра, анионы обычно делят на три группы (табл.3.1). Таблица 3.1. Классификация анионов, основанная на образовании малорастворимых солей бария и серебра. Групповой реагент Раствор ВаС12 в нейтральной или слабо-щелочной среде Сl — , Br — , J — , BrO3 — , CN — , NCS — , S 2- , С6Н5СОО — Раствор AgNO3 в разб. (2М) азотной кислоте 1 — Бромат-ион иногда относится к III группе, так как бромат серебра AgBrO3 растворяется в разбавленной HNО3. Осадок Ag2S растворяется при нагревании в растворе HNO3. Если осадок нерастворим во всех вышеперечисленных растворителях, то это указывает на возможное присутствие в нем соединений: AgCl, PbCl2, CaSO4, SrSО4, BaSO4. Осадок РbСl2 растворяют, обрабатывая его кипящей дистиллированной водой, a AgCl — концентрированным раствором аммиака. Сульфаты катионов третьей аналитической группы переводят в карбонаты обработкой раствором соды и растворяют в уксусной кислоте. Полученный раствор присоединяют к центрифугату и анализируют далее вместе как описано выше (см. п. 2.2.7). При аналитической классификации анионов, основанной на их окислительно-восстановительных свойствах, анионы обычно делят на три группы (табл. 3.2.): анионы-окислители, анионы-восстановители и индифферентные анионы, т.е. такие, которые не обладают выраженными окислительно-восстановительными свойствами в обычных условиях. Таблица 3.2. Классификация анионов, основанная на их окислительно-восстановительных свойствах. Групповой реагент I Раствор KI в сернокислой среде II S 2- , SO3 2- , S2O 2- , AsO3 3- , 2 NO2 — , 3 C2O4 2- , 4 CI 3 — , Br — , J — , CN — , SCN — Раствор КМnО4 в сернокислой среде III 1 – NO3 — — ион в слабокислой среде практически не реагирует с KI. 3.1. Анализ смеси анионов. В фармацевтическом анализе систематический анализ смеси анионов с использованием любой классификации никогда не проводится, как и в подавляющем большинстве других случаев аналитической практики. Групповой регент можно использовать для доказательства присутствия или отсутствия в смеси (в растворе) анионов той или иной аналитической группы, после чего намечают и реализуют наиболее целесообразную схему анализа данного конкретного объекта. Лекарственные субстанции и лекарственные формы обычно содержат ограниченное число анионов, причем, как правило, бывает известно, какие анионы могут присутствовать в анализируемом препарате. Поэтому при анализе лекарственных препаратов входящие в их состав анионы открывают дробным методом с помощью тех или иных частных аналитических реакций на соответствующий анион. Общая логическая схема анализа смеси анионов обычно состоит в следующем. Вначале на первом этапе проводят предварительные испытания, в ходе которых определяют рН раствора, устанавливают с помощью групповых реагентов присутствие или отсутствие анионов первой и второй аналитических групп, выясняют наличие анионов-окислителей, анионов-восстановителей, проводят пробу па выделение газов. Затем на втором этапе дробным методом открывают отдельные анноны в небольших пробах анализируемого раствора. Если растворы содержат, наряду с ионами водорода H3O + , только катионы натрия и калия, (остальные катионы отсутствуют), то их непосредственно анализируют на присутствие анионов. Если же в растворах присутствуют катионы II-VI аналитических групп, то их обычно предварительно отделяют, так как они могут помешать открытию некоторых анионов. Удаление катионов II-VI аналитических групп можно осуществить либо обработкой раствором соды (Na2CO3) или поташа (К2СО3), переводя эти катионы (а также катион лития Li + ) в малорастворимые карбонаты, либо методом ионообменной хроматографии. 3.1.1. Первод катионов II — VI аналитических групп о малорастворимые карбонаты. 2СН3СООН + Na2CO3 → 2CH3COONa + H2O + CO2↑.Предварительно в отдельных порциях анализируемого раствора открывают карбонат ион и ацетат — ион (как описано ниже). Затем к пробе анализируемого раствора ( 30 капель) осторожно, по каплям прибавляют разбавленный раствор соды для нейтрализации раствора до слабощелочной реакции, после чего добавляют еще 30 капель раствора соды. Смесь нагревают до кипения и кипятят около 5 минут, периодически добавляя по каплям дистиллированную воду по мере упаривания раствора, поддерживая объем жидкой фазы приблизительно постоянным. Полученную смесь центрифугируют, центрифугат отделяют от осадка (который сохраняют для дальнейшего анализа — в случае необходимости). К центрифугату осторожно, при перемешивании, по каплям прибавляют разбавленную уксусную кислоту до рН 7 для удаления избытка карбонат — ионов. Полученный раствор анализируют далее на присутствие анионов. 3.1.2. Предварительные испытания (проводятся в отдельной порции раствора). 1. Определение рН анализируемого раствора. 2. Проба на присутствие анионов неустойчивых кислот. 3. Проба па присутствие анионов первой аналитической группы (табл.3.1). 4. Проба на присутствие анионов второй аналитической группы (табл. 3.1). 5. Проба на присутствие анионов-окислителей. 1) в присутствии раствора крахмала. Окислители переводят ионы J в йод J2, при образовании которого крахмальный раствор окрашивается в синий цвет. 6. Проба на присутствие анионов-восстановителей. Наличие анионов-восстановителей устанавливают реакцией с йодом (раствор йода обесцвечивается, поскольку йод в нейтральной или слабокислой среде окисляет анионы-восстановители S 2- , SO3 2- , S2O3 2- , С2O4 2- , Br — , J — , SCN — , NO2 — ). 3.1.3. Дробное обнаружение анионов. После проведения предварительных испытаний, отдельные анноны открывают дробным методом, учитывая их возможное мешающее влияние друг на друга. Рассматриваемые анионы вступают в многочисленные реакции с различными реагентами. Многие из этих реакций представляют аналитический интерес. Ниже охарактеризованы только некоторые из этих реакций, рекомендуемые чаще других. 1. Открытие сульфат-нона. 2. Открытие сульфид-поиа. 3. Открытие сульфит — нона. 4. Открытие тиосульфат — иона. 5. Открытие карбонат-иона. 6. Открытие оксалат — иона. 7. Открытие нитрит — иона. 8. Открытие нитрат — иона. 9. Открытие ацетат — иона. 10. Открытие тартрат-иона — ООС — СН(ОН) — СН(ОН) — СОО — 11. Открытие цитрат-иона – ООССН2 — С(ОН)(СОО — ) – СН2СОО — . 12. Открытие ортофосфат — иона. 13. Открытие Сl — иона. 14. Открытие бромид- и иодид-ионов. 15. Открытие бензоат-иона С6Н5СОО — 16. Открытие салицилат-иона НО – С6Н4 — СОО — . 3.1.4. Систематический анализ смеси анионов. Не существует такая схема систематического анализа смеси анионов в растворе, которая была бы общепринятой, в отличие от систематического анализа смеси катионов. Ниже предложен один из вариантов анализа смеси анионов. Последовательность операций в общем случае заключается в следующем. Вначале проводятся предварительные испытания, затем дробно в отдельных порциях раствора открывают некоторые анноны, после чего осуществляют разделение анионов с помощью групповых реагентов с последующим открытием анионов в разделенных осадках и растворах. Пусть анализируемый раствор содержит наиболее распространенные анионы трех аналитических групп. В отдельных порциях раствора проводят предварительные испытания и дробно открывают анионы NO3 — , NO2 — , CH3COO — (обязательно!) и некоторые другие. Затем проводят систематический анализ; один возможных способов описан в схеме 8. источник |









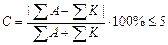

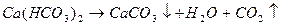
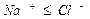
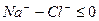
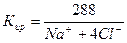
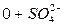
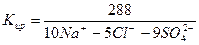
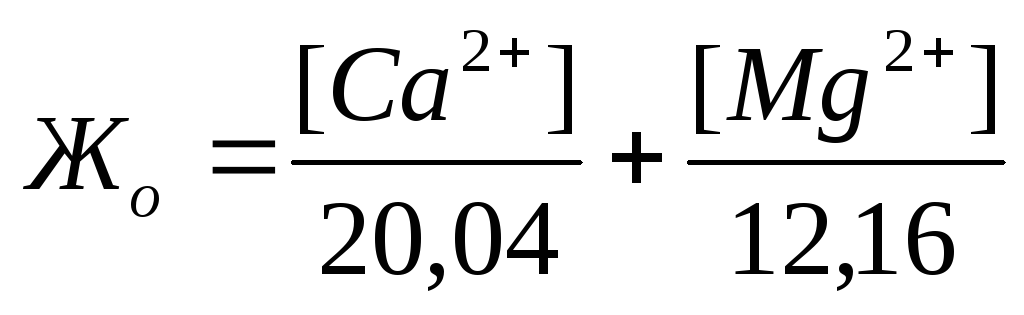
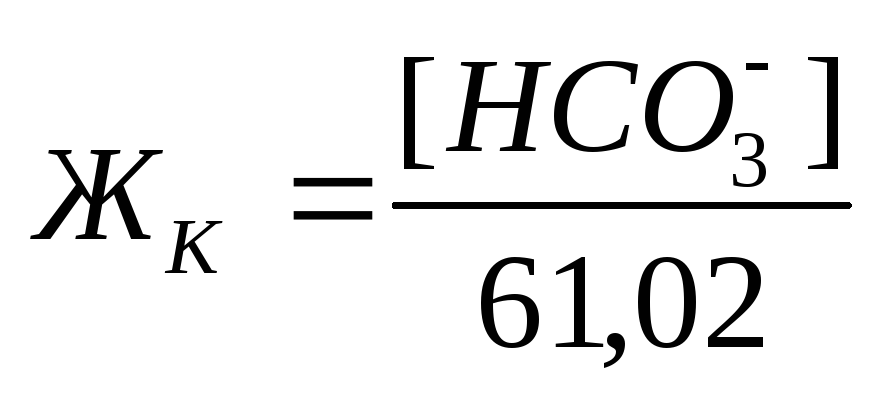 , где 61,02 – эквивалентная масса иона HCO3 – .
, где 61,02 – эквивалентная масса иона HCO3 – .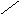
 aOOCCH2 CH2COONa
aOOCCH2 CH2COONa
 N––CH2––CH2––N
N––CH2––CH2––N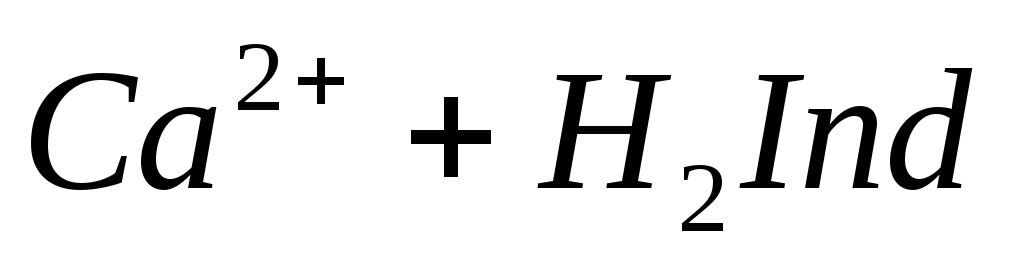

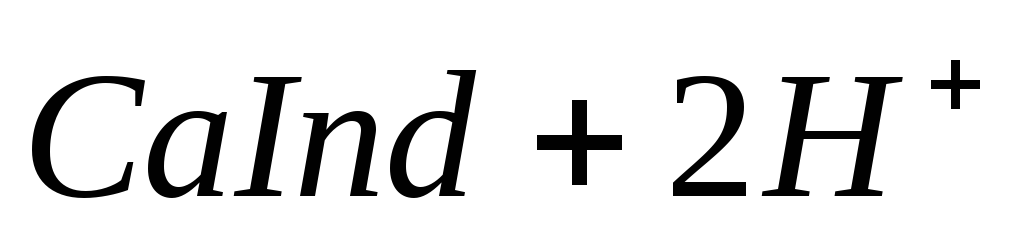
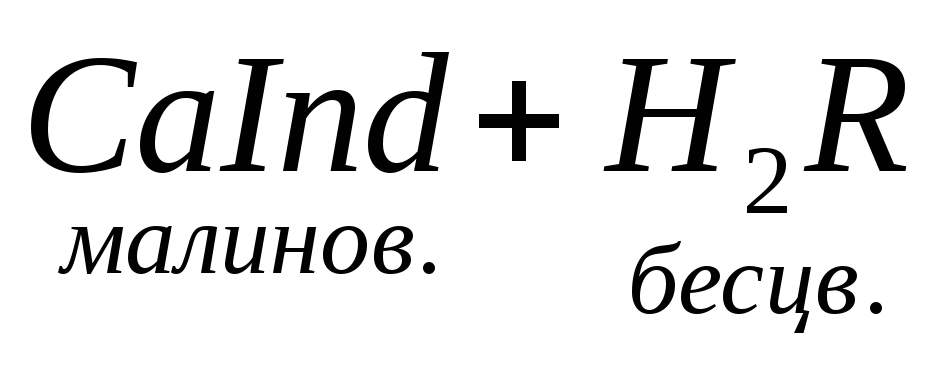

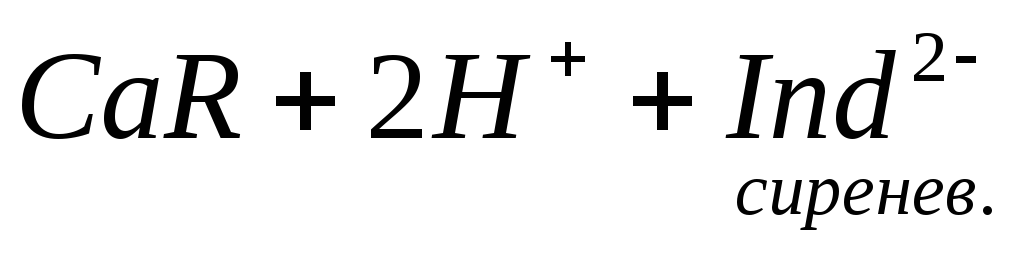
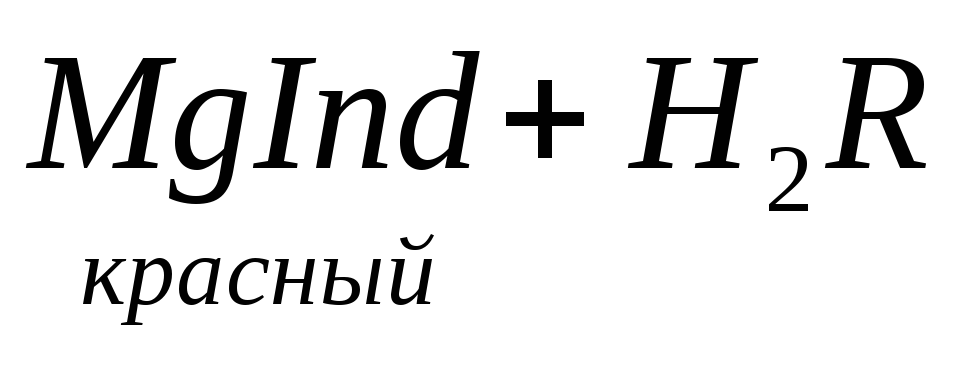

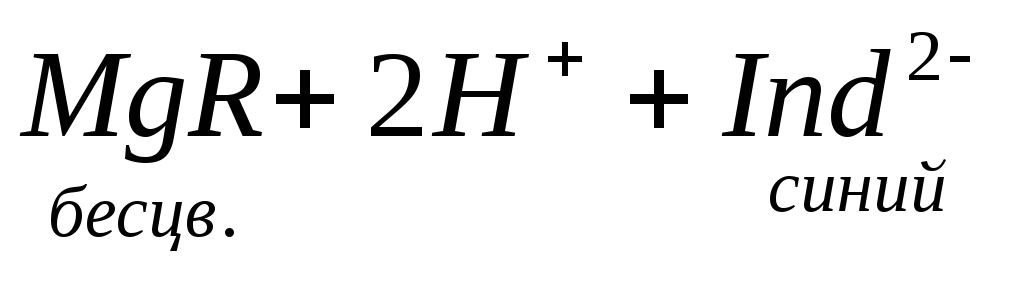
 2NaI + Na2S4O6
2NaI + Na2S4O6