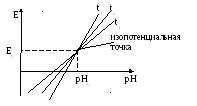Чтобы получить более полное представление о том, что такое потенциометрические методы анализа, зачем они существуют, и каково их предназначение, необходимо начать разбираться с самой потенциометрии. Этим мы сейчас и займемся.
Начать объяснение стоит с того, что же такое потенциометрия. Это не какая-то отдельная область науки или что-то в этом роде. Данный подраздел включает в себя совокупность всех физико-химических методов проведения исследований, которые существуют, но с одним небольшим условием. Сюда входят лишь те их них, которые базируются на измерении электродвижущей силы цепей.
Данные цепи состоят из двух основных элементов:
- индикаторного электрода;
- электрода сравнения.
Для того чтобы использовать потенциометрический метод анализа, необходимо найти зависимость электрохимического электрода, а точнее, его потенциала от концентрации ионов или же от их активности. Есть еще одно положение, и оно говорит о том, что потенциометрия — это раздел, который включает в себя электрохимические способы анализа, основывающиеся на возбуждении вещества электрическим полем и необходимость проводить измерения равновесного электрода.
Основоположником такого раздела анализа как потенциометрия является В. Нернст. В основе потенциометрического метода анализа лежит уравнение, которое в 1889 году вывел именно этот человек. Полученное Нернстом уравнение служило для равновесных электродных потенциалов, для их нахождения. Но вскоре после этого, потенциометрия стала получать более широкое распространение и начала использоваться в таком разделе как аналитическая химия.
В 1893 г. ученый Р. Беренд провел первое в истории человека потенциометрическое титрование. А в настоящее время такой раздел как потенциометрия довольно широко применяется в аналитической и физической химии. Кроме того, существует еще несколько областей применения потенциометрического метода анализа.
Аналитическая и физическая химия — это, как мы говорили, не единственные области, где потенциометрия нашла свое применение. Данный метод анализа также широко используется в редокосометрии. Названный раздел объединяет в себе несколько методов, которые основываются на измерении окислительно-восстановительных потенциалов в исследуемом растворе.
Потенциометрические методы анализа также используются и в ионометрии. Так именуют ответвление прямой потенциометрии, суть которого заключается в определении концентрации или активности ионов в их различных фазах. Для этого применяется ионселективный электрод. Кроме того, ионометрия объединяет в себе все методы анализа, относящиеся к определению концентрации. Также стоит добавить, что к данному разделу принадлежит еще и рН-метрия, катионо- и анионометрия.
Еще одно использование потенциометрического метода анализа — это потенциометрическое титрование. Суть титрования заключается в необходимости наблюдения за ходом реакции титрования и последующего нахождения точек эквивалентности.
Сущность потенциометрии, а также методов анализа этой области заключается в проведении измерения разности электродвижущей силы двух электродов. Один из них является измерительным, а другой — вспомогательным. К тому же оба эти электрода должны быть помещены в исследуемый раствор.
Очень важно отметить, что величина электродвижущей силы сильно зависит от температуры. По этой причине все приборы, которые используются для проведения анализа, в частности рН-метры и ионометры дополнительно комплектуются температурными компенсаторами, которые могут управляться как в ручном режиме, так и в автоматическом.
Если говорить коротко, то потенциометрический метод анализа основан на измерении ЭДС гальванических элементов. Под этими элементами как раз и понимают соединение двух электродов, один из которых, как говорилось ранее, индикатор, а другой необходим для сравнения.
Классификация методов потенциометрического анализа довольно проста и имеет всего 2 пункта. И первая подгруппа — это прямая потенциометрия. Суть данного метода заключается в том, что необходимо измерять точную величину электродного потенциала, а после этого находить по уравнению Нернста активность потенциалоопределяющего иона в растворе. Данный метод используют для того, чтобы находить рН водных и неводных растворов. К тому же, этим способом можно находить и рН для производственных растворов олигомеров.
Кроме этого, потенциометрические методы анализа прямой потенциометрии используют для того, чтобы проводить анализ кислых и основных примесей в диметилформамиде. Также данный метод можно использовать для определения хлорид-ионов и кислотных компонентов в различных производственных растворах.
На вопрос о том, на чем основан потенциометрический метод анализа этой группы, можно ответить так — на измерении точных величин. А отсюда становится ясным, почему данный способ анализа нашел свое широкое применение и в таких областях как термодинамика, электрохимические, а также химические реакции.
Сущность метода потенциометрического метода анализа в данной области потенциометрического титрования основывается на необходимости определения точки эквивалентности в реакции нейтрализации, а также в реакции осаждения и комплексообразования, которые будут известны по итогам проведения потенциометрических измерений. После того как в результате проведения анализа станет точно известна эта самая точка эквивалентности, которая является и точкой окончания реакции, окажется возможным нахождение неизвестного количества вещества в растворе, за которым ведется контроль. Определить это можно по расходу титранта, концентрация которого известна в точных числах.
Принцип работы потенциометрического метода анализа — титрования — заключается в следующем. Вблизи от точки эквивалентности обычно происходит сильное изменение или даже скачок потенциала от индикаторного электрода. Сила данного скачка будет зависеть от силы титруемого раствора кислоты или же основания, а также от концентрации самого раствора. Если же проводить титрование смесей различных кислот, то можно наблюдать несколько скачков за одну реакцию.
Использование данного метода осуществляется в чисто прикладных целях, когда необходимо обнаружить конечную точку титрования, с помощью которой есть возможность определить принадлежность анализируемого вещества в растворе к какой-либо группе. Однако, несмотря на это, данный способ получил довольно широкое распространение, а также имеет свои преимущества, которые выгодно выделяют его среди других методов анализа.
Среди преимуществ потенциометрии, в целом, можно выделить следующие пункты:
- Высокая точность проводимых анализов.
- Высокая чувствительность измерений.
- Если говорить о титровании, то метод можно использовать в мутных или разноцветных растворах.
- Использование прямого потенциометрического метода анализа — быстрота и простота, проводимых измерений.
- Одно из больших преимуществ — это возможность автоматизации процесса титрования. Некоторые промышленные объекты занимаются производством автоматических автотитраторов, которые комплектуются потенциометрами. В итоге получается небольшой автономный комплекс для проведения анализа.
Также выгодно отличает этот метод от других то, что есть возможность определения нескольких веществ в одном и том же растворе без их предварительного разделения.
Если говорить о потенциометрии, а также о ее методах анализа, то можно выделить несколько особенностей. К примеру, потенциометрическое титрование сильно расширяет возможность практического применения данной области проведения анализа среди неводных растворителей. Данные методы позволяют людям находить содержание различных компонентов, которые в отдельности невозможно титровать, а также появляется возможность проведения анализа вещества, которое не растворяется или, наоборот, разлагается в воде.
Также важной особенностью потенциометрических методов является то, что их относят к неразрущающей группе. Другими словами, проведение анализа одним из потенциометрических способов не влияет на состав анализируемого раствора и не разрушает его, вследствие чего смесь можно использовать в дальнейшем без каких-либо проблем. Погрешность измерений при использовании прямого потенциометрического метода составляет всего от 2 до 10%. А если использовать потенциометрическое титрование, то погрешность и вовсе составляет от 0,5 до 1%.
Недостатком метода можно считать то, что невозможно его применять для непрерывного контроля, а также в некоторых случаях им невозможно определить слишком малые концентрации в растворе.
Ученые выделяют основным преимуществом этого метода его быстроту, а также простоту, с которой проводится анализ. Именно эти два качества выгодно выделяют потенциометрию и методы ее анализа среди других.
Время, которое требуется, чтобы установилось равновесие потенциалов индикаторного электрода, довольно маленькое, что, в свою очередь, позволяет с удобством изучать кинетические реакции и реакции автоматического контроля различных технологических процессов.
Если использовать в качестве электродов микроэлектроды, то становится доступным проведение измерений в пробах, объем которых равен десятым долям см³. Кроме того, есть несколько различных растворов, в которых измерения могут быть проведены при помощи потенциометрии.
Существует потенциометрический метод анализа воды, различных мутных и окрашенных растворов, а также различных вязких паст. Огромным его преимуществом является то, что при использовании названного метода нет необходимости в перегонке или фильтрации раствора. А это в некоторых случаях экономит очень много времени.
Использование потенциометрического метода анализа титрования выделяется такими преимуществами:
- Данным метод позволяет полностью исключить субъективные ошибки, которые часто связаны с визуальным наблюдением за раствором.
- Данный метод считается более чувствительным. Другими словами при тех же манипуляциях титрование позволяет определять менее концентрированные вещества.
- Кроме того, метод позволяет без проблем проводить титрование в замутненных или цветных растворах. Это очень удобно, так как применять цветные индикаторы в таких растворах, допустим, невозможно вовсе.
- Также данный метод анализа позволяет человеку последовательно определить смесь веществ из одной и той же порции раствора.
Данные преимущества выгодно выделяют титрование на фоне других потенциометрических методов, а потому используется он довольно широко.
источник
Предназначены для определения определенного типа ионов в воде (Z.B. измерение концентрации [H] + (рН),Cl — ,F — ,Ca 2+ ,Na + ,K + и др.)
Методы основаны на использовании соотношении Нернста: 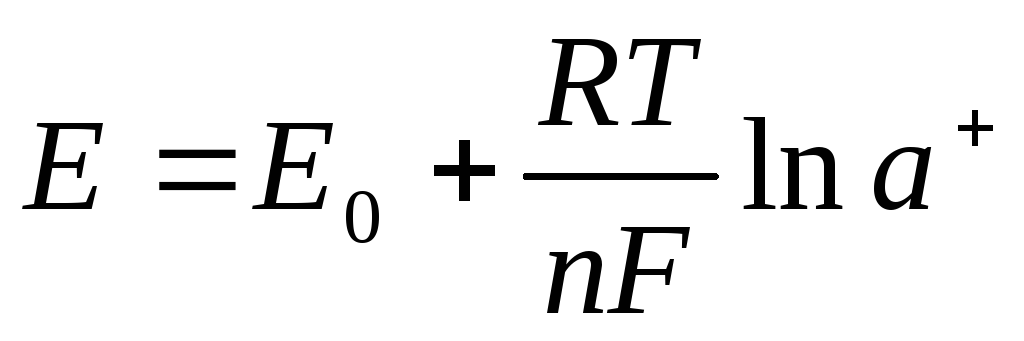
n– валентность иона, концентрация которого измеряется
f 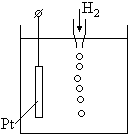
Потенциал нормального водородного электрода принят за ноль.
Платиновый электрод погружен в раствор с а = 1 (ионов Н + ) и подачей газообразного водорода к электроду. Считается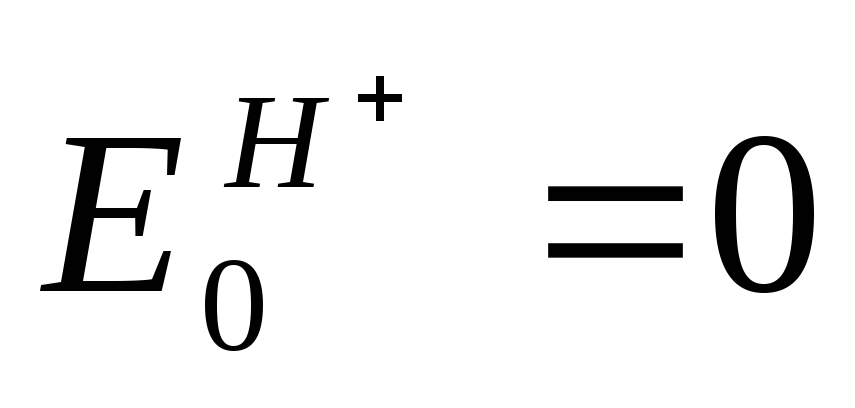
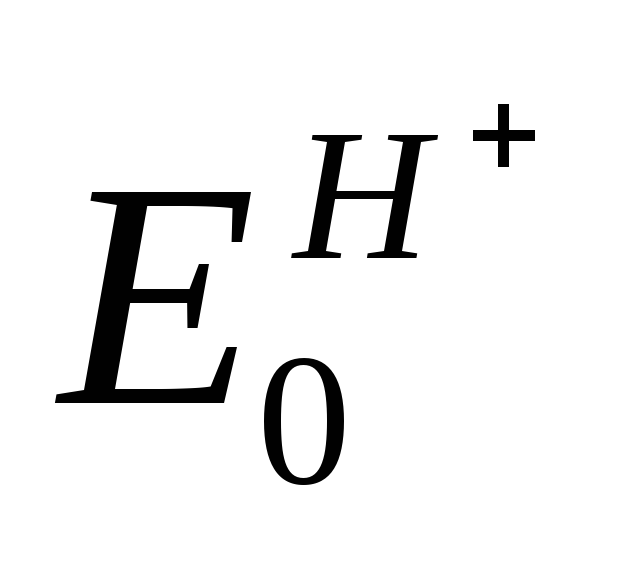
Уравнение Нернста справедливо для равновесных потенциалов. Равновесным считается потенциал электрода, когда скорости окисления и восстановления на нем равны.
В системе электродов равновесный потенциал, когда ток не протекает либо очень маленький (отсутствует поляризация).
I.ИЭ – измерительный электрод (стеклянный), потенциал которого являетсяf (рН)
ВЭ – вспомогательный хлор-серебряный электрод
Основным элементом ИЭ является чувствительная мембрана 1, которая выполнена из специального стекла
Е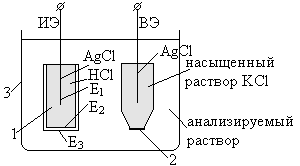
2 – полупроницаемая мембрана нужна для замыкания электрической цепи внутри анализируемого раствора, т.е. через нее пропускаются ионы К + иCl —
Практическое значение – координаты изопотенциальной точки используются в системе термокомпенсации рН-метров.
Зависимость потенциала ИЭ от рН называют водородной функцией:

2) сложная в обслуживании и эксплуатации конструкция стеклянного электрода
3) эти электроды не выдерживают измерение рН при высоких температурах.
I
4 – амальгама на внутренней поверхности чувствительной мембраны
5 – точка контакта электрода
III.Полупроводниковая техника кампланарной технологии
1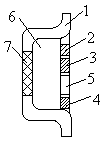
2 – измерительный электрод
3 – вспомогательный электрод
5 – аналогово-цифровой преобразователь (АЦП)
6 – область, заполненная хорошо проводящим гелем
7 –ионо-селективная мембрана (в данном случае к Н + )
: 1) невысокое внутренне сопротивление (
10 кОм) электродной системы
2) возможность передачи сигнала на значительное расстояние без существенных помех
Существует свыше 100 ионо-селективных электродов. Их селективность определяется типом или видом чувствительной мембраны.
Принцип действия такой же, как и определение рН.
Недостатки: 1) необходимость периодической очистки или смены чувствительной мембраны из-за загрязнений
2) достаточно высокая чувствительность к содержанию К + иNa + (только стеклянные электроды)
источник
Потенциометрический (электрометрический) метод определения величины pH воды со стеклянным электродом более универсален и точен. Большинство серийных рН-метров позволяет производить измерения с точностью 0,05—0,02 единицы pH. Он пригоден для анализа вод с широким диапазоном минерализации и содержащих окрашенные и взвешенные вещества.[ . ]
Потенциометрический метод основан на определении изменения потенциала электрода, реагирующего на изменение концентрации ионов в исследуемом растворе. Потенциал электрода зависит и от типа электрода, выбор которого определяется областью применения потенциометрического титрования. Первоначально анализ заключался в получении кривых потенциометрического титрования, которые адекватно отражали процесс нейтрализации либо осаждения при больших концентрациях определяемых ионов. Затем потенциометрический метод получил новое развитие в направлении автоматизации измерений и обработки данных титрования с помощью ЭВМ. Применение методики накопления анализируемых элементов на пленочном ртутном электроде при заданном потенциале позволило резко снизить их предел обнаружения. Потенциометрический метод применяют для определения оксидов углерода, серы, аммиака, сероводорода, меркаптана, электроактивных элементов и галогенид-ионов.[ . ]
Анализ развивающихся инструментальных физико-химических методов определения ХПК приведен в работе [165]. Из него следует, что основная направленность физико-химических методов сводится к определению непрореагировавшего бихромата калия с помощью ИК-спектрометров, фотометрических и электрохимических анализаторов. Высокая чувствительность предлагаемых методов, безусловно, позволит внедрить их в практику определения ХПК при условии сокращения продолжительности определений. Чаще всего объектами контроля при исследовании буровых стоков являются мутные и окрашенные воды и фильтраты. Это накладывает ограничение на применение фотометрического метода определения вышеуказанного показателя. Наиболее применяемым является потенциометрический контроль за расходом окислителя, который в принципе дублирует унифицированную методику и дает хорошую корреляцию данных с теоретически рассчитанным значением окисляемости [99].[ . ]
Потенциометрические методы анализа (как и другие электрохимические методы) основаны на процессе электролиза анализируемых веществ в электрохимической ячейке. Однако, в отличие от рассмотренной выше полярографии (см. раздел 5), в основе потенциометрического метода анализа лежит измерение равновесного потенциала электрода, возникающего в анализируемом растворе, и определение его зависимости от активности (концентрации) определяемого иона [14, 16].[ . ]
При анализе относительно концентрированных сточных вод (а иногда и разбавленных) используют титриметрические методы анализа с применением как цветных индикаторов для фиксирования конца титрования, так и специальных приборов — электрохимических (потенциометрическое титрование, ампёрометрическое, кондуктометрическое и т. п.) и оптических (турбидиметрическое титрование, нефелометрическое, колориметрическое). Титриметрические методы часто применяют для определения анионов, особенно тогда, когда одновременно присутствуют разные анионы, мешающие определению друг друга (см. разд. 10).[ . ]
При анализе воздуха иногда необходимо установить pH и содержание солей в пробах, полученных с помощью поглощения исследуемой газовой фазы простейшей адсорбционной средой (водой), для того, чтобы определить, например, концентрацию некоторых кислот или щелочей в тумане или количество солей, таких, как хлористый натрий в суспензии. Потенциометрическое титрование применяется, например, для анализа воздуха, содержащего сульфиды или меркаптаны. В этом методе индикатор заменен электродвижущей силой, возникающей между стандартным и индикаторным электродом. Оба эти метода образуют часть того раздела аналитической химии, который в настоящее время называется «электро-аналитической химией».[ . ]
Идея потенциометрического анализа возникла в 90-х годах прошлого столетия. Однако наибольшее распространение эти методы получили приблизительно с 1920 г.[ . ]
Принцип анализа. Метод основан на изменении э.д.с. в зависимости от состава исследуемого раствора. Сумму сульфата и сульфита натрия определяют прямым потенциометрическим методом. Для определения сульфита натрия используют метод окислительно-восстановительного потенциометрического титрования.[ . ]
Химические анализы почв выполняли общепринятыми методами (Агрохимические методы исследования почв, 1965; Аринушкина, 1970).[ . ]
Фтор в аэрозольной форме собирают на стекловолокнистом фильтре, а в газообразной — путем пропускания воздуха (от 80 до 100 м3) через 1 л 2%-ного раствора NaOH. Фильтр обрабатывают 200 мл 2%-ного раствора NaOH, а затем объем экстракта доводят до 400 мл. Полученный экстракт (10 мл) смешивают с 10 мл буферного раствора и анализируют фторид-селективным электродом с мембраной из трифторид-лантана, имеющим мостиковый электрод сравнения из галогенида серебра, заполненный 3 М раствором КС1. Для заполнения мостика применяют 10%-ный раствор KN03. Если концентрация алюминия в анализируемом воздухе оказывается выше 20 мг/м3, раствор образца разбавляют. Результаты измерений показывают, что потенциометрический метод оказался менее дорогим при затратах времени на один анализ в 5 раз меньше по сравнению с методом ионной хроматографии.[ . ]
Эффективным методом определения фторид-ионов является потенциометрический метод с ионоселективным электродом. Его применяют в анализе природных вод. Однако рекомендовать его для анализа сточных вод, особенно сложного состава, пока нельзя.[ . ]
В связи с тем что методы осаждения и комплексообразования играют важную роль в санитарно-химическом анализе, мы сочли необходимым ознакомить читателя с двумя типами электродов: серебряными и ртутными, образующими в растворе солей серебра и ртути системы Н§/Нйз+; Ag/Ag+ . С помощью последних можно потенциометрически определить концентрацию ионов серебра и ртути, а также концентрации тех ионов, которые с серебряными и ртутными ионами образуют труднорастворимые соли и комплексы[ . ]
Физико-химические методы—фотоколориметрия, потенциометрическое титрование и другие все больше и больше приме няются в практике санитарно-промышленного анализа.[ . ]
Электрохимический метод газового анализа основан на использовании химических сенсорных датчиков, состоящих из двух чувствительных элементов и определенного химического покрытия, которое непосредственно контактирует с анализируемой средой и на котором происходит адсорбция анализируемого вещества. В зависимости от того, какие физические свойства, зависящие от количества адсорбированного вещества, измеряются, датчики делятся на потенциометрические, кулонометрические, полярографические и др.[ . ]
Среди электрических методов измерения с целью непрерывного анализа растворов потенциометрический способ отличается особой простотой и занимает важное место, например, при анализе воды (для характеристики концентрации ионов водорода и окислительно-восстановительного процесса). Однако при непрерывном анализе состава воздуха данный метод до сих пор имел весьма небольшое значение. Причина этого заключается в том, что измеряемые потенциалы мало специфичны по отношению к некоторым веществам, чтобы удовлетворять требованиям анализа состава воздуха. Другая трудность, которая, правда, имеет место и при колориметрическом анализе, заключается в логарифмической зависимости между измеренной разностью потенциалов и искомой концентрацией вредного вещества, что затрудняет обработку результатов измерений.[ . ]
Наряду с нефелометрическими методами анализа применяют элек-трофотометрический, потенциометрический, полярографический.[ . ]
Для питьевой воды и природных вод эти методы описаны в ГОСТе [0-2] и в ряде монографий [0-15; 0-16; 0-23; 0-69; 0-17]. Для определения металлов в водных растворах — в питьевой воде и сточных водах — наряду с химическими применяются физические и физико-химические методы: полярографический, спектрографический, спектрофотометрический, хроматографический, флуориметрический, атомно-абсорбционный, масс-спектрометрический, потенциометрический, амперометрический и многие другие в разных их модификациях [77, 0-10; 0-1; 0-24; 83]. Электрохимическими методами анализа-в водных растворах определяют металлы (по 150—200 проб в день с высокой чувствительностью) [0-50]. По данным [0-10], обычно используемые весовые и объемные методы определения неорганических веществ в водных растворах недостаточно чувствительны. Для определения каждого металла приходится его отделять от остальных металлов и различных примесей. Эти методы трудоемки и требуется много времени для анализов. Современные физические методы очень чувствительны и точны, не требуют удаления примесей, создают возможность быстрого определения и автоматизации анализа [0-33].[ . ]
Для агрономических целей химическому анализу подвергаются почвы, растения, удобрения, поливные и грунтовые воды. Исследуемый материал предварительно подготавливают к анализу — высушивают, растирают, просеивают. Иногда анализируют не все вещества, образующие данный материал, а лишь некоторые его составные части, извлекаемые тем или иным реагентом. Многие количественные определения проводят весовым или объемным методом. Но часто пользуются различными физико-химическими методами анализа: колориметрическими, пламенно-фото-метрическими, оптическими, потенциометрическими, кондуктометр ическими и др. В основе их лежит зависимость тех или иных физических свойств растворов от концентрации определяемых веществ.[ . ]
Описываемые в справочнике физико-химические методы исследования объектов окружающей среды классифицированы соответственно используемым свойствам системы: хроматографическим, электрохимическим и оптическим. К хроматографическим методам относятся хроматография на бумаге и в тонком слое, газовая и газожидкостная хроматография, к электрохимическим — полярографический, амперометрический, кондуктометрический, кулонометрический и потенциометрический методы анализов, а также ионометрия, к оптическим — фотоколориметрический, нефелометр ический, турбидиметрический, рефрактометрический и люминесцентный методы.[ . ]
Определение окисляемости природных буровых вод методом потенциометрии (446). Определение салициловой кислоты в сточных водах методом потенциометрического титрования (448). Анализ сточных вод производства пластификатора дибутилфталата методом потенциометрического титрования (448). Определение додекалак-тама (ДДЛ) в сточных водах методом потенциометрического титрования (449). Определение непредельных соединений в сточных водах методом прямого потенциометрического титрования (450). Определение меди в воде методом потенциометрического титрования (451).[ . ]
Для определения бора предложено два фотометрических метода— с карминовой кислотой и с куркумином. Описанный во многих руководствах метод непосредственного титрования комплекса борной кислоты с маннитом дает вполне удовлетворительные результаты только при анализе относительно чистых растворов. В анализе сточных вод он оказался малопригодным (как при титровании с индикатором, так и при потенциометрическом титровании) из-за большого числа различных мешающих веществ. Влияния эти могут быть устранены предварительной отгонкой бора в виде его борнометилового эфира, но в таком варианте метод слишком сложен в выполнении.[ . ]
Четвертый том содержит сведения по аналитической химии (методы разделения; весовой, объемный и газовый анализ; потенциометрический, полярографический, колориметрический и другие методы анализа), по эмиссионному спектральному анализу, фотометрии пламени, спектрам поглощения неорганических и органических соединений. Приводятся также данные о показателях преломления жидкостей и оптической активности органических соединений.[ . ]
Многие количественные определения проводят весовым или объемным методом. Но часто пользуются при этом различными физико-химическими методами анализа: колориметрическими, пламенно-фотометрическими, оптическими, потенциометрическими, кондуктометрическими, хроматографическими и др. В основе их лежит зависимость тех или иных физических свойств растворов от концентрации определяемых веществ.[ . ]
Важным аспектом прикладной электрохимии является использование электрохимических методов анализа природных и сточных вод (кулонометрия, полярография, амперометрическое и потенциометрическое титрование, изотахофорез и др.). Электрохимические методы анализа используют закономерности электрохимических явлений. Такие преимущества этих методов, как быстрота, высокая точность, надежность, экономичность, возможность полной автоматизации процессов отбора проб и проведения анализов в небольшом объеме жидкости, делают незаменимыми электрохимические методы анализа при осуществлении контроля за технологическими процессами водоочистки и наблюдении за состоянием поверхностных источников. Методами электрохимического анализа определяют отдельные элементы, ионы или вещества, некоторые общие характеристики воды, например такие, как удельная электропроводность, pH, ЕЙ, химическое поглощение кислорода (ХПК), биохимическое потребление кислорода (ВПК), жесткость воды и др.[ . ]
Настоящие методические указания устанавливают методику количественного химического анализа атмосферного воздуха для определения в нем содержания аминофенилуксусной кислоты в диапазоне концентраций 0,05—0,5 мг/м3 методом потенциометрического титрования.[ . ]
Для определения аммиака, пиридина, ионов аммония широко используют кондуктометрические и потенциометрические методы анализа.[ . ]
Для определения микроколичеств токсических веществ в воздухе наибольшее применение нашли оптические методы, особенно фотометрический метод в видимой области спектра. Из электрохимических методов применяют полярографический, реже кондуктометрический и потенциометрический. Для разделения и определения сложной смеси компонентов постепенно внедряются различные виды хроматографического анализа.[ . ]
Определение величины ХПК не требует специальных приборов, но занимает много времени. Были предложены различные ускоренные варианты метода, а также методы анализа очень мало загрязненных вод. В настоящей статье рассматривать подробности всех этих вариантов мы не будем, отметим лишь, что предлагаемые приемы (увеличение концентрации серной кислоты для ускорения реакции, переход на колориметрическое окончание взамен титриметрического, применяемого при определении малых величин ХПК) достигают цели. Однако при использовании сер-ной кислоты (больших концентраций) требуется периодическое сравнение получаемых результатов с результатами, которые дает стандартный метод, и введение необходимых поправочных коэффициентов. Разработаны и автоматические методы определения величин ХПК с различными окончаниями: потенциометрическим, газометрическим и др.[ . ]
В прямой потенциометрии определяют значение электродного потенциала, вычисляя затем концентрацию определяемого иона в растворе. В объемном методе анализа при потенциометрическом титровании цветной индикатор заменяют металлическим электродом. Окончание реакции определяется по резкому изменению электродного потенциала в эквивалентной точке — скачок потенциала.[ . ]
В том случае, когда надо определить количество отдельных сахаров или групп сахаров (гексозы и пентозы), отделив их от других редуцирующих веществ, применяют хроматографический метод. Анализ этим методом состоит из двух частей: 1) разделение редуцирующих веществ с помощью хроматографии на бумаге и 2) определение количества сахара, выделенного на бумажной хроматограмме, колориметрическим методом или эбу-лиостатическим потенциометрическим методом.[ . ]
Обязательные определения, которые следует выполнить на месте отбора проб, следующие: температура, pH, растворенный кислород, агрессивная С02. Определения, которые выполняют немедленно по получении проб сточных или речных вод в лаборатории, следующие: цвет, запах, прозрачность по стандартному шрифту, pH (по цветной шкале или потенциометрически, если почему-либо он не был определен на месте), кислотность или щелочность (титрованием с фенолфталеином и метиловым оранжевым), объем осадка (%), грубодисперсные примеси общие. Остальные определения, такие как солевой состав (сухой остаток общий), грубодисперсные примеси’прокаленные, ионы тяжелых металлов, хлориды, сульфаты и т. п., могут быть выполнены позже. Для определения цианидов и фенолов пробы в отдельных бутылках фиксируют щелочью из расчета 5 мл насыщенного раствора КОН на 0,5 л сточной воды. Методы химического анализа промышленных сточных вод опубликованы в специальной литературе [33, 78, 79].[ . ]
источник
Предназначены для определения определенного типа ионов в воде (Z.B. измерение концентрации [H] + (рН), Cl — , F — , Ca 2+ , Na + , K + и др.)
Методы основаны на использовании соотношении Нернста: ; (а = f×c) и измерении равновесного потенциала системы электродов.
Е – стандартный потенциал
n – валентность иона, концентрация которого измеряется
f – коэффициент активности
Потенциал нормального водородного электрода принят за ноль.
Платиновый электрод погружен в раствор с а = 1 (ионов Н + ) и подачей газообразного водорода к электроду. Считается ; значения других потенциалов определяется относительно .
Уравнение Нернста справедливо для равновесных потенциалов. Равновесным считается потенциал электрода, когда скорости окисления и восстановления на нем равны.
В системе электродов равновесный потенциал, когда ток не протекает либо очень маленький (отсутствует поляризация).
I. ИЭ – измерительный электрод (стеклянный), потенциал которого является f (рН)
ВЭ – вспомогательный хлор-серебряный электрод
Основным элементом ИЭ является чувствительная мембрана 1, которая выполнена из специального стекла
ЕИЭ = Е1 + Е2 + Е3 (Е1; Е2 = const; E3 = f (pH))
ЕЭС = ЕИЭ + ЕВЭ (ЭС – электродная система)
2 – полупроницаемая мембрана нужна для замыкания электрической цепи внутри анализируемого раствора, т.е. через нее пропускаются ионы К + и Cl —
Практическое значение – координаты изопотенциальной точки используются в системе термокомпенсации рН-метров.
Зависимость потенциала ИЭ от рН называют водородной функцией:
Недостатки системы: 1) высокое электрическое сопротивление стеклянной мембраны и соответствующего электрода в целом (>500 Ом) Þ требует очень высокого входного сопротивления у измерительных приборов ® через стеклянный электрод протекает I»10 -12 А. В связи с его малостью датчик рН и ВП не могут быть удалены друг от друга на значительное расстояние. Необходима сложная защита от помех вторичного прибора.
2) сложная в обслуживании и эксплуатации конструкция стеклянного электрода
3) эти электроды не выдерживают измерение рН при высоких температурах.
II.1 –
4 – амальгама на внутренней поверхности чувствительной мембраны
5 – точка контакта электрода
III. Полупроводниковая техника кампланарной технологии
1 – корпус датчика
2 – измерительный электрод
3 – вспомогательный электрод
5 – аналогово-цифровой преобразователь (АЦП)
6 – область, заполненная хорошо проводящим гелем
7 –ионо-селективная мембрана (в данном случае к Н + )
Å: 1) невысокое внутренне сопротивление (
10 кОм) электродной системы
2) возможность передачи сигнала на значительное расстояние без существенных помех
§2. Анализ воды с помощью иона селективности электрода
Существует свыше 100 ионо-селективных электродов. Их селективность определяется типом или видом чувствительной мембраны.
Принцип действия такой же, как и определение рН.
Недостатки: 1) необходимость периодической очистки или смены чувствительной мембраны из-за загрязнений
2) достаточно высокая чувствительность к содержанию К + и Na + (только стеклянные электроды)
Дата добавления: 2014-01-20 ; Просмотров: 881 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Теоретические основы потенциометрического анализа окружающей среды. Электрохимические системы в равновесном состоянии. Аппаратурное оформление потенциометрии. Анализ методик лабораторных исследований, аппараты, реактивы и материалы для их проведения.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Размещено на http://www.allbest.ru/
Министерство образования Российской Федерации
Саратовский государственный технический университет
Потенциометрический метод анализа состояния окружающей среды
Методические указания к выполнению лабораторных работ
по дисциплинам: «Технические средства и технологии контроля источников загрязнения» и «Экологический мониторинг»
для студентов специальности 280201.65
Составили: Собгайда Наталья Анатольевна
Ольшанская Любовь Николаевна
- 1.Теоретические основы потенциометрического анализа
- Сущность метода
- Электрохимические системы в равновесном состоянии
- Индикаторные электроды методов осаждения и комплексообразования
- Кривые потенциометрического титрования реакций осаждения и комплексообразования
- Индикаторные электроды метода окисления — восстановления
- Кривые потенциометрического титрования в окислительно-восстановительных реакциях
- 2. Аппаратурное оформление потенциометрии
- 3.Методики лабораторных исследований
- Исследование воздушной среды
- Анализ сточных вод производства пластификатора дибутилфталата методом потенциометрического титрования
- Определение непредельных соединений в сточных водах методом прямого потенциометрического титрования
- Определение меди в воде методом потенциометрического титрования
- Исследование полимеров
- Определение стирола в водных вытяжках из полимерных материалов методом прямого потенциометрического титрования
- Вопросы для самопроверки
- Литература
Применяется метод прямой потенциометрии и потенциометрическое титрование. Потенциометрический метод анализа используется для определения неорганических и органических соединений в различных объектах окружающей среды.
Потенциометрические методы анализа основаны на использовании зависимости электродвижущей силы электрохимической (потенциометрической) ячейки от концентрации (активности) определяемого вещества в анализируемом растворе. Простейшая потенциометрическая ячейка содержит два электрода: потенциал одного из них прямо или косвенно зависит от концентрации определяемого вещества — это индикаторный электрод (ИЭ); второй электрод (относительно которого измеряют потенциал (ИЭ) называют электродом сравнения.
Потенциометрические методы определения можно разделить на прямую потенциометрию (ионометрию) и потенциометрическое титрование. В ионометрии вначале по серии стандартных растворов строят калибровочную кривую или соответственно настраивают прибор (например, pH-метод), а затем по ЭДС потенциометрической ячейки с анализируемым раствором находят активность или концентрацию определяемого компонента. Наиболее часто метод прямой потенциометрии используется для определения pH-раствора. Для аналитических целей чаще используют потенциометрическое титрование.
Под потенциометрическим титрованием понимают любые потенциометрические методы определения веществ, использующих хотя бы однократное добавление к анализируемому раствору известного вещества (раствора), вне зависимости от того, происходит при этом химическая реакция или нет (методы добавок).
— использование электродноактивных титрантов позволяет определить вещества, для которых отсутствуют ионоселективные электроды.
потенциометрический анализ окружающая среда
Равновесный потенциал. Равновесный потенциал — величина электродного потенциала, возникшая на границе металл — раствор. Его зависимость от концентрации ионов металла в растворе выражается уравнением Нернста:
где Ex — потенциал металлического электрода при данной концентрации ионов металла в растворе; E — нормальный потенциал металлического электрода (при концентрации ионов, равной единице); CMe — концентрация ионов металла; R — газовая постоянная, R= 8,313 Дж; T — абсолютная температура; F — число Фарадея, F = 96500 K; n — заряд ионов металла. При потенциометрическом анализе используют уравнение (1), принимая температуру равной +25 0 C и подставляя соответствующие значения R и T с учетом коэффициента перехода от натуральных логарифмов к десятичным (2,3026). Тогда уравнение (1) будет иметь вид:
Окислительно-восстановительная система характеризуется определенным значением потенциала, фиксируемым платиновым электродом и зависящим от природы системы, от концентрации окисленной и восстановленной форм вещества:
где a, b и m ? соответствующие стехиометрические коэффициенты у окислителя, восстановителя и иона водорода из уравнения реакции; [H + ] — концентрация ионов водорода в анализируемом растворе.
Нормальные потенциалы. Для определения значения потенциала используют метод, основанный на сравнении потенциала одного электрода с потенциалом другого. В качестве эталона выбирают нормальный водородный электрод, представляющий собой платиновую пластинку, покрытую платиновой чернью, насыщенную водородом при нормальном атмосферном давлении и погруженную в раствор с активностью водородных ионов, равной 1 г-экв. Водород, адсорбированный платиной, ведет себя по отношению к водородным ионам в растворе так же, как металлический электрод по отношению к своим ионам. Установившееся равновесие соответствует уравнению
Потенциал водородного электрода условно принимают равным нулю, а любому другому электроду, измеренному по отношению к нему, приписывают потенциал, равный ЭДС гальванического элемента. Нормальным электродным потенциалом E называется потенциал электрода, погруженного в раствор соответствующей соли с активностью ионов в 1 г-экв, измеренный относительно нормального водородного электрода.
Заряд металлического электрода, стоящего в ряду активностей после водорода, будет отрицательным, до водорода — положительным.
Реальные потенциалы. В реальных условиях в ряде случаев значения нормальных потенциалов не могут служить для сравнения поведения систем. Обычно анализируемые растворы содержат кроме ионов, участвующих в окислительно-восстановительных реакциях, и ионы комплексообразователей, способных вступать во взаимодействие с окисленной или восстановленной формой вещества, оказывая влияние на величину окислительно-восстановительных потенциалов. Например, нормальный окислительно-восстановительный потенциал системы Fe 3+ /Fe 2+ равен +0,77 В; в присутствии цианид-ионов в результате комплексообразования электродный процесс окисления — восстановления осложняется:
и потенциал окислительно-восстановительной системы изменяется до +0,36 В.
Таким образом, реальный окислительно-восстановительный потенциал — потенциал, зависящий не только от свойств окислительно-восстановительной системы, но и от среды, в которой протекает реакция. В большинстве случаев его значение определяется экспериментально.
Электроды. Различают электроды первого и второго рода. Электроды первого рода — металл, погруженный в раствор соли этого же металла, образующий окислительно-восстановительную систему, в которой этот потенциал определяется только относительно концентрации катионов в растворе. К электродам первого рода относятся ртутные, серебряные, амальгамные, водородные и другие. Амальгамный электрод — металл, растворенный в ртути, обладает дополнительными преимуществами по сравнению с металлическим:
1) не реагирует с кислотами, так как водород на амальгаме выделяется с большим перенапряжением по сравнению с чистым металлом;
2) с ним быстрее устанавливается равновесие, чем с металлическим.
Электроды второго рода — металл, погруженный в раствор малорастворимой соли этого металла, содержащий избыток другой соли с одинаковым анионом, потенциал которого определяется концентрацией соответствующего аниона. К электродам второго рода относятся хлорсеребряный, каломельный и сурьмяный.
Электрод, реагирующий на изменение концентрации определяемого иона в растворе и заменяющий индикатор в условиях обычного титрования, называется индикаторным. Его потенциал определяется по отношению к неполяризуемому электроду, называемому стандартным, потенциал которого в процессе титрования постоянен и служит исключительно для определения потенциала индикаторного электрода. Последний выбирают в зависимости от типа реакций, лежащих в основе титрования, но во всех случаях его потенциал должен устанавливаться мгновенно соответственно концентрации титруемых ионов и не зависеть от наличия посторонних ионов.
Электроды, используемые для титрования кислот и оснований, являются индикаторными по отношению к концентрации ионов водорода. Мы рассмотрим два типа электродов: сурьмяный и стеклянный, которые, на наш взгляд, могут с успехом применяться в санитарно-химическом анализе для реакции нейтрализации и определения pH растворов.
Сурьмяный электрод Sb/Sb2O3 — электрод второго рода, составленный из металла и его малорастворимой окиси. Этот электрод используется для определения концентрации ионов водорода, так как металлический электрод в присутствии своего малорастворимого оксида выполняет функции водородного электрода.
Достоинства сурьмяного электрода:
— простота и удобство в обращении;
— возможность применения при анализе растворов кислот и щелочей;
— возможность применения при анализе растворов, содержащих электролитические яды — сульфиды, цианиды.
Недостаток сурьмяного электрода: не вполне обратимый электрод и измеряемые им потенциалы не вполне подчиняются уравнению Нернста.
Стеклянный электрод — стеклянный шарик диаметром 15 — 20 мм с толщиной стенок 0,06 — 0,1 мм, изготовленный из стекла, содержащего большое количество щелочных металлов — лития или натрия, и расположенный на конце стеклянной трубки. Если этот шарик заполнить раствором с определенным значением pH и опустить его в анализируемый раствор с другим значением pH, то на поверхности шарика возникает потенциал, величина которого изменяется соответственно разности pH между внутренним и внешним растворами. На поверхности стеклянного электрода устанавливается сложное равновесие, связанное со взаимной диффузией ионов водорода из раствора в стекло и ионов натрия или лития из стекла в раствор. Достоинства стеклянного электрода:
— на точность определения pH не влияет присутствие окислителей или восстановителей;
— на электрод не действуют яды, коллоиды и другие вещества, искажающие точность определений pH;
— позволяет работать с кислыми и щелочными растворами в широком диапазоне pH (от 0 до 12 — 13).
Недостатки стеклянного электрода:
1) нельзя использовать обычную потенциометрическую установку вследствие большого сопротивления электрода;
2) для усиления тока электродной пары со стеклянным электродом необходимо использовать струнные или зеркальные гальванометры или ламповые усилители;
3) при работе обнаруживается явление — «потенциал асимметрии стеклянного электрода».
Когда обе поверхности стеклянного электрода соприкасаются с растворами, концентрации водородных ионов в которых одинаковы, на внутренней и внешней поверхностях электрода возникают разные потенциалы. Это свидетельствует о различии в свойстве внутренней и внешней поверхностей стеклянного электрода из легкоплавкого стекла с большой электропроводностью, очень тонкими стенками и периодическим выдерживанием в воде, в слабощелочном буфере и в буфере с pH, равным pH внутреннего раствора стеклянного шарика. Чем больше потенциал асимметрии, тем менее устойчивы показания pH.
Кривые потенциометрического титрования реакции нейтрализации — изображение изменения pH раствора. Отдельные точки кривой титрования можно рассчитать по формулам для вычисления pH раствора соответствующих электролитов. При вычислении pH раствора сильных кислот или оснований, пренебрегая ионной силой раствора, концентрацию ионов H + или OH — можно приравнять к общей концентрации кислоты или щелочи.
Для вычисления pH слабых кислот и оснований, а также растворов их солей, подвергающихся гидролизу, необходимо учитывать соответствующие константы диссоциации:
для соли слабой кислоты и сильного основания
Электрод, опущенный в анализируемый раствор, должен быть индикаторным по отношению к концентрации ионов водорода. На поверхности такого электрода устанавливается равновесие (4).
Потенциометрическое титрование в методе нейтрализации находит ограниченное использование для целей санитарно-химического анализа. Ограничимся только изображением кривых потенциометрического титрования 0,1N раствора HCl 0,1N раствором NaOH с хингидронным электродом и кривых потенциометрического титрования 0,1М раствора Na2CO3 1N раствором HCl.
При этом изменением объема в процессе титрования пренебрегают, так как это не оказывает существенного влияния на значения потенциалов и характеристики кривых.
Другой тип электродов, используемых при осаждении и комплексообразовании, — это металлические электроды, покрытые труднорастворимой солью того же металла: хлористосеребряные, сернистортутные и т.п., образующие в системе следующие системы, определяющие их потенциалы:
источник
Потенциометрия — электрохимический метод анализа, основанный на возбуждении исследуемого раствора электрическим полем и измерении равновесного потенциала электрода, являющегося функцией концентрации потенциалопределяющего вещества.
Основы потенциометрии заложены В. Нернстом, который в 1889 году получил известное уравнение для равновесных электродных потенциалов. Вскоре потенциометрия начала применяться в аналитической химии, и в 1893 г. Р. Беренд провел первое потенциометриче — ское титрование. В настоящее время потенциометрия широко применяется в аналитической и физической химии и развивается в следующих направлениях:
• Редоксометрия — объединяет ряд методов, основанных на измерении окислительно-восстановительных потенциалов в растворе;
область прямой потенциометрии, которая объединяет методы прямого определения концентрации или активности ионов в различных фазах с использованием ионселективных электродов; к ионометрии относятся рН-метрия, катионо — и анионометрия;
• Определение термодинамических величин: свободной энергии, энтропии, энтальпии, активности (концентрации) в растворах и расплавах;
• Потенциометрическое титрование — наблюдение за ходом реакции титрования и нахождение точки эквивалентности (см. далее).
Метод потенциометрии измеряет разность потенциалов (ЭДС) двух электродов — измерительного и вспомогательного, — помещенных в исследуемый раствор. Поскольку величина ЭДС зависит от температуры, приборы (рН-метры или иономеры) снабжены температурным компенсатором, управляемым вручную или автоматически.
Различают прямую потенциометрию и потенциометрическое титрование.
Прямая потенциометрия сОстоит в измерении точной величины электродного потенциала и нахождении по уравнению Нернста активности потенциалопределяющего иона в растворе. Методом по- тенциометрии определяют рН водных и неводных растворов, в том числе производственных растворов олигомеров; анализируют кислые и основные примеси в диметилформамиде и диметилацетамиде; определяют хлорид-ионы и кислотные компоненты в производственных растворах, реакционные концевые группы в олигомерах и т. д. Кроме того, метод широко используют для расчета термодинамических констант электрохимических и химических реакций.
Потенциометрическое титрование оСновано на определении точки эквивалентности в реакциях нейтрализации, осаждения и комплексообразования по результатам потенциометрических измерений. Когда точно установлена эквивалентная точка титрования (окончание реакции), можно определить неизвестное количество вещества в контролируемом растворе — по расходу титрующего вещества (титранта) точно известной концентрации. При титровании определенного объема Vj раствора вещества неизвестной концентрации содержание вещества в растворе (в г-экв/л) легко вычислить по формуле
Где N — нормальность титранта; V — объем титранта; Nx — нормальность анализируемого раствора; V> — объем анализируемого раствора.
Вблизи точки эквивалентности происходит резкое изменение (скачок) потенциала индикаторного электрода; величина скачка потенциала зависит от силы титруемого раствора кислоты или основания и от концентрации раствора. При титровании смеси кислот различной силы появляется несколько скачков. Более наглядно отношение изменения потенциала ЛЕ к соответствующему изменению объема титранта AV, поэтому точку эквивалентности обычно определяют по максимуму на графике зависимости AE/AVот V.
Метод потенциометрического титрования, как и визуальное обнаружение конечной точки титрования (с помощью индикаторов), преследует чисто прикладную цель определения анализируемого вещества в растворе, однако он обладает рядом преимуществ:
• исключает субъективные ошибки, связанные с визуальными наблюдениями;
• более чувствителен, т. е. при той же точности можно определять меньшие количества вещества;
• позволяет осуществлять титрование в мутных и окрашенных растворах, когда затруднена или совсем исключена возможность использования цветных индикаторов;
• дает возможность дифференцированно (последовательно) определять смесь веществ из одной порции раствора;
• позволяет автоматизировать процесс титрования.
Метод потенциометрического титрования широко используют в аналитической химии высокомолекулярных соединений, особенно для анализа растворов и эмульсий [2]:
• Анализ эмульгаторов (олеаты и парафинаты калия, аммония и три — этаноламина) по определению в них общей и свободной щелочности, или кислотности. Взятую навеску эмульгатора растворяют в 60 %-ном растворе этанола и титруют кислотой или щелочью [3].
• Определение общей щелочности латекса. Навеску латекса титруют 0,1 Н раствором соляной кислоты [4]. Число КОН натурального латекса характеризует его качество и показывает количество граммов едкого кали, необходимое для нейтрализации жирных кислот, приходящихся на 100 г сухого вещества латекса [5].
• Измерение содержания эмульгатора в латексе. Навеску латекса растворяют в смеси воды и изопропилового спирта (1:1), добавляют 0,1 Н раствор НС1 и титруют 0,1 Н раствором КОН [6].
• Установление порога коагуляции (железного числа) латекса [7]. Стабильность латексов определяют по так называемому железному числу, показывающему, какое количество азотнокислого железа в граммах необходимо для полной коагуляции 100 г исходного латекса. Для этого взятую навеску латекса титруют раствором азотнокислого железа.
• Определение фенольных антиоксидантов в водах (например, после выделения каучука из латекса) проводят путем экстракционного концентрирования с последующим потенциометрическим анализом [8].
Поскольку большинство полимеров в воде нерастворимы, их
Аналитическая химия базируется на Неводном титровании. При кислотно-основном титровании в неводных средах в большинстве случаев используют стеклянный электрод в качестве индикаторного, а насыщенный каломельный — в качестве электрода сравнения. Для анализа очень слабых кислот и оснований, в частности функциональных групп полимеров, когда незначительные примеси воды в растворителе снижают резкость скачков потенциала, насыщенный водный раствор в каломельном электроде заменяют насыщенным метанольным раствором КС1 или раствором хлорида калия в растворителе, который используют для титрования. В неводных растворах могут применяться также платиновый электрод (в сочетании с хлорсеребряным электродом сравнения), ион-селективные электроды.
Растворители участвуют в электрохимической реакции только в тех случаях, когда их молекулы способны к диссоциации или образуют водородные связи (пиридин, метанол). К растворителям промежуточной группы, влияющим на реакцию нейтрализации в некоторой степени, относятся ацетон, ацетонитрил, нитрометан и др. Для определения кислот пригодны растворители: инертные (бензол, толуол, хлорбензол, метилэтилкетон, ацетон, ацетонитрил), основные и про — тофильные (этилендиамин, н-бутиламин, пиридин, диметилацетамид, диметилформамид, 1,4-диоксан, трет.-бутанол, изопропиловый, этиловый, метиловый спирты, пропиленгликоль). Для определения оснований применяют растворители: инертные (н-гексан, циклогексан, диок — сан, четыреххлористый углерод, бензол, толуол, хлороформ, хлорбензол, метилэтилкетон, ацетон, ацетонитрил), кислотные и протогенные (муравьиную, уксусную и пропионовую кислоты, уксусный ангидрид, нитробензол, этиленгликоль, изопропиловый спирт). Растворители, участвующие в неводном титровании, не должны содержать примесей кислот и оснований и воды.
При анализе соединений основного характера в неводных растворах в качестве титрантов используют растворы хлорной кислоты и хлористого водорода, желательно в тех же растворителях, в которых титруют определяемые вещества; использование кетоновых растворов повышает резкость конечной точки титрования. Хлорная кислота — одна из самых сильных в неводной среде, что обусловливает ее широкое применение. При анализе соединений с кислыми свойствами используют спиртовые растворы неорганических оснований или Щелочных металлов, уксуснокислые растворы ацетатов щелочных металлов. Самыми сильными основными титрантами в неводных средах являются растворы четвертичных аммониевых оснований — гидроксиды тетраметил-, тетраэтил — и тетрабутиламмония. По сравнению с растворами гидроксидов щелочных металлов они лучше растворимы в органических растворителях, не оказывают вредного воздействия на стеклянный электрод, устойчивы в течение длительного времени. Эти растворы готовят в основном в среде метанола или изопропанола или в смеси бензола с метанолом в соотношении от 3:1 до 20:1.
Потенциометрические методы непрерывно развиваются и совершенствуются. Например, разработан [9] прибор, позволяющий получать картину распределения рН в исследуемом материале с пространственным разрешением в одном направлении — мкм, в другом — мм. На основе современных технологий предлагаются [10] микродатчики рН с использованием оптических волокон. Разрабатываются полностью автоматизированные (рН, объем титранта, интервал между порциями титранта и др.) приборы — титраторы для кислотно — основного титрования водных растворов серии Titratine 96 Schott, основанные на совершенно новой концепции титрования [11].
источник
Предназначены для определения определенного типа ионов в воде (Z.B. измерение концентрации [H] + (рН), Cl — , F — , Ca 2+ , Na + , K + и др.)
Методы основаны на использовании соотношении Нернста:
(а = fc) и измерении равновесного потенциала системы электродов.
Е — стандартный потенциал
n — валентность иона, концентрация которого измеряется
f — коэффициент активности
Потенциал нормального водородного электрода принят за ноль.
Платиновый электрод погружен в раствор с а = 1 (ионов Н + ) и подачей газообразного водорода к электроду. Считается ; значения других потенциалов определяется относительно .
Уравнение Нернста справедливо для равновесных потенциалов. Равновесным считается потенциал электрода, когда скорости окисления и восстановления на нем равны.
В системе электродов равновесный потенциал, когда ток не протекает либо очень маленький (отсутствует поляризация).
I. ИЭ — измерительный электрод (стеклянный), потенциал которого является f (рН)
ВЭ — вспомогательный хлор-серебряный электрод
Основным элементом ИЭ является чувствительная мембрана 1, которая выполнена из специального стекла
ЕЭС = ЕИЭ + ЕВЭ (ЭС — электродная система)
- 2 — полупроницаемая мембрана нужна для замыкания электрической цепи внутри анализируемого раствора, т.е. через нее пропускаются ионы К + и Cl —
- 3 — корпус
Практическое значение — координаты изопотенциальной точки используются в системе термокомпенсации рН-метров.
Зависимость потенциала ИЭ от рН называют водородной функцией:
Недостатки системы: 1) высокое электрическое сопротивление стеклянной мембраны и соответствующего электрода в целом (>500 Ом) требует очень высокого входного сопротивления у измерительных приборов через стеклянный электрод протекает I10 -12 А. В связи с его малостью датчик рН и ВП не могут быть удалены друг от друга на значительное расстояние. Необходима сложная защита от помех вторичного прибора.
- 2) сложная в обслуживании и эксплуатации конструкция стеклянного электрода
- 3) эти электроды не выдерживают измерение рН при высоких температурах.
- 4 — амальгама на внутренней поверхности чувствительной мембраны
- 5 — точка контакта электрода
III. Полупроводниковая техника кампланарной технологии
- 1 — корпус датчика
- 2 — измерительный электрод
- 3 — вспомогательный электрод
- 4 — датчик температуры
- 5 — аналогово-цифровой преобразователь (АЦП)
- 6 — область, заполненная хорошо проводящим гелем
- 7 -ионо-селективная мембрана (в данном случае к Н + )
: 1) невысокое внутренне сопротивление (
10 кОм) электродной системы
- 2) возможность передачи сигнала на значительное расстояние без существенных помех
- 3) низкая стоимость
Существует свыше 100 ионо-селективных электродов. Их селективность определяется типом или видом чувствительной мембраны.
Принцип действия такой же, как и определение рН.
Недостатки: 1) необходимость периодической очистки или смены чувствительной мембраны из-за загрязнений
2) достаточно высокая чувствительность к содержанию К + и Na + (только стеклянные электроды)
источник