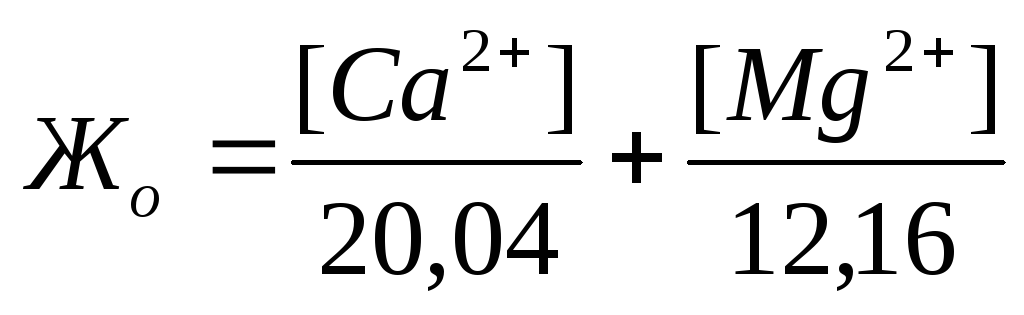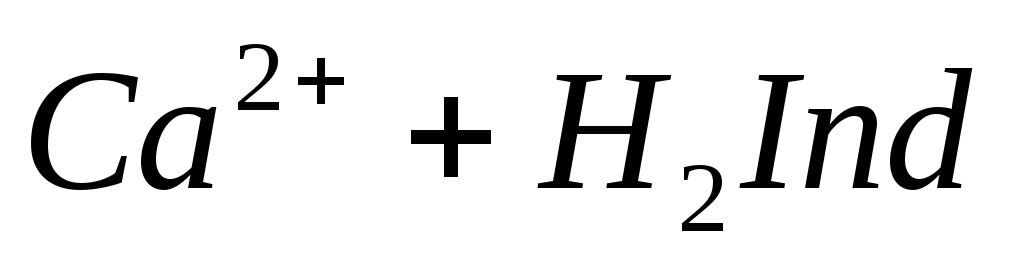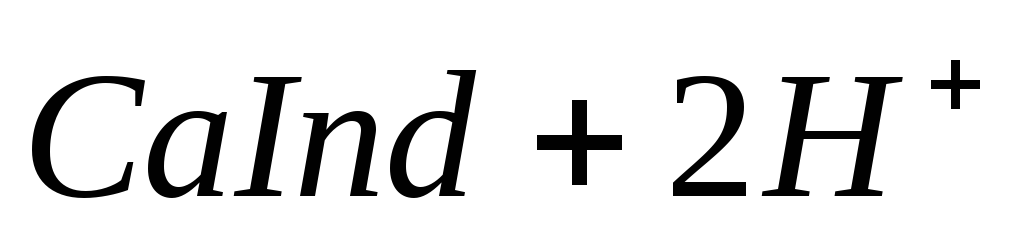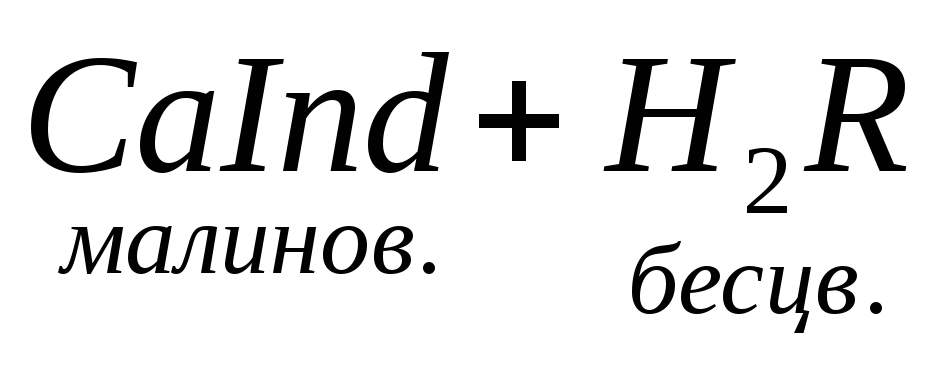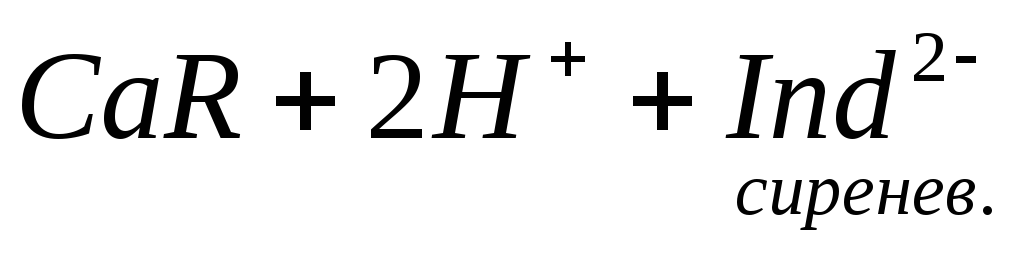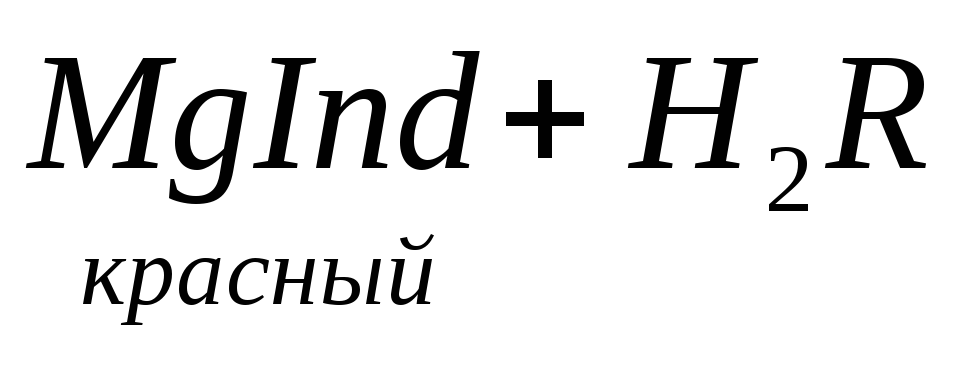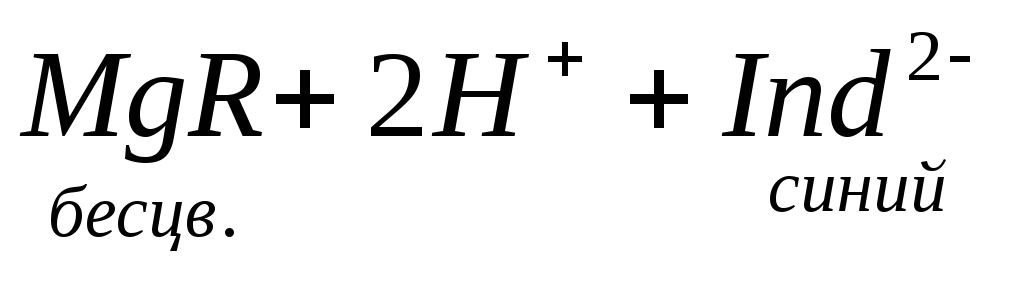Зачем нужен количественный анализ воды (сточных вод)? Условия проведения анализа. Правила забора и хранения пробы. Требования к персоналу и уровню безопасности. Нормативные документы, регламентирующие проводимые анализы. Виды количественного анализа. Титриметрия. Гравиметрия. Разновидности инструментального количественного анализа. Количественный анализ воды (сточных вод) позволяет очень точно определить концентрацию того или иного элемента или соединения. Такому анализу могут подвергаться различные виды воды. В нашей статье речь пойдёт о сточных водах.
Существует множество различных методик, позволяющих определить концентрацию определённых веществ в жидкости. При этом для обнаружения различного содержимого используются разные методики и способы подсчёта. Например, чтобы вычислить содержание формальдегида в питьевой воде используется одна методика, которая не позволит определить концентрацию этого вещества в краске. А для обнаружения и подсчёта массовой доли нефтепродуктов в сточных водах применяется метод колоночной хроматографии с гравиметрическим окончанием, который может использоваться только для этих целей.
Любые измерения и вычисления дают определённую долю погрешности. Обычно допустимые отклонения регламентируются ГОСТом номер 27384 с названием «Вода. Нормы погрешности измерений показателей состава и свойства».
В зависимости от определяемого содержимого и используемых реагентов количественный химический анализ воды должен выполняться с соблюдением всех правил безопасности:
- При использовании химических реактивов необходимо придерживаться правил безопасности, оговоренных в ГОСТе 12.4.019.
- В момент использования электрического оборудования для выполнения процедуры анализа нужно придерживаться правила электробезопасности, описанных в ГОСТ 12.1.019.
- Весь персонал, проводящий испытания и анализы, должен пройти инструктаж по технике безопасности согласно ГОСТ12.0.004.
- Место (кабинет, лаборатория, организация), где проходят испытания, должно отвечать условиям по пожаробезопасности, которые описываются в ГОСТ 12.1.004.
- Кабинеты в обязательном порядке укомплектовываются устройствами для гашения пожара по ГОСТ 12.4.009.
Проводить количественный анализ жидкости можно только при соответствующих условиях окружающей среды, а именно:
- температура воздуха в помещении должна быть в пределах от 15 до 25 градусов;
- допустимое атмосферное давление составляет 84-106 кПа;
- в помещении должна быть влажность в пределах 75-85 %;
- для электрического оборудования частота тока – 49-51 Гц;
- напряжение 210-230 В.
Забор и хранение проб жидкости выполняется согласно таким условиям:
- для отбора и хранения образцов используются специальные ёмкости из стекла с плотно прилегающими крышками.
- Если проведение испытаний откладывается на длительный срок, то производят консервацию проб в смеси экстрагента с водой. В таком состоянии пробы могут сохраняться до 14 дней.
- Обычно для проведения анализа достаточно использовать пробу жидкости объёмом 3-3,5 дм³.
- Взятие пробы производится с составлением соответствующего акта, где указываются цели проведения анализов, искомые элементы и частицы (чаще загрязнители), дата, время и место взятия пробы, порядковый номер пробы, фамилия, инициалы, а также должность человека, выполняющего забор пробы.
Все методики количественного анализа можно разделить на:
- одномерные или однокомпонентные;
- двумерные или многокомпонентные.
Обычно для обнаружения одного элемента в жидкости достаточно использовать метод титриметрии или гравиметрии. Для обнаружения больше числа составляющих в сточной воде могут использоваться более сложные инструментальные методики. Но у более простых методов есть одно преимущество – простота проведения и точность анализа.
Если количественный химический анализ сточных вод выполняется с целью обнаружения одного искомого компонента, то метод титриметрии самый подходящий. Эта методика анализов базируется на точных измерениях количества двух компонентов, участвующих в химической реакции.
Этот метод относится к группе одномерных испытаний, поэтому он позволяет вычислить объём только одного элемента. При этом не обязательно искать только одно какое-то вещество, анализ позволяет определить целую группу веществ. Например, подобный анализ позволяет очень точно определить содержание в стоках частиц кальция и магния, характеризующих жёсткость воды. Точность данных испытаний очень высока, хотя чувствительность этой методики несколько ниже, чем при инструментальных исследованиях. Именно поэтому метод не может использоваться для вычисления концентрации остаточных веществ.
Простота и точность данной методики анализа очень высока, но его трудоёмкость и длительность проведения также значительны. Данный метод подразумевает выделение искомого элемента с его взвешиванием впоследствии.
При этом искомый элемент может отделяться как в чистом виде, так и в виде какого-либо соединения. Процесс отделения вещества может выполняться методом возгонки или осаждения. В итоге искомый элемент преобразуется в плохо растворяющийся осадок. Затем этот осадок фильтруется, высушивается, подвергается прокаливанию и только потом взвешивается для определения его массы и объёма.
Инструментальный количественный анализ сточных вод может выполняться при помощи следующих методик:
- Газовая хроматография с месс-спектрометрическим детектированием (разделение веществ в газовой фазе).
- Жидкостная хроматография высокой эффективности (разделение веществ в жидком состоянии).
- Электрофорез капиллярный (разделение сложных составляющих в кварцевом капилляре).
- Инфракрасная спектрофотометрия.
- Атомно-эмиссионная спектроскопия.
У нас вы можете заказать количественный анализ жидкости, который мы проведём довольно быстро и по приемлемой цене. Для этого вам необходимо связаться с нашими специалистами по телефонам, указанным на сайте.
источник
Объем гидрохимических работ, количество, сроки, место и способы взятия проб зависят от целей гидрохимических исследований.
Для рыбохозяйственных целей могут быть выполнены:
1)газовый анализ воды (определяют физические свойства воды, содержание растворенного кислорода, углекислого газа, концентрацию ионов водорода (рН), наличие и количество сероводорода, аммиака);
2)краткий анализ воды (кроме определений, перечисленных в газовом анализе, определяют окисляемость, щелочность, карбонатную жесткость воды и общее содержание растворенного железа);
3)полный общий анализ воды, который включает определение физических свойств (температуры, прозрачности, цвета, запаха и вкуса); содержания кислорода, углекислого газа, сероводорода, аммиака; концентрации ионов водорода (рН) и щелочности, общей, карбонатной жесткости; окисляемости нефильтрованной и фильтрованной воды; содержания альбуминоидиого азота, солевого аммиака, нитритов, нитратов, фосфатов, различных форм железа, кремния; сульфатов, хлоридов, кальция и магния.
Целью специальных исследований может быть определение содержания металлов и микроэлементов.
Полученные результаты сравнивают с нормативными значениями показателей качества воды, приведенными в таблице.
Большинство природных вод мало минерализовано, поэтому для количественного определения многих компонентов, растворенных в воде, требуются точные методики. Вместе с тем они должны быть достаточно простыми, не требующими сложного и дорогостоящего оборудования, доступными для выполнения в полевых условиях и в относительно небольших гидрохимических лабораториях рыбоводных хозяйств.
Методики исследования химического состава воды должны быть едиными при изучении водоемов в различных целях; для того чтобы полученные данные можно было сравнить и использовать.
Определения не должны занимать много времени, так как надо стремиться все необходимые показатели определить в течение 1 -2 сут.
Используемые в настоящее время в практических целях методы химического анализа природных вод можно разделить на:
1) химические (весовые, объемный анализ); 2) электрохимические (потенциометрический, кондуктометрический, полярографический); 3) оптические (фотометрические и спектрофотометрические, люминесцентный, спектральный анализ); 4) фотохимические, 5) хроматографичсские (жидкостная колоночная хроматография, тонкослойная хроматография, газовая хроматография и т.д.).
Наиболее распространены в гидрохимии первые три группы методов. К химическим методам относятся методы, предусматривающие проведение химической реакции и последующее количественное определение образующихся продуктов. Из химических методов при анализе природных вод широко используется метод объемного анализа. Основным преимуществом объемного анализа являются простота, быстрота определения, а также широкие возможности использования разнообразных химических свойств веществ. Именно благодаря этим достоинствам метода объемного анализа в настоящее время являются основными при определении макрокомпонентов природных вод. Суть объемного метода заключается во взаимодействии исследуемого компонента с реактивом, который добавляется в виде раствора определенной концентрации (титрованный раствор) до того момента, когда количество прибавленного реактива не станет эквивалентно количеству определяемого компонента в растворе. Этот процесс называется титрованием, а момент окончания титрования — точкой эквивалентности. Конец титрования обычно устанавливают по изменению цвета индикатора, т.е. вещества, которое изменяет вою окраску при концентрациях реагирующих веществ, близких к точке эквивалентности. Индикатор и условия титрования выбирают так, чтобы точка титрования индикатора совпадала с точкой эквивалентности или была, возможно, ближе к последней.
Процесс титрования осуществляется следующим образом.
В коническую колбу помещают исследуемую пробу воды, раствор индикатора, по каплям добавляют из бюретки титрующий раствор при постоянном перемешивании. Титрование продолжают до изменения цвета окраски в колбе. Обычно для установления конечной точки титрования используют «свидетель», в качестве которого обычно применяется проба, оттитрованная до эквивалентной точки. Сравнение окрасок следует производить на белом фоне. По окончании титрования по бюретке отмечают количество затраченного на титрование раствора.
В зависимости от типа реакций методы объемного анализа делятся на четыре большие группы: 1) кислотно-основное титрование, 2) титрование окислителями и восстановителями; 3) методы осаждения; 4) методы, основанные на образовании комплексов.
При кислотно-основном титровании в качестве титрованных растворов обычно применяют кислоты и щелочи. Определять этим методом можно кислоты, щелочи, соли слабых кислот и оснований; в частности, в гидрохимии этим методом определяют диоксид углерода и гидрокарбонаты.
Титрование окислителями и восстановителями применяется в гидрохимии в основном при определении растворенного кислорода и окисляемости.
Методы объемного анализа, основанные на реакциях осаждения, используются при определении сульфатов и хлоридов.
Примером титрования с образованием комплексов могут служить реакции взаимодействия ионов кальция и магния с трилоном Б, которые лежат в основе определения общей жесткости воды.
Электрохимические методы основаны на измерении электрохимических свойств компонентов — окислительного потенциала, электрической проводимости, силы полярографического тока и т.д. Простота выполнения определений, легкость автоматизации, высокая чувствительность делают эти методы весьма перспективными в анализе вод.
В основе оптических методовлежит способность всех веществ поглощать лучистую энергию в виде квантов, соответствующих определенным длинам волн. Линии или полосы поглощения при этом располагаются в ультрафиолетовой, видимой или инфракрасной областях спектра и могут использоваться для количественной оценки (см. лаб. раб.№2.).
В процессе выполнения анализа записи следует вести в табличной форме. При применении объемного метода рекомендуется форма табл.1(приложение), фотоколориметрического — табл.2(приложение) и при определении окисляемости перманганатным методом — табл.3 (приложение).
Такие таблицы позволяют легко произвести расчет, устранить неясности и при необходимости быстро проверить правильность вычислений.
Пользуясь указанными выше методами, результаты анализа выражают в виде
источник
Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
состав растворенных газов.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей.
Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или
12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO32 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO32 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общаяжесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам:
Общая жесткость
Карбонатная жесткость равна концентрации (мг/л) [HCO3– ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:
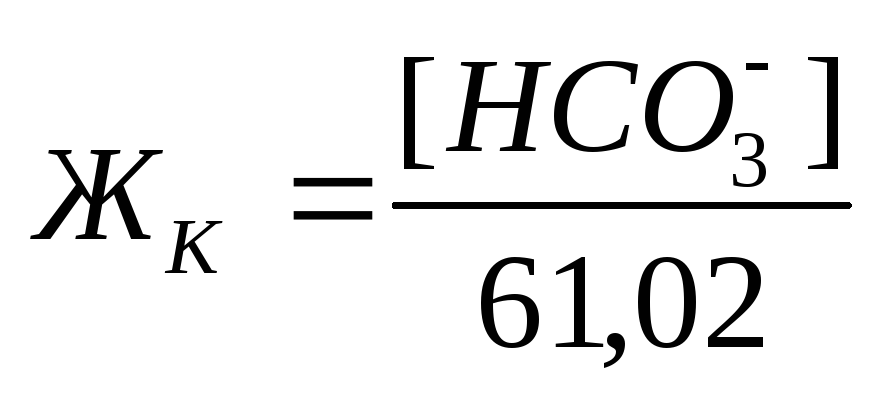
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК= ЖО– ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Окисляемость характеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества.
Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме
требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л.
При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Определение иона Cl – . В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO42– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO42– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO42– .
Определение ионов CO32– и HCO3– . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии.
Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO32 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО32– и НСО3– , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния:
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)
N
образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет.
Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:
Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна:
С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка.
Растворенные в воде газы определяют химическими методами или газовой хроматографией.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
Определение растворенного кислорода производится йодометрическим методом.
Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом:
Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе:
Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия:
I2+ 2Na2S2O3
Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II):
Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску.
В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания.
Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом.
В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом:
К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе.
источник
ЧАСТЬ I. КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ ВОД
(Предлагаемые ООО «ТСК Девон»)
ЧАСТЬ I. КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ ВОД
Номер ПНД Ф и название МКХА
Срок действия свидетельства
Методика выполнения измерений массовой концентрации ионов аммония в природных и сточных водах фотометрическим методом с реактивом Несслера.
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации железа в природных и сточных водах фотометрическим методом с о-фенан — тролином.
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации нитрит-ионов в питьевых, поверхностных и сточных водах фотометрическим методом с реактивом Грисса.
ПНД Ф 14.1:2:4.3-95 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации нитрат-ионов в в питьевых, поверхностных и сточных водах фотометрическим методом с салициловой кислотой.
ПНД Ф 14.1:2:4.4-95 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации нефтепродуктов в питьевых, поверхностных и сточных водах методом ИК-спектрометрии.
ПНД Ф 14.1:2:4.5-95 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации бензола и толуола в пробах природных и очищенных сточных вод методом газожидкостной хроматографии (ГЖХ).
ПНД Ф 14.1:2.6-95 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации 1.2‑дихлорэтана, хлороформа, четыреххлористого углерода в пробах природных и очищенных сточных вод методом газожидкостной хроматографии (ГЖХ).
ПНД Ф 14.1:2.7-95 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации неионогенных ПАВ в пробах сточных вод экстракционно-фотометри-ческим методом.
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации анионных поверхностно-активных веществ в питьевых, поверхностных и сточных водах экстракционно-фотометрическим методом.
ПНД Ф 14.1:2:4.15-95 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации катионных ПАВ в пробах природных и очищенных сточных вод экстракционно-фотометрическим методом.
ПНД Ф 14.1:2.16-95 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации химически потребляемого кислорода (ХПК) в пробах природных и сточных вод бихроматно-потенциометрическим методом.
Методика измерений массовой концентрации ртути в питьевых, поверхностных и сточных водах методом беспламенной атомно-абсорбционной спектрометрии.
ПНД Ф 14.1:2:4.20-95 (издание 2011 г.)
Поверхностные и сточные воды
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации анионоактивных ПАВ в природных, питьевых и сточных водах на анализаторе жидкости “Флюорат‑02”
Методика выполнения измерений массовой концентрации меди в пробах природной, питьевой и сточной воды на анализаторе жидкости “Флюорат‑02”.
ПНД Ф 14.1:2:4.28-95 (издание 2005 г.)
Методика выполнения измерений массовой концентрации ионов кобальта в природных и сточных водах фотометрическим методом с нитрозо-R-солью.
ПНД Ф 14.1:2.44-96 (издание 2004 г.)
Дата выдачи 02.02.2004 г. без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации ионов кадмия в природных и сточных водах фотометрическим методом с дитизоном.
ПНД Ф 14.1:2.45-96 (издание 2004 г.)
Дата выдачи 02.02.2004 г без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации никеля в сточных водах фотометрическим методом с диметилглиоксимом.
ПНД Ф 14.1.46-96 (издание 2004 г.)
Дата выдачи 02.02.2004 г. без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации молибдена в природных и сточных водах фотометрическим методом с роданидом аммония.
ПНД Ф 14.1:2.47-96 (издание 2004 г.)
Дата выдачи 02.02.2004 г. без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации ионов меди в питьевых, поверхностных и сточных водах фотометрическим методом с диэтилдитиокарбаматом свинца.
ПНД Ф 14.1:2:4.48-96 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации ионов мышьяка в природных и сточных водах фотометрическим методом с диэтилдитиокарбаматом (ДДК) серебра.
ПНД Ф 14.1:2.49-96 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации общего железа в питьевых, поверхностных и сточных водах фотометрическим методом с сульфосалициловой кислотой.
ПНД Ф 14.1:2:4.50-96 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации висмута в природных и сточных водах фотометрическим методом с тиокарбамидом.
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации ионов хрома в питьевых, поверхностных и сточных водах фотометрическим методом с дифенилкарбазидом.
ПНД Ф 14.1:2:4.52-96 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации цианидов в природных и сточных водах фотометрическим методом с пиридинбензидином.
ПНД Ф 14.1:2.53-96 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации свинца в природных и очищенных сточных водах фотометрическим методом с дитизоном.
ПНД Ф 14.1:2.54-96 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации олова в природных и сточных водах фотометрическим методом с фенилфлуороном.
ПНД Ф 14.1:2.55-96 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации цианидов в природных и сточных водах фотометрическим методом пириди — ном и барбитуровой кислотой.
ПНД Ф 14.1:2.56-96 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации ионов цинка в питьевых, поверхностных и сточных водах фотометрическим методом с дитизоном.
ПНД Ф 14.1:2:4.60-96 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации марганца в природных и сточных водах фотометрическим методом с применением персульфата аммония.
ПНД Ф 14.1:2.61-96 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации нефтепродуктов в природных и очищенных сточных водах методом колоночной хроматографии со спектрофотометрическим окончанием.
ПНД Ф 14.1:2.62-96 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерения массовых концентраций сульфит, сульфат и тиосульфат ионов в природных и сточных водах, технологических растворах методом ионной хроматографии.
Методика измерений массовой концентрации хлорид-ионов в питьевых, поверхностных и сточных водах меркуриметрическим методом.
ПНД Ф 14.1:2:4.111-97 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации фосфат-ионов в питьевых, поверхностных и сточных водах фотометрическим методом с молибдатом аммония.
ПНД Ф 14.1:2:4.112-97 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации “активного хлора” в питьевых, поверхностных и сточных водах титриметрическим методом.
ПНД Ф 14.1:2:4.113-97 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации сухого остатка в питьевых, поверхностных и сточных водах гравиметрическим методом.
ПНД Ф 14.1:2:4.114-97 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации неионогенных ПАВ в пробах природных и очищенных сточных вод фотометрическим методом с фосфорно-вольфрамо вой кислотой.
ПНД Ф 14.1:2.115-97 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации нефтепродуктов в пробах природных и сточных вод методом колоночной хроматографии с гравиметрическим окончанием.
ПНД Ф 14.1:2.116-97 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений рН в водах потенциометрическим методом.
ПНД Ф 14.1:2:3:4.121-97 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации жиров в пробах поверхностных и сточных вод гравиметрическим методом.
ПНД Ф 14.1:2.122-97 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений биохимического потребления кислорода после n‑дней инкубации (БПКполн.) в поверхностных прес — ных, подземных (грунтовых), питьевых, сточных и очищенных сточных водах.
ПНД Ф 14.1:2:3:4.123-97 (издание 2004 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации сульфат-иона в пробах природных и сточных вод турбидиметрическим методом.
ПНД Ф 14.1:2.159-2000 (издание 2005 г.)
Дата выдачи свидетельства 23.12.2004 г.
без указания окончания срока действия.
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации фенола в пробах питьевых, природных и сточных вод методом газожидкостной хроматографии ГЖХ.
ПНД Ф 14.1:2:4.177-02 (издание 2011 г.)
Дата выдачи свидетельства 23.05.2011 г.
Рекомендуемый срок пересмотра
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации фторид-ионов в питьевых, поверхностных, подземных пресных и сточных водах фотометрическим методом с лантан (церий) ализарин комплексоном.
ПНД Ф 14.1:2:3:4.179-2002 (издание 2012 г.)
Дата выдачи свидетельства 15.03.2012 г.
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации кадмия в поверхностных, подземных пресных и сточных водах фотометрическим методом с бромбензтиазо.
ПНД Ф 14.1:2:3.180-2002 (издание 2012 г.)
Дата выдачи свидетельства 15.03.2012 г. без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации висмута в питьевых, поверхностных, подземных пресных и сточных водах фотометрическим методом с тиокарбамидом.
ПНДФ 14.1:2.196-2003 (издание 2012 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации селена в пробах питьевых, природных и сточных вод фотометрическим методом с о-фенилендиамином
ПНД Ф 14.1:2:4.203-03 (издание 2008 г.)
Дата выдачи свидетельства 18.08.2008 г.
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений массовой концентрации общего азота в природных и сточных водах титриметрическим методом
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений цветности питьевых, природных и сточных вод фотометрическим методом
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика выполнения измерений мутности питьевых, природных и сточных вод турбидиметрическим методом по каолину и по формазину
Дата выдачи свидетельства 27.06.2005 г.
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовых концентраций железа, кадмия, кобальта, марганца, никеля, меди, цинка, хрома и свинца в питьевых, поверхностных и сточных водах методом пламенной атомно-абсорбционной спектрометрии
ПНД Ф 14.1:2:4.214-06 (издание 2011 г.)
Дата выдачи свидетельства
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации кремнекислоты (в пересчете на кремний) в питьевых, поверхностных и сточных водах фотометрическим методом в виде желтой кремнемолибденовой гетерополикислоты
ПНД Ф 14.1:2:4.215-06 (издание 2011 г.)
Дата выдачи свидетельства
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации лигнинсульфоновых (лигносульфоновых) кислот в поверхностных и сточных водах фотометрическим методом
ПНД Ф 14.1:2.216-06 (издание 2011 г.)
Дата выдачи свидетельства
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации бора в питьевых, поверхностных, подземных пресных и сточных водах фотометрическим методом с АШ-резорцином.
ПНД Ф 14.1:2:3:4.237-2007 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации ванадия (V) в питьевых, поверхностных, подземных пресных и сточных водах фотометрическим методом с N-бензоил-N-гидроксиламином.
ПНД Ф 14.1:2:3:4.238-2007 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации свинца в питьевых, поверхностных, подземных пресных и сточных водах хроматным фотометрическим методом с дифенилкарбазидом.
ПНД Ф 14.1:2:3:4.239-2007 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации сульфат-ионов в питьевых, поверхностных, подземных и сточных водах гравиметрическим методом.
ПНД Ф 14.1:2:3:4.240-2007 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации полиакриламида в питьевых, поверхностных, подземных пресных и сточных водах адсорбционно-фотометрическим методом.
ПНД Ф 14.1:2:3:4.241-2007 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений свободной и общей щелочности в питьевых, поверхностных, подземных пресных и сточных водах методом потенциометрического титрования.
ПНД Ф 14.1:2:3:4.242-2007 (издание 2011 г.)
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации летучих фенолов в питьевых, поверхностных, подземных пресных и сточных водах газохроматографическим методом.
ПНД Ф 14.1:2:3:4.244-2007 (издание 2011 г.)
Фенол, гваякол, о-крезол, п, м-крезолы (сумма),
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений свободной и общей щелочности в питьевых, поверхностных, подземных пресных и сточных водах титриметрическим методом.
ПНД Ф 14.1:2:3:4.245-2007 (издание 2012 г.)
Дата выдачи свидетельства 15.03.2012 г.
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
Методика измерений массовой концентрации ионов аммония в питьевых, поверхностных (в том числе морских) и сточных водах фотометрическим методом с реактивом Несслера.
Питьевые, поверхностные пресные и сточные воды
Поверхностные морские воды
без указания окончания срока действия
По вопросу приобретения обращаться в ООО «ТСК Девон» (1)
1.По вопросам приобретения данных методик просим обращаться в ООО «ТСК Девон».
Юридический адрес: 420111, РТ, г. Казань, ул. Лево-Булачная,24
Почтовый адрес: 421001, РТ, г. Казань, ул. Адоратского, д2 офис 3.
источник
Методики количественного химического анализа питьевой и природной воды для внелабораторных и лабораторных условий
А. Муравьёв, к.х.н., ЗАО «Крисмас+», muravyov@christmas-plus.ru
В докладе освещён опыт специалистов производственно-лабораторного комплекса ЗАО «Крисмас+» по разработке и аттестации ряда новых методик количественного химического анализа (КХА) для определения показателей качества питьевой и природной воды. Приводятся рабочие условия измерений для ряда методик, более широкие по сравнению с указанными в большинстве действующих НТД классов ПНД Ф 14 и РД 52.24, а также другие преимущества — портативность оборудования, унификация средств дозирования и др. Показаны возможности модификации действующих НТД и отличительные признаки, определяющие необходимость аттестации этих методик в соответствии с Законом «Об обеспечении единства измерений». Продемонстрированы особенности проведённых аттестационных исследований, ставящих целью установление метрологических характеристик рассматриваемых методик. Отличие использованного подхода при аттестации состоит в следовании международно признанным способам выражения точности результатов.
Представлены возможности использования методик в полевых (внелабораторных) и лабораторных условиях как непосредственно, так и применительно к созданию портативных специализированных комплектов для химических измерений.
Разработка и аттестация методики химического количественного анализа (КХА) считается специалистами непростой задачей. Создание подобной методики для внелабораторных условий всегда представлялось проблематичным. А разработка несложного оборудования, позволяющего реализовать химические измерения в полевых условиях стала возможной благодаря многолетней работе специалистов санкт-петербургского научно-производственного объединения ЗАО «Крисмас+». Данные работы выполнялись в порядке мероприятий по обеспечению единства и правильности измерений с использованием производимого ЗАО «Крисмас+» оборудования – тест-комплектами и портативными лабораториями для анализа воды, и включали работы по аттестации ряда новых методик количественного химического анализа для определения показателей качества питьевой и природной воды. Перечень разработанных и аттестованных методик приведён в таблице 1.
Диапазон
определяемых
концентраций
Номер свидетельства об аттестации/ Рег. код МВИ по ФР
ФМ, с молибдатом аммония и аскорбиновой кислотой
ФМ, с лантан(III)ализаринкомплексоном
489/242-( 01.00250-2008)-2013/ ФР.1.31.2014.17765
ТМ, с индикатором ортаниловым К
Учитывая, что измерения с применением портативного оборудования могут выполняться в полевых (внелабораторных) условиях, следовало установить также рабочие условия измерений, создающие удобства для оператора. Это также стало возможным благодаря проведённым аттестационным исследованиям. В табл.2 приведены рабочие условия измерений для новых («полевых») методик, пригодных для внелабораторного применения.
Тест-комплекты, полевые лаборатории
Типовая методика КХА воды
(*) За исключением требований к фотоэлектроколориметру.
Из данных табл. 2 следует, что новые аттестованные методики, по сравнению с данными для типовых методик КХА воды (классов ПНД Ф 14 и РД 52.24), характеризуются более широкими значениями рабочих температур, в то время как давление и относительная влажность не являются регламентированными параметрами.
Следует отметить и другие преимущества вновь аттестованных методик, состоящие в возможности использования портативного оборудования, унифицированных средств дозирования реактивов, растворов и проб и т.п.
В настоящее время существуют различные методики КХА проб воды, регламентирующие действующими нормативными документами химические измерения подчас одних и тех же показателей разными методами. Поэтому, при решении поставленных перед разработчиками задач в области метрологии и качества измерений, при проектировании оборудования следовало либо в максимальной степени воспользоваться текстом существующей методики, модифицировав её, либо, признав отличия в применяемых средствах измерений и др. посуде существенными, проводить разработку методики как новой и проводить её метрологическую аттестацию. Метрологическая аттестация необходима не только в случае применения методики и соответствующего портативного оборудования в области технического регулирования, но и для создания доверия к соответствующей продукции со стороны потребителей. Проведённые работы показали возможности модификации действующих НТД и позволили сформулировать отличительные признаки, определяющие необходимость аттестации этих методик в соответствии с Законом «Об обеспечении единства измерений» (или подтвердить, что аттестации методики не требуется).
В соответствии с Федеральным законом № 102-ФЗ «Об обеспечении единства измерений» (Статья 5) методики измерений, используемые в сфере государственного регулирования обеспечения единства измерений, подлежат аттестации. Содержание работ по аттестации методик измерений определено в ГОСТ Р 8.563-2009. В ходе аттестации должны быть найдены метрологические характеристики методики и подтверждено соответствие методики установленным в данной области измерений метрологическим требованиям. Отличие нашего подхода в аттестации методик КХА проб воды состоит в том, что мы следуем международно признанным способам выражения точности результатов.
К числу основных метрологических характеристик относятся диапазон и показатели точности измерений; установление показателей точности – наиболее важный аспект аттестационных исследований. В этой работе ВНИИМ им. Д. И. Менделеева следовал рекомендациям международных метрологических организаций, таких как Объединённый Комитет по Руководствам в Области Метрологии (JCGM), и, прежде всего, — правилам и рекомендациям, сформулированным в Руководстве по выражению неопределённости измерений (JCGM 100:2008, ГОСТ Р 54500.3-2011). Применительно к задачам химического анализа эти правила и разработанные на их основе примеры изложены в документе ЕВРАХИМ Количественное описание неопределённости в аналитических измерениях (QUAM), который служит основой в работе по аттестации методик химического анализа во ВНИИМ.
Рассмотрение всех источников неопределённости в методиках анализа и составление так называемого бюджета неопределённости представляет собой весьма трудный и ответственный этап работы. Накопленный опыт по аттестации методик анализа вод, разрабатываемых ЗАО «Крисмас+» и применимых к использованию во внелабораторных условиях, позволяет сосредоточить внимание на нескольких источниках неопределённости, характерных для таких методик, и оптимизировать экспериментальные подходы к их оцениванию.
Эти, типичные, источники неопределённости таковы:
♦ Случайный разброс результатов
В методиках анализа вод обычно предусматривается выполнение двух параллельных определений, что позволяет получить оценку повторяемости уже на стадии разработки методики, при анализе проб известного состава с целью проверки правильности измерений.
♦ Установление градуировочной характеристики
Эта составляющая неопределённости объединяет экспериментальный разброс, погрешности линейной аппроксимации градуировочной функции, приготовление градуировочных растворов и степень чистоты используемых для этого реактивов (стандартных образцов).
♦ Температура окружающего воздуха
Важность этой составляющей неопределенности связана с относительно широким диапазоном температур (от 10°С до 35°С), в котором применяются полевые методики. В простейшем случае речь идет о влиянии температуры (т.е. отличия рабочей температуры от той, при которой выполнена градуировка) на концентрацию растворов. В более сложных случаях приходится учитывать влияние температуры на протекание химической реакции, лежащей в основе аналитического метода.
♦ Влияние мешающих компонентов
Это наиболее трудно оцениваемый источник неопределённости. Необходимую информацию можно получить из специально поставленных экспериментов исходя из предполагаемого содержания мешающих компонентов в пробах и ограничений, устанавливаемых в методике.
Процесс оценивания неопределенности измерений включает несколько этапов:
- Описание измеряемой величины;
- Выявление источников неопределенности;
- Количественное выражение составляющих неопределенности;
- Вычисление суммарной неопределенности.
Примером аттестационных исследований может служить оценивание неопределенности измерений в одной из аттестованных методик КХА – «Методике измерений массовой концентрации нитрит-ионов в пробах питьевой и природных вод фотометрическим методом на основе тест-комплекта «Нитриты». Диапазон измерений по методике: от 0,040 до 2,0 мг/дм 3 . В основе методики лежит образование (по реакции с реактивом Грисса) окрашенного соединения с максимумом поглощения при l = 520 нм.
Ниже, для иллюстрации расчётного аппарата аттестационных исследований, приводим (выборочно) материал из бюджета неопределённости, составленного по итогам исследований названной методики КХА.
Измеряемая величина и полное уравнение измерений описываются формулой:
где:
C – массовая концентрация нитрит-ионов, мг/дм 3 ;
D – оптическая плотность раствора, е.о.п.;
a и b – градуировочные коэффициенты;
k — коэффициент разбавления;
f T , f МК– поправочные множители, учитывающие влияние таких факторов, как температура и мешающие компоненты.
(Числовые значения f Tи f МК принимаются равными единице, но их неопределенности входят в бюджет.)
Относительная расширенная неопределенность U , %:
U=ku c ,
где u c — относительная суммарная стандартная неопределенность, %;
k = 2 — коэффициент охвата.
Относительная суммарная стандартная неопределенность u c
включает следующие составляющие:
s — относительное стандартное отклонение результатов измерений в условиях повторяемости, %;
u ГХ— относительная неопределённость, связанная с установлением градуировочной характеристики, %;
u ГР относительная неопределённость в концентрации градуировочных растворов, %, которая в свою очередь включает неопределённость, связанную с значением стандартного образца, u CO, неопределённость, связанную с приготовлением стандартных растворов, u CP, и неопределённость, связанную с приготовлением градуировочной серии, u ГС;
u k — относительная неопределённость в значении коэффициента разбавления, %;
u T — относительная неопределённость, связанная с влиянием температуры, %;
u MK— относительная неопределённость, связанная с наличием в пробе мешающих компонентов, %.
Полученные оценки составляющих неопределённости приведены в «Бюджете неопределённости измерений», прилагаемому к свидетельству об аттестации методики.
Из полученных материалов следует, что относительная расширенная неопределённость измерений по данной методике составляет:
(33,3 – 223·С) % в диапазоне от 0,040 до 0,099 мг/дм 3 и 10 % в диапазоне от 0,10 до 2,0 мг/дм 3 .
Согласно ГОСТ 27384-2002 «Нормы погрешности измерений показателей состава и свойств», норма погрешности измерений нитритов в водах составляет 25 % (при концентрации на уровне 3,0 мг/дм 3 ).
Из полученных результатов следует, что рассматриваемая методика измерений соответствует установленным метрологическим требованиям.
Образцы портативного оборудования, разработанного для применения в полевых и лабораторных условиях, приведены на рисунке.
Рисунок. Портативное оборудование для анализа воды в полевых и лабораторных условиях:
а – портативная экспресс-лаборатория НКВ-12;
б – тест-комплекты.
Универсальность применения оборудования для анализа вод к использованию как в полевых, так и в лабораторных условиях, обуславливает перспективность разработанных образцов для применения в учебных и мало оснащённых профессиональных лабораториях, в том числе при настольном использовании оборудования (в частности, экспресс-лаборатории НКВ-12), что позволяет создать значительную экономию средств и других ресурсов.
Таким образом, выполненный комплекс работ по созданию пригодных для внелабораторного применения методик КХА питьевой и природной вод позволил разработать и обосновать характеристики при анализе с применением универсального портативного оборудования, применимого для полевых и лабораторных исследований проб.
источник