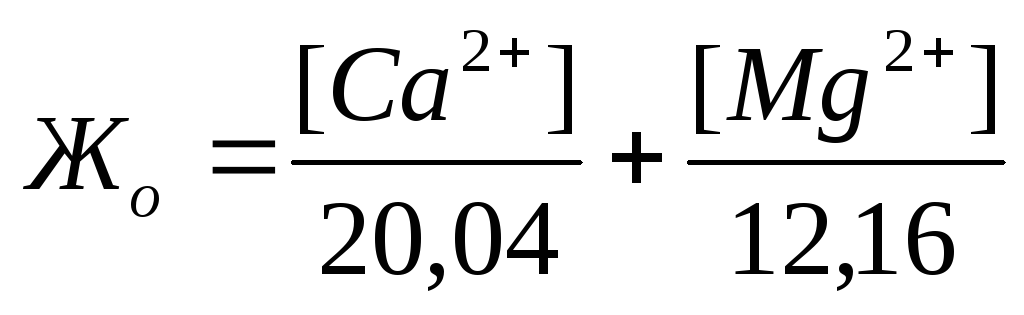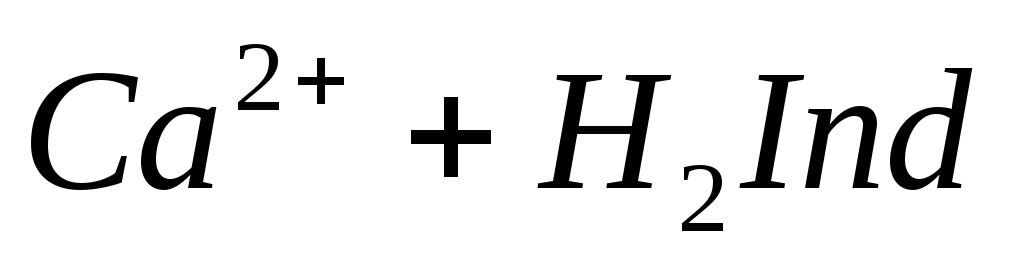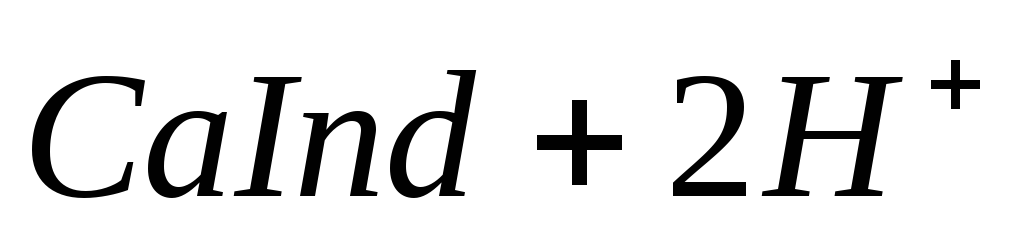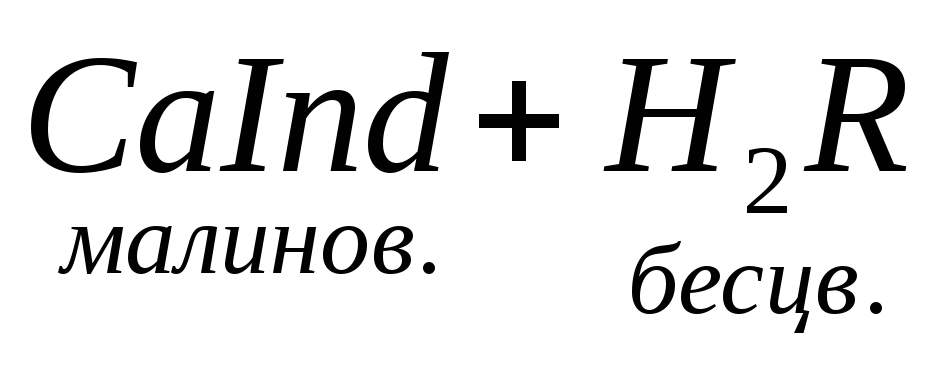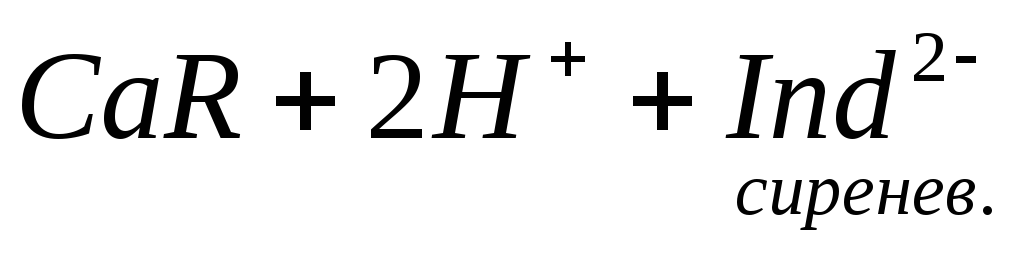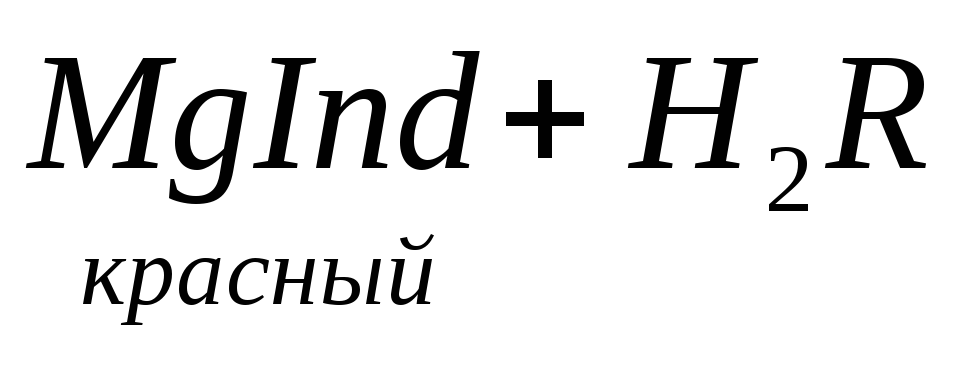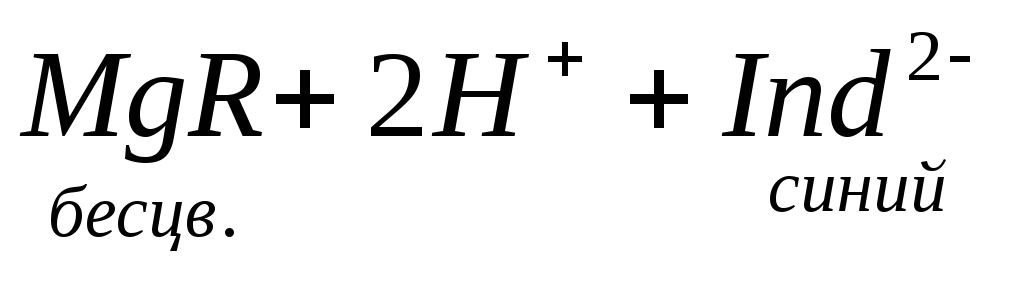Показатели качества питьевой воды и их санитарно-токсикологическая характеристика
К физическим показателям качества воды относят температуру, запах, привкус, цветность, мутность. Они определяют органолептические качества воды.
Химические показатели характеризуют химический состав воды. К ним обычно относят: водородный показатель воды рН, жесткость и щелочность, минерализация (сухой остаток), содержание органических и неорганических веществ.
Санитарно-бактериологические показатели характеризуют общую бактериальную загрязненность воды, загрязненность ее кишечной палочкой, содержание в воде токсичных и радиоактивных компонентов.
Эпидемические показатели. Вода является идеальной средой для размножения бактерий, микробов: возбудителей брюшного тифа, паратифов, холеры, дизентерии, вирусного гепатита и т.д. Вода может быть переносчиком различного рода глистов. В связи с обильным содержанием патогенных организмов, анализ воды проводят по «показательным» микробам (к примеру, кишечной палочке). Требования СанПиН — в 100 мл воды не должно быть кишечной палочки, количество бактерий в 1 мл воды не должно превышать 50.
Органолептические показатели.
Запах воды может быть: болотный, гнилостный, землистый, сероводородный, ароматический, хлорный, фенольный, хлорфенольный, нефтяной и др.
Привкус воды может быть: кисловатым, солоноватым, горьковатым, сладковатым.
Наличие запахов и привкусов говорит о содержании (возможно превышенном) в воде газов, минеральных солей, органических веществ, нефтепродуктов, микроорганизмов. Как правило, с повышением температуры запахи и привкусы усиливаются. Вода, используемая для питья, не должна иметь при температуре 60 о С оценку более 2 баллов.
Цветность — окраска воды в тот или иной цвет. Свидетельствует о наличии в воде выше нормы высокомолекулярных соединений почвенного характера, железа в коллоидной форме, загрязнений сточных вод. Цветность не должна превышать 20 о стандартной платинокобальтовой шкалы.
Мутность — иначе прозрачность. Зависит от наличия в воде взвешенных частиц. Использование мутной воды для питьевого водоснабжения нежелательно и даже недопустимо.
Химические показатели.
Водородный показатель рН — показатель концентрации в воде водородных ионов. Его величина характеризует фон водной среды: от кислого до щелочного. Для питьевой воды величина рН должна составлять от 6 до 9. Изменение значения рН должно быть сигналом о нарушении технологического режима водоподготовки.
Общая минерализация (сухой остаток) — суммарная концентрация анионов, катионов и растворенных в воде органических веществ. Влияет на органолептические свойства воды (вкуса). По сухому остатку можно судить о содержании в воде неорганических солей. Вода с повышенной минерализацией влияет на секреторную деятельность желудка, нарушает водно-солевое равновесие, в результате чего наступает рассогласование многих метаболических и биохимических процессов в организме. Содержание сухого остатка в питьевой воде нормируется величиной не более 1000 мг/л.
Жесткость воды — обусловлена наличием в ней катионов кальция и магния. Взаимодействуя с карбонатными ионами, при высоких температурах они образуют малорастворимые соли. Поэтому жесткие воды могут образовывать накипь и отложения на бытовой технике, котлах, трубопроводах горячей воды. При использовании жесткой воды для стирки белья ее необходимо предварительно умягчать. Установлена статистически достоверная связь между жесткостью воды и развитием сердечно-сосудистых заболеваний (частотой инфаркта миокарда). Есть предположение о роли жесткости воды в развитии мочекаменной болезни. Жесткость воды для питьевых целей ограничена концентрацией 7 ммоль/л.
Органические и неорганические вещества.
Общее число химических веществ, загрязняющих природные воды и оказывающих неблагоприятное воздействие на здоровье человека, в настоящее время превышает 50 000. Их содержание в воде строго регламентировано требованиями СанПиН. Гигиеническое значение их обусловлено их биологической ролью.
При содержании фтора в воде более 1,5 мг/л может развиться флюороз, менее 0,7 мг/л — кариес зубов.
Чрезмерное содержание молибдена в воде приводит к увеличению активности ксантиноксидазы, щелочной фосфотазы, увеличению мочевой кислоты в крови и моче.
При низком поступлении в организм йода, развивается эндемический зоб, внешне проявляющийся в увеличении размеров щитовидной железы.
Ртуть — токсичный элемент, наличие ее в воде приводит к болезни Минамата, для которой характерно поражение центральной нервной системы.
Алюминий — нейротоксичен, способен накапливаться в нервной ткани, печени и , что особенно важно, в жизненно важных областях головного мозга, приводя к тяжелым расстройствам функции центральной нервной системы.
Барий — высокотоксичное вещество. При поступлении в организм, барий аккумулируется в костной ткани, что усугубляет его опасность для здоровья.
Бериллий — высокотоксичный и кумулятивный клеточный яд. Хорошо всасывается в желудочно-кишечный тракт. При поступлении в организм высоких концентраций бериллия с питьевой водой, наблюдаются серьезные расстройства половой сферы у представителей обоих полов.
Мышьяк — считается доказанной, роль мышьяка, содержащегося в воде, в возникновении опухолевых заболеваний.
Нитраты и нитриты — нитраты в воде в 1,5 раза токсичнее нитратов содержащихся в овощах. Повышенное содержание нитратов в воде вызывает токсический цианоз. Всасывание нитратов приводит к повышению содержания метгемоглобулина в крови.
Свинец — кумулятивен в костях. Поражает нервную систему, почки, приводит к раннему атеросклерозу, нарушению процесса образования эритроцитов. Детским организмом свинец усваивается в 3-4 раза интенсивнее, чем взрослым.
Железо — вода, когда ее перекачивают насосом прозрачна и бесцветна. Но по мере того, как отдельные молекулы этого соединения собираются вместе, появляется характерный ржавый цвет (такую воду часто называют «красной водой» или «ржавой водой»). В воде, содержащей железо, неизбежно образовываются железобактерии — рассадник бактерий самого различного класса и уровня опасности для организма человека. По мере нарастания, эти бактерии образуют красно-коричневые наросты, которые забивают трубы и снижают напор воды. Разлагающаяся масса этих бактерий является причиной неприятного запаха и вкуса воды.
Вода с повышенным содержанием железа имеет металлический привкус. Такая вода оставляет следы буквально на всем. Даже при самом малом содержании железа в воде (0,3 мг/л) она оставляет ржавые пятна на любой поверхности. Железо добавляет много трудностей как в быту, так и в промышленности (особенно в пищевой). Даже там, где концентрация железа низка, его ни в коем случае нельзя игнорировать. Наличие железа в воде представляет серьезную проблему еще и потому, что оно обладает большой химической повторяемостью элементов. Нерастворимые соединения железа могут образовывать илистые отложения в водонапорных резервуарах, водонагревателях и других водопроводных установках.
Повышенное содержание железа в воде (а следовательно в организме человека) является причиной серьезных аллергенных заболеваний.
Марганец — спутник железа. Обычно его встречают в железосодержащей воде. Марганец, соприкасаясь с чем-либо, оставляет темно-коричневые или черные следы даже при его минимальных концентрациях в воде (0,05 мг/л). Собираясь в водопроводных трубах, марганец дает черный осадок, от чего вода становится мутной.
Повышенное содержание марганца отрицательно влияет на высшую нервную систему, систему кровообращения, на работу поджелудочной железы, провоцирует болезни эндокринной системы, увеличивает возможность заболеваний онкологического характера.
Не случайно, Стандарт питьевой воды США установил минимальную норму присутствия марганца в воде равную 0,05 мг/л.
Медь — придает воде неприятный вяжущий привкус.
источник
Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
состав растворенных газов.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей.
Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или
12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO32 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO32 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общаяжесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам:
Общая жесткость
Карбонатная жесткость равна концентрации (мг/л) [HCO3– ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:
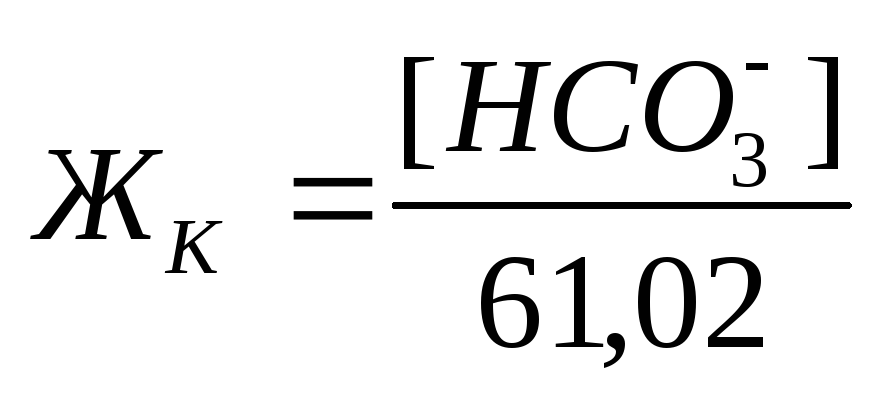
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК= ЖО– ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Окисляемость характеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества.
Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме
требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л.
При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Определение иона Cl – . В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO42– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO42– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO42– .
Определение ионов CO32– и HCO3– . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии.
Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO32 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО32– и НСО3– , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния:
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)
N
образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет.
Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:
Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна:
С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка.
Растворенные в воде газы определяют химическими методами или газовой хроматографией.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
Определение растворенного кислорода производится йодометрическим методом.
Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом:
Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе:
Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия:
I2+ 2Na2S2O3
Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II):
Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску.
В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания.
Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом.
В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом:
К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе.
источник
О качестве питьевой воды сказано не мало. Вопросы чистоты и безопасности обсуждаются как среди населения, так и на законодательном уровне. На сегодняшний день качество питьевой воды в России регулируют всевозможные правила и нормы, которые указывают на то, что питьевая вода должна быть безопасна для человека как в эпидемиологическом, так и в радиационном плане, иметь безвредный химический состав и обладать хорошим вкусом и запахом. Факторы качества питьевой воды подразделяются на органолептические, химические и микробиологические.
Под органолептикой воды понимают ее вкус, запах, мутность и цветность. Проверять данные показатели рекомендуется ежемесячно для воды из рек и озер и не менее четырех раз в год (один раз в сезон) для воды из родников и скважин.
На вкус воды влияют растворенные остатки растений и животных, соли, химические вещества и другие загрязнения. Посторонние привкусы могут присутствовать не только в природной воде, но и появиться во время водоподготовки.
Разные группы веществ придают воде свой уникальный привкус: хлорид натрия делает воду соленой, углекислый газ – кислой, сульфат магния – источник горечи.
Чистая вода не должна иметь никаких запахов. В том случае, если запах в воде все же есть, нужно прислушаться к нему, таким образом, природу загрязнений можно определить самостоятельно. Например, если присутствует запах тухлых яиц – в воде превышена концентрация сероводорода, запах гнили свидетельствует о наличии органических остатков, запах нефтепродуктов – признак того, что в воду попали промышленные отходы.
Запах воды определяют в два этапа: сначала при температуре 20°C, затем 60 °C. Оценивают его по пятибальной шкале, где 0 – полное отсутствие, 5 – сильный запах. По нормам (СанПиН 2.1.4.559-96 ПИТЬЕВАЯ ВОДА. Гигиенические требования к качеству воды
централизованных систем питьевого водоснабжения. Контроль качества. ) максимальный допустимый балл – 2.
Под цветностью понимают окраску воды, которую вызывают растворенные в ней вещества. Чаще всего причиной цвета являются гуминовые кислоты, а также примеси железа. Способствовать изменению цвета воды могут и промышленные отходы, попадающие в поверхностные источники вместе с промышленными сточными водами. Уровень цветности определяют по платино-кобальтовой шкале цветности раствора и измеряют в градусах. Допустимая цветность воды по СанПин составляет 20 градусов.
Мутность воды характеризуется содержанием в ней взвеси, которой могут быть соли металлов, песок, глина, бактерии и микроорганизмы. Чаще всего образуется в процессе размывания дна водоема, попадания в него талых и сточных вод. Мутность не только создает благоприятные условия для развития бактерий, но и служит преградой при дезинфекции.
Если вода изначально мутная, но после отстаивания светлеет, а на дно выпадает осадок – в ней содержится песок и глина. Если же вода мутнеет не сразу, то, скорее всего она загрязнена солями металлов, которые в процессе соприкосновения с воздухом окисляются.
Согласно СанПин мутность воды не должны превышать 1,5 мг. взвеси на дм3 воды.
Данная группа показателей отвечает за содержание в воде различных химических веществ и подразделяется на следующие виды: интегральные, органические и неорганические.
В интегральные показатели воды входят кислотность, жесткость, окисляемость и сухой остаток. остаток.
Кислотность воды определяется водородным показателем pH . В зависимости от уровня pH вода может быть кислая или щелочная. Оптимальный показатель pH питьевой воды по СанПин варьируется от 6 до 9.
Жесткость воды характеризуется наличием в ней извести и солей магния. Вода с повышенным содержанием солей называется жесткой, вода с минимальным их количеством – мягкой. Допустимый показатель солей – 7 ммоль на 1 л. воды.
Различают постоянную и временную жесткость воды. Постоянная жесткость получила название некарбонатной, временная – карбонатной. Временная жесткость вызвана наличием гидрокарбонатов кальция и магния и легко устраняется кипячением, выпадая в осадок. Причина постоянной жесткости – сульфаты и хлориды кальция и магния.
Жесткая вода портит бытовые приборы, приводит к сухости волос и кожи, способствует образованию камней в почках.
Под окисляемостью понимается присутствие в вод веществ, которые окисляются под влиянием химических элементов. Выделяют три вида окисляемости: перманганатную, бихроматную и иодатную. На практике чаще всего используют окисляемость перманганатную, измеряется она в количестве кислорода, затраченного на окисление веществ, предельно допустимый показатель 5 мг/л воды.
Сухой остаток – данный показатель указывает на количество растворенных в воде элементов. По СанПин количество взвесей в воде может достигать 1000 мг/л, при большем количестве ухудшаются вкус и запах, а также появляется мутность.
подразумевают под собой оптимальное содержание в воде различных металлов.
Железо в больших концентрациях способно вывести из строя сантехнику, придает неприятный желтоватый оттенок белью в процессе стирки, а также влияет на органолептику: вода приобретает посторонний запах и становится мутной. Кроме того, переизбыток металла в организме приводит к аллергии и дерматиту, становится причиной развития онкологических заболеваний. Оценка питьевой воды на уровень содержания железа не просто прихоть, а необходимость. Согласно СанПин 2.1.4.1074-01, предельная норма железа в воде составляет 0,3 мг/л.
Марганец – источник металлического привкуса воды. Вода с превышенным содержанием данного металла образует черный налет на водопроводных трубах, который постепенно отслаивается и выпадает в осадок. Превышенное содержание марганца в организме придает серый цвет ногтям и зубам. Допустимая концентрация элемента ниже, чем у железа и составляет 0,1 мг/л.
Причиной превышения уровня ртути в воде чаще всего являются техногенные аварии. Металл губительно влияет на любую ткань, с которой соприкасается. При регулярном употреблении с высокой концентрацией ртути нарушается психика, теряется чувствительность кожи, ухудшается слух и зрение, возникают проблемы с сердечно-сосудистой системой. Для того, чтобы избежать таких последствий, важно знать предельно допустимую безопасную концентрацию металла, которая по нормам качества питьевой воды составляет 0,0005 мг/л.
Алюминий в большом количестве, превышающем 0,5 мг/л, способствует параличу центральной нервной системы человека, провоцирует артрит и остеопороз.
Сульфаты содержатся в большей части поверхностных вод. Естественная причина их образования – растворение минералов, содержащих серу и окисление сульфидов серы. Большая часть сульфатов – следствие отмирания растений, а также окисления органических веществ. Другой источник сульфатов – стоки производственных предприятий. Превышение соединений серы в питьевой воде ухудшает органолептические показатели. Взаимодействуя с кальцием и магнием, сульфаты способствуют образованию накипи. Согласно СанПин допускается 500 мг сульфатов на 1 литр воды.
Нитраты в излишнем количестве ведут к кислородному голоданию тканей, что является причиной заболевания «нитратная метгемоглобинемия». Попадают в природные воды данные соединения вместе с химическими и натуральными удобрениями. По СанПин норма нитратов составляет 45 мг/л.
Хлориды в большом количестве, превышающем 350 мг/л, делают воду коррозионно-активной, что ведет к повреждению трубопровода, а также появлению ржавчины на сантехнике.
О загрязненности воды органическими вещества судят по количеству содержащегося углерода. К органическим веществам относят остатки мертвых растений и животных, выделения водных обитателей, гуминовые кислоты и т.д. Органика ведет к изменению органолептических показателей, в частности, к ухудшению вкуса и запаха.
Микробиологическую оценку проводят, анализируя наличие термотолерантных колиформных бактерий, цист лямблий, колифагов, а также оценивая общее микробное число, которое по нормативам не должно превышать 50 на 1 мл. воды.
Проверка качества питьевой воды осуществляется по нормам СанПин. В России существуют два ключевых документа: СанПиН 2.1.4.1074-01, выдвигающий список гигиенических требований к качеству воды централизованных систем питьевого водоснабжения» и СанПиН 2.1.4.1175-02, в котором перечислены показатели качества воды нецентрализованного водоснабжения, а также отрегулирована санитарная охрана источников. Документы находятся в свободном доступе.
В СанПин и в результатах анализа воды встречаются следующие термины:
ПДК – предельно-допустимые концентрации вещества, при которых данное вещество не оказывает вреда организму человека. Превышенное количество – стимул к очищению воды.
ОДУ – ориентировочно допустимый уровень вещества в воде, имеет временный характер, устанавливается по результатам экспериментальных методов прогнозирования токсичности.
Часто в анализах воды указывают класс опасности. Согласно нормативным документам существуют следующие классы опасности:
- 1К – чрезвычайно опасные элементы;
- 2К – высоко опасные вещества;
- 3К – опасные соединения;
- 4К – вещества умеренно опасные.
Другим показателем, отраженным в анализах, является токсичность вещества. Санитарно-токсикологические признаки обозначаются «с-т». В группе органолептических признаков существуют следующие аббревиатуры: зап – вещество изменяет запах воды, окр – элемент окрашивает воду, привк – изменение вкуса и оп – вещество может вызывать опалесценцию. Также в результатах может присутствовать термин «КОЕ», расшифровывающийся как колониеобразующие единицы.
Перечисленные выше вещества можно выявить с помощью экспресс-анализа питьевой воды. Проверку реально провести как в лаборатории, так и собственными силами. В лаборатории, как правило, оценивают образец по 10-12 показателям. Для того, чтобы результаты были верными, воду необходимо набирать в чистую стеклянную тару, предварительно обработав руки и вентиль крана спиртом. Рекомендуются сначала спустить воду на протяжении 10-15 минут. Доставлять образец в лабораторию лучше в плотном черном пакете.
Экспресс-анализ воды в домашних условиях подразумевает использование специальных тест-приборов. С помощью устройств можно провести как комплексную проверку, так и анализ воды на содержание какого-то конкретного вещества. К базовым показателям качества питьевой воды относят уровень щелочности, концентрацию железа, хлора, а также содержание нитратов и нитритов. Приборы для экспресс-оценки различаются не только специализацией на каком-либо конкретном загрязнителе, но и делятся в зависимости от источника питьевой, воду из которого необходимо проверить – скважины, родника или реки.
Своевременный анализ питьевой воды позволит вовремя провести ее очистку, а, значит, поможет сохранить здоровье.
источник
Качество питьевой воды во многом определяет здоровье человека. Выраженный избыток минералов в воде из артезианской скважины может стать причиной образования камней в почках или желчном пузыре. Органические загрязнители в избыточном количестве станут причиной аллергических реакций и болезней печени. Наличие нитратов и неорганических соединений приводит к медленному отравлению организма человека. Своевременно проведенный химический анализ воды из скважины поможет предотвратить массу проблем со здоровьем, особенно в тех случаях, когда нет другой альтернативы для получения питьевой воды.
Это только кажется, что вода, извлеченная из глубин земли, будет всегда идеально чистая и абсолютно безвредная. Кроме естественных загрязнителей, большое значение на качество подземных вод оказывает человеческая деятельность. Пробурив артезианскую скважину, следует посмотреть, понюхать и попробовать воду.
Первым делом состояние воды из артезианской скважины можно оценить «на глаз». Видимые изменения в виде мутности и выраженного осадка станут обязательной причиной для проведения полноценных химических тестов. В тех случаях, когда внешне вода кажется чистой, надо все равно анализировать извлеченную из скважины жидкость, потому что часть загрязнений представлены в минимальных невидимых дозах.
Обязательно надо учитывать запах: если чувствуется хотя бы мимолетные пары любого аромата, необходим химический анализ. Чистая вода не пахнет, а запах возникает при попадании в жидкость органических соединений.
Вкус воды во многом зависит от минеральных солей, неорганических и органических соединений. Поэтому если привкус или послевкусие кажутся неприятными или отталкивающе невкусными, то химический анализ надо делать незамедлительно. Однако если вкус приятен, то это вовсе не причина для отказа от тестирования артезианской воды: часть химических соединений невозможно определить на вкус.
Специальные лаборатории используют все возможности современных химических анализаторов, проводя следующие основные исследования:
— фотометрический анализ, позволяющий оценить молекулярный состав жидкости по степени поглощения световых волн;
— титриметрический анализ, с помощью которого можно количественно оценить химические соединения в воде;
— гравиметрический анализ, помогающий оценить весовые показатели вредных веществ.
На основе фотометрии выявляется большинство химических веществ и соединений, находящихся в воде. При необходимости проводятся более сложные тесты (спектрометрия, потенциометрия).
Во время проведения химического анализа воды лаборатория разделяет все виды загрязняющих веществ на органические и неорганические.
1. Органические
Химическая органика является наиболее часто обнаруживаемым загрязнителем в питьевой воде, что объясняется очень просто: многовековая жизнедеятельность человека определяет выраженные изменения в биосфере планеты. К органическим химическим соединениям относятся все вещества, содержащие следующие элементы:
К вредным органическим веществам, которые должны или полностью отсутствовать, или находится в минимальных количествах, относятся все нефтепродукты, формальдегиды, нитриты, фосфорные соли, сероводород, цианиды. Крайне важно выявить количественные и качественные изменения артезианской воды заблаговременно, не дожидаясь появления симптомов отравления у родственников и близких людей.
2. Неорганические
Химическая неорганика представлена большим количеством элементов, составляющим основу менделеевской таблицы. В воде можно обнаружить металлы, минералы, сложные солевые составы, газы, кислоты. Часть из них практически безвредны. Но часть химических веществ категорически недопустимы в дозах, превышающих норму. В лаборатории определяют следующие химические элементы:
— тяжелые металлы (свинец, ртуть);
— солевые соединения кальция и магния;
Некоторые минералы и микроэлементы полезны для человеческого организма, но только в малых дозах. Если предельно допустимая доза (ПДК) превышена в несколько раз, то это становится опасной проблемой. Тяжелых металлов и химических соединений этих элементов не должно быть в артезианской воде, потому что они крайне токсичны и чрезвычайно опасны для человека.
Стандартный химический анализ проводится для всех вариантов питьевой воды (бутилированная, водопроводная), но, кроме основных показателей, необходимо точно знать, что вода из подземных источников и из артезианской скважины не имеет следующих опасных изменений:
— повышенного содержания радиоактивных химических веществ, попадающих в воду из почвы (радионуклиды стронция, радона, радия, свинца и полония);
— наличия в воде удобрений, применяемых в сельском хозяйстве (пестициды);
— нахождения в артезианской воде нефтепродуктов.
Все эти органические и неорганические химические соединения вполне реально могут попадать в подземные воды и скапливаться именно в том участке, где происходит забор питьевой воды. Своевременное и тщательное проведение анализа поможет предотвратить опасное отравление организма и хроническое токсическое влияние на отдельные органы и системы человека.
Длительное употребление внутрь питьевой воды, насыщенной солями тяжелых металлов, приведет к хроническому отравлению с симптомами опасной интоксикации и риском для жизни. Солевые минеральные соединения могут спровоцировать мочекаменную болезнь, а органические вещества станут причиной аллергии у детей. Надо ли экономить на проведении обычной процедуры, считая, что нет никакой необходимости проверять воду, извлекаемую из земных глубин? И впоследствии долго лечиться, пытаясь избавиться из серьезных проблем. Стоит ли рисковать здоровьем своей семьи и своим благополучием? Значительно безопаснее и спокойнее выполнить химический анализ воды подземных вод сразу после бурения артезианской скважины и вовремя узнать о потенциальном риске. Или спокойно использовать воду для питья и повседневных нужд, уверенно глядя в будущее.
источник
Выпускается в 7-ми различных вариантах исполнения — ручное или автоматическое управление, корпус из армированного пластика или нержавейки, есть вариант нержавеющего корпуса с нижним сливом для простоты консервации на зиму. Посмотреть все варианты исполнения фильтров
Анализ воды из скважины, колодца или водопровода сделать в лаборатории Санкт-Петербурге, стоимость экспертизы питьевой воды, где сделать, цена.
Согласно санитарным нормам питьевая вода должна быть безопасна в эпидемиологическом и радиационном отношении, безвредна по химическому составу, и иметь приятные органолептические свойства. Поэтому, целесообразно проверить качество воды из вашего источника — сделать анализ качества воды на соответствие требованиям санитарных норм и правил на питьевую воду. Для выбора системы очистки воды из скважины или колодца важно проверить воду не менее, чем по 15-ти основным показателям.
Требования (нормативы), которым должна соответствовать вода, изложены в санитарных нормах и правилах РФ (СанПиН) и международных нормативах Всемирной организации здравоохранения (ВОЗ), основные положения которых приведены в представленной ниже таблице. И так, рассмотрим основные показатели качества воды.
К органолептическим свойствам воды относят следующие характеристики: запах, привкус, цветность и мутность.
Запах и привкус воды объясняются присутствием в ней естественных или искусственных загрязнений. Природа запахов и привкусов очень различна, и может быть обусловлена как наличием в воде определенных растворенных солей, так и содержанием различных химических и органических соединений.
Кроме того, следует отметить, что запах и привкус может появиться в воде на нескольких этапах: из исходной природной воды, в процессе водоподготовки (в том числе в водонагревателе), при транспортировке по трубопроводам. Правильное определение источника запахов и привкусов — залог успешности их устранения.
Величина (интенсивность) запаха определяется по 6-ти бальной шкале. Например, запах тухлых яиц обусловлен наличием в воде сероводорода (Н2S), а также присутствием сульфатредуцирующих бактерий, вырабатывающих этот газ, а гнилостный запах обусловлен присутствием в воде природных органических соединений. Химические запахи (например, бензиновый, фенольный) указывают на антропогенный характер загрязнений.
Вкус воды обусловлен растворенными в воде природными веществами, каждое из которых придает воде определенный привкус:
- солоноватый — хлоридом натрия;
- горьковатый — сульфатом магния;
- кисловатый — растворенным углекислым газом или растворенными кислотами.
Приятный или неприятный вкус воды обеспечивается как наличием, так и концентрацией находящихся в ней примесей.
Под цветностью понимается естественная окраска природной и питьевой воды. Цветность косвенно характеризует наличие в воде некоторых органических и неорганических растворенных веществ и является одним из важных показателей, позволяющих правильно выбрать систему водоочистки.
Цветность воды определяется сравнением с растворами специально приготовленной шкалы цветности (на основе определенных концентраций хромово-кобальтового раствора) и выражается в градусах цветности этой шкалы. По требованиям к питьевой воде данный показатель не должен превышать 20 градусов.
Главными «виновниками» цветности воды, являются вымываемые из почвы органические вещества (в основном гуминовые и фульвовые кислоты). Повышенная цветность воды также может свидетельствовать о возможной ее техногенной загрязненности. Наличие гуминовых кислот может приводить к определенной биологической активности воды, повышает проницаемость в кишечнике ионов металлов: железа, марганца и др.
Показатель, характеризующий наличие в воде взвешенных веществ неорганического происхождения (например, карбонаты различных металлов, гидроокиси железа), органического происхождения (коллоидное железо и т.п.), минерального происхождения (песка, глины, ила), а также микробиологического происхождения (бактерио-, фито- или зоопланктона). Мутность выражается в мг/дм3.
Мутность также может быть обусловлена наличием на поверхности и внутри взвешенных частиц различных микроорганизмов, которые защищают их как от химического, так и от ультрафиолетового обеззараживания воды. Поэтому снижение мутности в процессе очистки воды способствует также значительному снижению уровня микробиологического загрязнения.
Химические показатели характеризуют химический состав воды. К данным показателям относят водородный показатель воды рН, жесткость и щелочность, минерализацию (сухой остаток), анионный и катионный состав (неорганические вещества), содержание органических веществ.
Показатель, характеризующий интегральную загрязненность воды, т.е. содержание в воде окисляющихся органических и неорганических примесей, которые в определенных условиях способны окисляться сильным химическим окислителем. К упомянутым выше загрязнителям относятся в основном органические вещества — для воды из поверхностных источников, и неорганические ионы (Fe 2+ ,Mn 2+ , и т.п.) — для воды из артезианских скважин.
Различают несколько видов окисляемости воды: перманганатную (ПМО), бихроматную, иодатную. Как видно из названий — при этом для проведения химического анализа воды используются соответствующие окислители. Показатель окисляемости — мгО2/л. Это количество миллиграмм кислорода, эквивалентное количеству реагента (окислителя), пошедшего на окисление веществ, содержащихся в 1 л воды.
Величина бихроматной окисляемости обычно используется для определения такого важного показателя воды как ХПК — химическая потребность в кислороде. ХПК используется для характеристики загрязненных природных поверхностных вод, а также для сточных вод. Этот показатель свидетельствует о степени биогенной загрязненности воды.
Бихроматная окисляемость позволяет получить значение наиболее полно характеризующее присутствие органических загрязнителей, за исключением таких химически инертных веществ как бензин, керосин, бензол, толуол и т.п. Считается, что при определении этого показателя окисляются до 90% органических примесей.
На практике для характеристики питьевой воды обычно используется показатель перманганатная окисляемость (ПМО) или перманганатный индекс (ПМИ). Чем больше значение ПМО, тем выше концентрация загрязнителей. Отметим, что величина перманганатной окисляемости ниже, чем значение, полученное для бихроматной примерно в 3 раза.
Водородный показатель или рН представляет собой логарифм концентрации ионов водорода, взятый с обратным знаком, т.е. pH = -logH + 1. Величина рН определяется количественным соотношением в воде ионов Н + и ОН — , образующихся при диссоциации воды. Если ионы ОН — в воде преобладают, что соответствует значению рН>7, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н + , что соответствует рН + >+ HCO3 —
В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды, токсичность загрязняющих веществ и многие другие ее характеристики.
Обычно уровень рН для воды, используемой в хозяйственных и питьевых целях, нормируется в пределах интервала 6-9.
Эта величина характеризует количество растворенных неорганических и органических веществ. В первую очередь это сказывается на органолептических свойствах воды. Установлено, что до 1000 мг/л вода может быть использована для водопотребления.
Величина сухого остатка влияет на вкусовые качества питьевой воды. Человек может без риска для своего здоровья употреблять воду с сухим остатком до 1000 мг/л. При большем значении вкус воды чаще всего становится неприятным горько-соленым. Следует также отметить, что у воды с низким уровнем сухого остатка вкус может отсутствовать и употреблять ее тоже не очень приятно.
Этот показатель характеризует свойство воды, связанное с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»).
Вода с большим содержанием таких солей называется жёсткой, с малым содержанием — мягкой.
Численное выражение жёсткости воды — это концентрация в ней катионов кальция и магния. По ГОСТ Р 52029-2003 жесткость выражается в градусах жесткости (°Ж), что соответствует концентрации щелочноземельного элемента, численно равной 1/2 его моля, выраженной в мг/дм³ (г/м³) (1 °Ж = 1 мг-экв/л).
Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния (катионов Ca 2+ и Mg 2+ и анионов HCO3—).
При кипячении воды гидрокарбонатные анионы вступают в реакцию с этими катионами и образуют с ними малорастворимые карбонатные соли, которые осаждаются на нагревательных элементах в виде накипи белого цвета, называемой в простонародии известью.
Временную жесткость можно устранить кипячением — отсюда и ее название.
Постоянная (некарбонатная) жесткость воды вызвана присутствием солей, не выпадающих в осадок при кипячении. В основном, это сульфаты и хлориды кальция и магния (CaSO4, CaCl2, MgSO4, MgCl2). Следует отметить, что именно присутствие соли CaSO4, растворимость которой с повышением температуры воды понижается, приводит к образованию плотной накипи.
Вода с высокой жесткостью наносит большой вред бытовым электронагревательным приборам, образуя накипь и тем самым вызывая их перегрев и разрушение, образует неприятные матовые налеты на сантехнике; в ней плохо пенятся мыло и шампуни, а поэтому увеличивается их расход.
Жесткая вода сушит кожу и вредит волосам; отрицательно влияет на качество приготовленной пищи, полезные вещества которой могут образовывать с солями жесткости плохо усваиваемые организмом соединения.
Жесткая вода вредна и для организма человека: увеличивается риск развития мочекаменной болезни, нарушается водно-солевой обмен.
Иногда в качестве характеристики встречается показатель «полная жесткость» воды, равный сумме постоянной и переменной (карбонатной) жесткости.
Его токсичное влияние на организм человека незначительно, но все же употребление питьевой воды с повышенным содержанием железа может привести к отложению его соединений в органах и тканях человека.
В общем случае в воде железо может встречаться в свободной форме в виде двух- и трехвалентных ионов:
Fe 2+ , как правило, в артезианских скважинах при отсутствии растворенного кислорода. Вода с повышенным содержанием такого железа может быть первоначально прозрачна (Fe 2+ ), но при отстаивании или нагреве приобретает желтовато-бурую окраску. Это происходит в результате окисления растворенного железа до Fe 3+ с образованием нерастворимых солей трехвалентного железа:
Fe 3+ — содержится в поверхностных источниках водоснабжения в так называемом окисленном состоянии, и, как правило, в нерастворимом виде.
Существует еще одна форма присутствия железа в природной воде — это органическое железо. Оно встречается в воде в разных формах и в составе различных комплексных соединений трехвалентных ионов железа с растворенными неорганическими и органическими соединениями, и, главным образом, с солями гуминовых кислот — гуматами. Повышенное содержание такого железа наблюдается в болотных водах, и вода имеет бурое или коричневатое окрашивание.
Органические соединения железа, как правило, растворимы или имеют коллоидную структуру (коллоидное железо) и очень трудно поддаются удалению. Коллоидные частицы из-за своего малого размера и высокого поверхностного заряда, который не позволяет частицам сближаться и препятствует их укрупнению, предотвращая образование конгломератов, создают в воде суспензии и не осаждаются, находясь во взвешенном состоянии и, тем самым, обуславливают мутность исходной воды.
На вкус такая вода имеет характерный неприятный металлический привкус, образует ржавые подтеки. Присутствие в воде коллоидного железа способствует развитию железистых бактерий, что еще больше ухудшает вкусовые качества воды и вызывает отложение осадка на внутренней поверхности трубопроводов и санитарно-технического оборудования вплоть до их полного засорения.
Марганец входит в состав многих ферментов, гормонов и витаминов, которые влияют на процессы роста, кровообразование, формирование иммунитета. Однако, повышенное его содержание в воде может оказывать токсический и мутагенный эффект на организм человека.
Вода с повышенным содержанием марганца обладает металлическим привкусом. Его присутствие приводит к значительно более быстрому износу бытовой техники и систем отопления, поскольку он способен накапливаться в виде черного налета на внутренних поверхностях труб с последующим отслаиванием и образованием взвешенного в воде осадка черного цвета. Кроме того, повышенное содержание марганца приводит к образованию черных пятен на посуде, белом белье при стирке, окрашивает ногти и зубы в серовато-черный цвет.
Также существуют «марганцевые» бактерии, которые, как и «железистые» бактерии, могут развиваться в такой воде и становиться причиной зарастания и закупорки трубопроводов.
Показатель, чаще всего характеризующий наличие в воде органических веществ животного или промышленного происхождения. Источниками азота аммонийного являются: животноводческие фермы, хозяйственно бытовые сточные воды, сточные воды с сельскохозяйственных угодий, предприятий пищевой и химической промышленности.
Указанные соединения являются главным образом продуктами распада мочевины и белков. Лимитирующая величина показателя «аммонийный азот» — токсикологическая. По нормам СанПиН содержание в воде аммония не должно превышать 2,0 мг/л.
К микробиологическим показателям безопасности питьевой воды относят общее микробное число, содержание бактерий группы кишечной палочки (общие колиформные бактерии и колифаги), споры сульфитредуцирующих клостридий и цисты лямблий.
В зависимости от характеристик водного источника с целью безопасности воды могут проверяться и такие показатели, как паразитологические и радиологические.
Анализ качества питьевой воды производится исходя из норм показателей по требованиям нормативных документов государств.
В таблице представлены нормативы основных показателей качества по санитарным нормам СанПиН Российской Федерации, указанные в столбце 3 — СанПиН 2.1.4.1074-01 «Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения» и столбце 4 — СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
Именно по этим показателям следует проверить качество воды из вашего источника и оценить необходимость установки дополнительного оборудования для очистки воды.
Для сравнения приведены нормативы Всемирной организации здравоохранения (ВОЗ).
источник
Анализ данных о составе сточных вод, поступающих на городские очистные сооружения, показал, что большой проблемой на сегодняшний день является недостаточная эффективность очистки от органических соединений и тяжелых металлов, в частности меди и цинка. По если органические соединения подвергаются биологическому разложению, то тяжелые металлы могут только перераспределяться в объектах окружающей среды. Поэтому вопросы, связанные с повышением эффективности очистки от ионов тяжелых металлов, в частности меди и цинка, весьма актуальны.[ . ]
Вода в природе нигде не встречается в виде химически чистого вещества. Под физико-химическим составом природных вод принято понимать весь сложный, комплекс растворенных газов, ионов, взвесей и коллоидов минерального и органического происхождения. В природных водах обнаружено около половины химических элементов, входящих в периодическую таблицу Д. И. Менделеева, а многие другие пока не найдены только из-за недостаточной чувствительности методов анализа. Еще большим качественным и количественным многообразием при месей отличаются сточные воды; состав этих примесей всецело зависит от характера производства, в котором они образуются.[ . ]
Анализ состава органических примесей природных вод, сорбированных на поверхности гидроокиси алюминия, позволяет отнести их к группе флокулянтов растительного происхождения. Преимущество флокулянтов природного происхождения заключаются в отсутствии у них токсичных свойств и полной безвредности для организма человека [2]. На это явление указывает также Т. А. Карюхина. Коллоидные гумусовые вещества сорбируются на поверхности А1 ((ЗН) ч, передавая ему свои свойства.[ . ]
Анализ сточных вод производства изопрена по отдельным органическим загрязнителям очень затруднен ввиду присутствия в сточных водах различных соединений, имеющих одинаковые функциональные группы (гидроксильные, метальные, непредельные связи, связанный формальдегид и др.). Поэтому для характеристики состава сточных вод производили обычный санитарно-химический анализ их и некоторые специфические определения, например формальдегида и изопрена.[ . ]
При анализе вод с известным качественным составом проведение указанных операций выделения и разделения органических веществ нецелесообразно; основные компоненты можно определять непосредственно в сточной воде по методикам, описанным в п. 5.3.[ . ]
При анализе природных вод, содержащих смеси органических веществ неизвестного состава, существенно усложняются задачи идентификации. Один из возможных подходов для реализации метода прямого анализа природных вод рассматривается в работах [7—9], используется принцип пиролитической хроматографии. Хроматограммы фрагментов пиролиза отдельных классов и групп соединений имеют общие и специфические пики. Описана возможность идентификации органических соединений в смесях по группам или классам в пирографических участках и расчет концентраций с помощью математической обработки [9].[ . ]
При анализе очень сложных смесей, когда идентификация компонентов только при помощи газовой хроматографии затруднена, все чаще используют комбинацию газовой хроматографии и . масс-спектрометрии — хромато-масс-спектроме-трию. Применение такой комбинации для определения состава органических примесей в природных и сточных водах описано в ряде работ, требующих специального рассмотрения.[ . ]
При водятся методы группового разделения органических веществ для случая неизвестного состава воды; идентификация компонентов выделенных групп производится методами физико-химического анализа; УФ, ИК спектрометрией, газово-жидкостной, тонкослойной хроматографией и др.[ . ]
При анализе состава сточных вод все чаще применяют «многокомпонентные» методы анализа, позволяющие определять сразу большое число веществ, например атомно-эмиссионный и рентгеновский анализ, хроматографию. Предпочтительно использование методов прямого анализа, т. е. не связанного с химической подготовкой пробы, но в случае определения типа загрязнений, такая подготовка часто необходима. Например, предварительное концентрирование исследуемого компонента позволяет определять его в меньших концентрациях, устранять трудности, связанные с негомогенным распределением компонента в пробе и отсутствием образцов сравнения. Специфическую группу методов определения органических соединений составляют методы элементного анализа. Применение газовой хроматографии позволило автоматизировать элементный анализ: для этого выпускают С-, Н-, Ы-анализаторы и другие приборы-автоматы. Анализ органических соединений по функциональным группам (например, ЫН2-группа, ОН-группа и др.) выполняют различными химическими, электрохимическими (амперометрия, полярография), спектральными (инфракрасная спектроскопия) или хроматографическими методами.[ . ]
Общий органический углерод (ТОС) — это та часть растворенного и нерастворенного органического вещества, которая присутствует в воде. Она не дает информации о природе органического вещества. Органический углерод может быть определен до анализа или определен в составе ТОС, а затем получен путем вычитания содержания неорганического углерода из общего содержания углерода.[ . ]
На основе анализа данных о взаимодействии органических веществ в воде, их устойчивости к действию окислителей и адсорбентов может быть рекомендовано небольшое число технологических схем, обеспечивающих очистку воды в широком диапазоне ее состава. Если до последнего времени такие схемы можно было создавать на основании эмпирического подбора, то наличие сведений о природе веществ и механизме протекающих при обработке воды реакций дает возможность обоснованно рекомендовать технологические схемы и реагенты и четко очертить границы их применимости.[ . ]
Трудность анализа состава сточных вод ЦБП определяется как сложностью состава основного объекта технологического процесса древесины, так и многообразием химических операций, проводимых с древесиной, затем с целлюлозой, в результате чего образуются щелока, поступающие в сточные воды. Для делигнифика-ции древесины при получении целлюлозы используют различные химические реагенты: щелочные растворы сульфида натрия или двуокиси серы. Разнообразны способы отбелки целлюлозы: хлорирование, щелочение, обработка гипохлоритом натрия, двуокисью хлора, перекисью водорода, кислородом [1, 2]. Реакции, протекающие в процессе получения целлюлозы из древесины, приводят к образованию и накоплению в сточных водах ЦБП огромного количества веществ, различных по химическому составу, строению, дисперсному состоянию. Сточные воды содержат органические и неорганические, низко- и высокомолекулярные, растворенные, эмульгированные и суспендированные вещества. Положение осложняется тем, что концентрации многих компонентов очень малы, а это накладывает серьезные ограничения на использование ряда аналитических методов для их определения. Сложность состава сточных вод и неустойчивость многих компонентов весьма затрудняют идентификацию веществ. Отметим, что в наиболее изученном сульфатном черном щелоке идентифицировано к настоящему моменту 100 соединений, но это лишь небольшая часть всех веществ, имеющихся в щелоке [3—7]. Сточные воды бумажного производства значительно проще по составу, чем целлюлозного производства, и не определяют специфику аналитического контроля сточных вод ЦБП, поэтому мы не будем их рассматривать [8].[ . ]
Метод прямого анализа водных образцов. При анализе водных растворов с помощью пламенно-ионизационного детектора возможно обнаружение присутствующих органических веществ; в концентрациях до 10-3—10-4%. Прямой анализ получил распространение при контроле сточных вод [1—3] и других систем известного состава, для которых вопросы идентификации и количественного определения могут быть решены путем сравнительного анализа искусственных смесей.[ . ]
Для определения органических примесей в водах и воздушной среде и для сигнализации о выбросах опасных веществ в лабораторных производственных и полевых условиях, в том числе на транспортных средствах в составе передвижных лабораторий. Режимы работы: обзорный анализ — определение наличия и идентификация компонентов на основе использования масс-спектров индивидуальных веществ, хранящихся в компьютеризированной базе данных; анализ на содержание определяемых компонентов; количественный анализ смесей известного состава; выполнение сервисных функций — цифровая фильтрация масс-спектра от шумов, преобразование аналоговою спектра в гистограммный, пополнение базы данных и другие.[ . ]
Вследствие сложности состава производственных и бытовых сточных вод оценка самоочищения водоема в целом представляет собой сложную комплексную задачу. Чаще дают оценку самоочищения водоема по отношению к легко окисляемому органическому веществу (определяемому по ВПК) или по общему содержанию органических веществ (определяемому по ХПК). Оценка самоочищения производится и по данным определения конкретных соединений или их групп (фенолов, углеводородов, смол), а также на основании микробиологических показателей и анализа индикаторных организмов — сапробионтов. О самоочищении водоема в целом [1,9, 10, 23] можно говорить только в том случае, когда имеются данные по всем показателям.[ . ]
Проблема исследования состава природных и сточных вод ввиду ее сложности, особенно в части органического анализа, должна решаться на основе двух основных тенденций развития современной аналитической химии: разделение веществ перед их определением и разделение суммы сигналов, получаемой при исследовании смеси веществ. В настоящем сообщении будут рассмотрены перспективы некоторых спектральных методов анализа: спектрофотометрии, ИК-спектроскопии, ЯМР, рентгено-электрон-ной спектроскопии и ЭПР. Применение масс-спектроскопии, флуо-риметрии настолько разнообразно и широко, что краткое обсуждение их вряд ли целесообразно.[ . ]
В анализируемых сточных водах должны определяться: содержание компонентов, специфичных для данного вида производства (фенолов, нефтепродуктов, поверхностно-активных, ядовитых, радиоактивных, взрывоопасных веществ); общее количество органических веществ, выражаемое БПКшш и ХПК; активная реакция; интенсивность окраски; степень минерализации; наличие биогенных элементов и др. В зависимости от технологии производственных процессов анализ состава сточных вод производится по разовым часовым, среднесменным и среднесуточным пропорциональным пробам; следует также составлять графики колебания концентраций наиболее характерных загрязнений по часам смен, суток, дням недели. Необходимо установить такие параметры, как кинетика оседания или всплывания механических примесей и их объем, возможность коагулирования сточных води др. Эти данные позволяют выбрать наиболее целесообразный и экономически обоснованный метод очистки сточных вод для определенного предприятия.[ . ]
При изучении химического состава вод определяют содержание минеральных, газовых и органических компонентов. Среди минеральных компонентов, как правило, анализируют содержание кальция, магния, натрия, калия, хлор-, сульфат-, карбонат- и бикарбонат-ионов и некоторых микрокомпонентов — стронция, бария, иода, брома, бора, азота, иногда лития и радиоактивных элементов. При этом используют обычные комплексонометриче-ские (трилонометрические) методы, пламенную фотометрию, а также классические титриметрические и гравиметрические методы анализа. Содержание основной массы неорганических веществ в подземных водах измеряется десятками и сотнями граммов, микрокомпонентов — десятками и сотнями миллиграммов на литр исследуемой воды.[ . ]
Наиболее сложным является анализ содержащихся в воде органических веществ, от состава и количества которых во многих случаях зависят санитарно-гигиенические качества воды.[ . ]
В основу хроматографического анализа окрашенных органических веществ, содержащихся в высокоцветных водах, положено различие в адсорбционной активности гумусовых веществ, отличающихся по составу и строению, а также их способность переходить в раствор при определенных значениях pH среды. При подборе деталей установки преследовалась цель обеспечить бесперебойную круглосуточную работу хроматографической колонки, что особенно важно при разделении веществ, близких по составу и свойствам.[ . ]
Из сказанного следует, что при анализе вод, имеющих в своем составе азотсодержащие органические вещества, значение ХПК, полученное при использовании метода с КгБгОв, будет выше (за счет образования нитратов), чем при использовании обычного метода с К2СГ2О7. Для отличия первую величину целесообразно обозначить символом ХПКМ0 -Она отвечает тому химическому поглощению кислорода, которое произошло бы при очистке сточных вод в биохимических сооружениях, если бы процесс доводили до полной нитрификации азотсодержащих веществ.[ . ]
Рассмотрены некоторые возможности анализа состава естественных водных сред методом дистанционной лазерной флуориметрии. Обсуждается определение концентрации нефтепродуктов в воде, определение нефтей на фоне растворенного органического вещества, приводятся конкретные схемы лидаров и лабораторного оборудования для лазерного анализа.[ . ]
Кроме показателей общего содержания органически х веществ, таких, как ХПК, ВПК, нефтепродукты, для оценки состава производственных сточных вод часто возникает необходимость определить концентрацию индивидуальных примесей, если эти примеси отрицательно влияют на процесс очистки. Задача эта очень сложна. Трудности определения индивидуальных веществ обусловлены непостоянством состава стоков, малыми концентрациями компонентов, одновременным присутствием многих разнохарактерных веществ, взаимно влияющих и затрудняющих избирательное определение. Для решения этой сложной задачи широко используются современные физико-химические методы исследования — фотоколоримстрпя, газожидкостная хроматография, осциллополярография, люминесцентный анализ в сочетании с экстракцией, отгонкой и хроматографическим разделением в тонком слое.[ . ]
При общей очистке стоков с переменным составом неэффективно использовать специфические сорбенты, обладающие селективными свойствами. Так, если очистку общих стоков химического предприятия ведут на сугубо микропористом ГАУ, обладающем хорошей емкостью по ароматическим соединениям, то в первый период работы на АУ извлекается 70—80% органических веществ, а при изменении состава сточных вод — лишь 20— 40% загрязнений. Фирмой Са оп Согр. выполнен большой статистический анализ 222 случаев сорбционной очистки на АУ промышленных стоков 68 производств 15 отраслей. Оказалось, что в 5 случаях из 8 содержание общего органического углерода (ООУ) снижалось более чем на 90%, и лишь в двух менее чем на 85%; в 6 случаях из 7 цветность снижалась более чем на 95% и лишь в одном — менее чем на 90%. В целом, в 4/9 проб исходное содержание ООУ было выше 100, но менее 1000 мг/дм3, и в стольких же выше 1000 мг/дм3.[ . ]
При исследовании смесей неизвестного состава задачи идентификации упрощаются применением специфического концентрирования, позволяющего выделять отдельные классы органических соединений. Идентификация отдельных компонентов внутри класса более легко достигается при использовании различных зависимостей, связывающих хроматографические характеристики (время, объемы удерживания) с физико-химическими свойствами веществ внутри ряда (температура кипения, молекулярный вес). Выделение отдельных классов при концентрировании часто связано с первоначальным более или менее селективным накоплением (перегонка, экстракция, вымораживание и т. д.). Поэтому разработка общих схем систематического анализа органических компонентов вод имеет существенное значение для выбора наиболее рационального пути концентрирования, с использованием элементов этих схем при решении отдельных задач [34, 35]. Дополнительные возможности для идентификации дает метод аналитической реакционной хроматографии, который использует химические превращения анализируемых веществ в хроматографической схеме [36, 37].[ . ]
Известно, что при проведении химического анализа природных вод, сформированных в естественных условиях или в условиях наложенного техногена, для установления их состава, правильного соотношения присутствующих в них компонентов, используют результаты анализа, проведенного на месте отбора или в течение первых часов после отбора пробы. Это в первую очередь касается определения неустойчивых компонентов: растворенного кислорода (Оо), гидрокарбонатов (НСО3), нитратов (МО3), аммонийных ионов (МНр, железа (F Таким образом, дикарбоновые кислоты и сточная вода поступают в слабо турбулизирующий газовый поток, где процесс горения еще не закончился и сохраняются худшие условия для перемешивания паров органических веществ с кислородом воздуха. Создаются условия для еще большего затягивания горения и активизации его в конвективном газоходе. Наблюдались случаи, когда факел достигал скрубберов, где, вследствие резкого охлаждения дымовых газов орошающей водой, происходила закалка несгоревшей части органических соединений. При этом температура газов в верхней зоне была ниже, чем перед скрубберами, и, хотя в составе топочных газов СО не обнаруживалась, анализы скрубберной воды и дымовых газов показывали наличие в них органических соединений.[ . ] Инфракрасная спектроскопия более пригодна для анализа неорганических газов и органических компонентов в воде, чем для определения металлов. Так как для значительного числа чисто неорганических твердых веществ известны инфракрасные спектры, то этот метод можно использовать для установления состава осадков, полученных при упаривании воды.[ . ] Для определения чрезвычайно лабильных и разнообразных по составу органических веществ природных вод весьма перспективны систематические схемы анализа, включающие фракционирование сорбционными методами и сочетающие разделение по химической природе с разделением по размерам молекул [25, 26]. Для разделения органических веществ, обладающих сродством к ионным и водородным связям, успешно применяют сорбенты с гидрофильной матрицей (ионообменные целлюлозы и сефадексы). В отличие от ионообменных смол, целлюлозы представляют собой агрегаты полисахаридных цепей, хорошо проницаемых даже для очень больших ионов. Рыхлая структура целлюлозы, высокая дисперсность, сорбция преимущественно по поверхности обусловливают быстроту процессов сорбции и десорбции. Хорошо проницаемы для крупных молекул также нейтральные и ионообменные сефадексы.[ . ] Сконцентрированные в ловушках (патроны и диски) загрязняющие воду примеси токсичных веществ обычно элюируют органическими растворителями (см. разделы 2.3.1 и 2.3.4). При этом выбор растворителя зависит от свойств сорбента, характера и природы матрицы (сточные, природные, питьевые воды и др.), состава и количества загрязнений и цели исследования (арбитражный анализ, экологическая экспертиза, рутинные анализы, определение отдельных наиболее важных приоритетных загрязнений, анализ представительной пробы, скрининг целевой и нецелевой и т.п.).[ . ] Как в первой серии опытов (с добавкой 20% хозяйственнофекальных сточных вод), так и в данных был составлен общий баланс процесса. Анализ данных баланса показал, что в течение 28 суток через аэротенк прошло 377 л стоков с содержанием кислорода 19 г по фильтрованной пробе и 24,5 г по нефильтрованной. Таким образом, при средней нагрузке 271 г/м3 — сутки по фильтрованной и 350 г/м3- сутки по нефильтрованной пробе эффект очистки по БПК5 составил 96,2—94,8%; при этом разрушение органических веществ составило 260— 331 г/м3-сутки 02.[ . ] В заключение можно сказать, что решение задачи определения индивидуальных органических соединений по существу сводится к разработке некоторого общего метода систематического анализа природных вод для определения органических компонентов [27]. Этот метод может иметь несколько вариантов, применяемых в зависимости от состава анализируемой воды и от допустимых потерь тех или иных веществ. При изучении состава органических веществ параллельно с компонентным анализом необходимо иметь данные о содержании неорганических микро- и макрокомпонентов и органического углерода, о цветности воды, что позволит дать оценку методам выделения и определения отдельных групп органических соединений [28].[ . ] Применявшийся раньше метод перманганатного окисления совершенно не пригоден для анализа сточных вод (в анализе природных вод его еще используют). Перманганат — недостаточно сильный бйбслитель: окисление органических веществ проходит неполно и многие из них совсем не окисляются. Кроме того, при кипячении растворов, содержащих избыток перманганата, последний в значительной мере разлагается с образованием диоксида марганца и кислорода. Это разложение происходит как в кислой, так и в щелочной среде. Выпадающий диоксид марганца каталитически ускоряет процесс. Количество образующегося осадка различно в зависимости от условий и состава пробы. Поправка на холостой опыт здесь невозможна, так как при проведении холостого определения осадок диоксида марганца обычно совсем не выпадает.[ . ] К сожалению, на данный момент можно констатировать малую доступность СО природных вод для аналитиков-практиков, особенно в России из-за отсутствия отечественных образцов. К тому же образцы природных вод нередко различаются по минеральному составу ввиду сезонной и временной динамики, а также в зависимости от места отбора пробы [128]. Другими словами, даже сертифицированный СО природной воды не всегда идентичен по минеральному и органическому составу анализируемой пробе. По этой причине в аналитических лабораториях широко применяют унифицированные методы анализа, основанные на применении более простых СО, например, водные растворы солей. Однако упрощение калибровки не упрощает, а скорее усложняет саму процедуру создания методики анализа. На этой стадии необходимо выявить все возможные влияния макро- и матричных компонентов, а также найти способ их устранения или учета, например, путем разделения микро- и макроэлементов с применением экстракции, сорбции и других методов или путем введения макрокомпонентов в образцы сравнения на уровне, соответствующем его содержанию в пробе.[ . ] Содержание азотсодержащих соединений нитратов, аммонийного азота) в исследованных водах за период наблюдении определялось в концентрации, в несколько раз ниже предельно допустимой (ПДК — 45 мг/л) для питьевой воды. Анализ динамики изменения содержания азотсодержащих соединений в воде, обработанной прибором с активной водой, и в контрольной (после контакта с «плацебо») воде показал, что в течение срока наблюдений среднее отклонение опытных данных от контрольных составляло для нитратов — 1,46 мг/л, а для аммонийного азота — 0,035 мг/л, т.е. понижение концентрации нитратов и повышение количества аммонийного азота относительно их среднего содержания в воде является существенным и равно 27 и 22,4% соответственно (относительно контрольных величин). Отклонение от средних контрольных значений для показателей ВПК, органического углерода, перманганатной окисляемости составило 30,3%, 13,1% и 7% соответственно.[ . ] Бихромат калия наиболее полно окисляет вещества, содержащиеся в промышленных сточных водах, особенно при использовании серебра в качестве катализатора. В результате анализа определяется суммарное количество кислорода, которое затрачивается на окисление углеродсо ержащих веществ до двуокиси углерода, серусодержащих — до сульфатов, фосфорсодержащих — до фосфатов. Кислород, который содержится в составе некоторых органических соединений, в величину ХПК не входит.[ . ] Таким образом, расчет сооружений для биохимической очистки должен производиться с учетом состава производственных сточных вод при определении всей суммы органических загрязнений, выражаемой полной • биохимической потребностью в кислороде. Для этого необходимо знать величину БПКполн, а также ХПК производственных сточных вод, которая определяется по данным анализов.[ . ] Промывка должна быть интенсивной и равномерной, осуществляться быстро и с минимальной затратой воды. После нее в песке не должно оставаться скоплений комочков грязи, плохо промытых участков, а при анализе песка не должно обнаруживаться изменения химического состава в результате обволакивания его неотмытыми органическими и минеральными отложениями. Качество промывки зависит от интенсивности и равномерности распределения промывной воды, времени промывки и условий отвода воды.[ . ] Последние публикации подтверждают возможность получения качественно новой геологической информации, особенно на основе данных о молекулярном составе органических веществ подземных вод. Важнейшими направлениями в области анализа органических веществ вод являются инструментализация и автоматизация методов. К одной из таких задач относится создание и внедрение в практику специальных анализаторов для определения органического углерода, азота, а также анализаторов для селективного определения отдельных компонентов или групп веществ. Серьезных успехов следует ожидать от внедрения различных видов хроматографии, особенно инструментальной (газовой и жидкостной хроматографии), а в дальнейшем — хроматомасс-спектрометрии для определения молекулярного состава органических соединений.[ . ] Опубликованы данные по убыли кислорода и снижению ХПК первичного стока четырех очистных сооружений Калифорнии. К сожалению, ничего не сообщается о составе стоков. Было найдено, что выход убыли кислорода составляет 2,8 молекул/100 эв, даже при введении катализирующих добавок, таких, как Т 03 , Ре2+ + Н202 и Н202. Снижение ХПК измерялось при различных режимах проведения облучения: в отсутствие кислорода (насыщение азотом), при предварительном насыщении воздухом или кислородом и при барботаже воздуха во время облучения. В последнем случае С(—02), рассчитанный по изменению ХПК, равняется 10 эке/100 эв. Анализы по общему углероду показали, что около половины органических соединений разлагается до С02 и воды. Цепные процессы окисления обнаружены не были.[ . ] По сравнению с первым изданием (1958 г.) книга значительно переработана и расширена. Наибольшее число дополнений внесено в раздел, посвященный методам определения органических веществ в промышленных сточных водах (раздел увеличен примерно в три раза), но, конечно, и это далеко не может удовлетворить острой потребности в таких методах анализа. Определение малых количеств органических веществ, присутствующих в сложных комбинациях, в сложных по составу смесях, какими являются производственные сточные воды — задача, пока еще далеко не решенная, и для анализа сточных вод многих производств мы еще не располагаем надежными методами.[ . ] Среди выявленных представителей семейства преобладают литораль-но-эпифитные водоросли (16 таксонов), обитающие в прибрежной зоне. По отношению к содержанию солей в воде основная часть состава семейства Fragilariaceae в данных водотоках приходится на индифферентные диатомеи (24 вида с разновидностями). Основной экологической группой по отношению к pH являются алкалифильные диатомовые (26 таксонов). Сапробиологический анализ показал преобладание диатомовых водорослей (13), характерных для вод с умеренным загрязнением легкоокисляе-мыми органическими веществами. Соотношение экологических групп со-ответствуетхимическому составу вод исследованных водотоков. Среди био-географических групп первое место занимают космополиты (27 видов с внутривидовыми таксонами). Выявлены редкие виды.[ . ] Следует отметить, что ранее с использованием фотометрических методов было получено большое количество аномально высоких и, как правило, некорректных результатов по содержанию ртути в незагрязненных природных водах [168]. Следовательно, необходимо очень осторожно применять эти методы для анализа ртути, а также интерпретировать данные по ее содержанию, полученные с их использованием. Обзоры фотометрических и экстракционно-фотометрических методов определения ртути приведены в [45, 134, 140, 153, 456]. В обзоре [153], рассматривающем развитие фотометрических методов за 20 лет (1971—1991 гг.), в табличном виде приведены характеристики используемых органических реагентов, их аналитические свойства, сведения по селективности методов, мешающие компоненты. В зависимости от характеристик и состава анализируемых объектов можно выбрать наиболее подходящий метод анализа. Авторы обзора делают вывод, что большинство разработанных фотометрических методик определения ртути недостаточно избирательны вследствие неспецифичности функционально-аналитических групп применяемых реагентов и проведения комплексообразования в щелочной среде. Поэтому для фотометрического определения ртути перспективны направленный синтез органических реагентов, образующих устойчивые комплексы с ртутью в сильнокислых средах, и разработка высокочувствительных методов на их основе [153].[ . ] Геохимическое опробование снежного покрова проводилось в течение нескольких лет (1992—1995 гг.) на территории нескольких промышленных городов области (Новый Уренгой, Сургут, Тюмень), в поселках, возникновение которых связано со строительством компрессорных станций (КС) на магистральных трубопроводах. Для сопоставления проводилось исследование состава снежного покрова в ненарушенных, т.е. фоновых условиях. Исследованиями были охвачены различные природные зоны — от типичных тундр (п-ов Ямал) до границы таежной и лесостепной зон (г. Тюмень, КС “Богандинская“). Отбор проб и подготовка к анализу проводились по методике мониторинга снежного покрова [Василенко и др., 1985]. В талой снеговой воде определялись: основные гидрохимические показатели, содержание тяжелых металлов методом атомно-адсорбционной спектрофотоме-трии, содержание ряда органических соединений, используемых в технологических процессах на КС (метанол, этиленгликоль, фенол), а также ароматические углеводороды (бензол, этилбензол, толуол и др.). Математическая обработка полученных результатов включала вычисление стандартных статистических параметров, корреляционный и факторный анализы. По материалам опробования строились картосхемы (методом изолиний), отражающие пространственное распределение загрязнителей по территории исследуемых городов и КС. При оценке уровня экологической опасности загрязнения использовались предельно допустимые концентрации для природных водоемов.[ . ] В основном в пробах были отмечены планктонные и факультативно-планктонные формы водорослей, однако достаточно большую долю диатомовых составляют обрастатели, бентосные и эпифитные формы. В экологогеографическом отношении водоросли планктона прудов были представлены широко распространенными видами, обитающими в пресных водоемах и предпочитающими нейтральные или щелочные воды. Виды-космополиты преобладали в списке водорослей и составляли в зависимости от типа водоема 42-75 % от общего числа. По шкале сапробности число водорослей-индикаторов органического загрязнения составило в среднем 35-43 % от общего количества видов по водоему. Среди них значительное положение занимали (3-мезосапробы (20-34 % от общего количества видов в водоеме) и олиго-[3-мезосапробы (9-15 % от общего количества видов в водоеме). На основании анализа видовой структуры и летней биомассы фитопланктона, которая часто превышала пределы 4-8 мг/л (г/м3), было определено, что исследуемые водоемы являются эвгрофными. В периоды «цветения» воды трофический статус водоемов достигал гиперэвтрофного уровня.[ . ] Водохранилища — искусственно созданные водоемы различных размеров — приобретают в настоящее время большое народнохозяйственное значение, позволяя решать важные проблемы энергетики, промышленности, транспорта, сельского хозяйства. Заселение водохранилищ ценными породами рыб (рис. Формирующийся в конкретных условиях данного водохранилища химический состав воды определяет пригодность ее использования для намеченных целей, а также условия жизни рыб, противокоррозионную устойчивость гидротехнических сооружений и многое другое. Игнорирование этого вопроса может привести к тяжелым, трудно исправимым последствиям. Процесс формирования химического состава воды в водохранилищах протекает особенно интенсивно в первоначальный период их существования. В результате затопления новых площадей суши, представляющей леса, луга, пашни, болота, происходит смыв в водохранилища большого количества растворимых органических и минеральных веществ, отмирание и разложение растительности, формирование новых грунтов дна водохранилища при интенсивном взаимодействии растворенных в воде ионов и газов с почвами. Этот период первичного формирования химического состава воды для различных водохраниг лищ протекает в различные промежутки времени (порядка нескольких лет), а затем в водохранилищах устанавливается свойственный им режим, близкий к озерному, Переход от речного режима к озерному сопровождается изменением гидрологических и биологических условий: повышается температура воды, усиливается испарение, увеличивается прозрачность, более интенсивно развиваются планктон и водная растительность. Все это может привести к существенным изменениям гидрохимического режима. Точный анализ возможных изменений представляет значительные трудности, и прогнозы гидрохимических особенностей создаваемых водохранилищ могут быть даны лишь в предварительной общей форме, на основе учета рассмотренного выше влияния физико-географических условий и водного режима на гидрохимический режим водоемов.[ . ] источник