Миеломная болезнь (плазмоцитома) — заболевание, относящееся к парапротеинемическим гемобластозам, специфическим маркером которых, в большинстве случаев, являются иммуноглобулины (парапротеины) сыворотки крови.
Иммунохимические варианты миеломы определяются по классу иммуноглобулинов и типу легких цепей (λ или κ):
1. иммуноглобулин G — миелома встречается в 55-65 %,
3. иммуноглобулин D — миелома — в 2-5%,
5. болезнь легких цепей (миелома Бенс-Джонса) — в 12 -20%.
Общий анализ крови — у большинства больных анемия нормохромного и нормоцитарного типа. Железодефицитная анемия может развиться при кровотечениях, нарушениях гемостаза и по другим причинам. При дефиците витамина В12 и фолиевой кислоты в костном мозге выявляются признаки мегалобластного кроветворения (В12-дефицитной анемии, фолиеводефицитной анемии). Количество ретикулоцитов понижено. СОЭ увеличена.
У больных миеломной болезнью отмечается лейкопения, реже лейкоцитоз (повышенное количества лейкоцитов в крови). В лейкоцитарной формуле нейтропения, моноцитоз. Плазматические клетки обычно выявляются в небольшом количестве (лучше в лейкоконцентратах). Содержание тромбоцитов снижено.
В анализе мочи при миеломной болезни находят протеинурию, цилиндрурию, белок Бенс-Джонса (свыше 12 г/сут). Поражение почек наблюдается при миеломной болезни у большинства больных. С учетом этого обстоятельства проводятся пробы Зимницкого и Реберга-Тареева.
Биохимический анализ крови — в сыворотке отмечается увеличение общего белка до 90 — 100 г/л и выше (повышение уровня гамма-глобулинов), количество альбумина снижено. При миеломной болезни возрастает уровень кальция, мочевой кислоты. У большинства больных отмечается повышение уровня креатинина и азота мочевины, снижение содержания электролитов. Значительное повышение активности альфа-нафтилацетатэстеразы выявляется в плазматических клетках.
Определение бета-2-микроглобулина используется для наблюдения за динамикой заболевания и эффективностью лечения.
При миеломной болезни проводят электрофорез белков сыворотки крови в полиакриламидном геле. Анализ выявляет М-компонент , чаще всего за счет иммуноглобулинов G и М (иммунохимические варианты миеломы). При миеломе Бенс-Джонса М-компонент в крови обычно отсутствует и выявляется на электрофореграмме белков мочи.
В анализе костного мозга находят большое количество плазматических клеток, которые выявляются у 86 — 95 % больных.
- функция почек ослаблена в менее 50% случаев, обычно это потеря почечной концентрационной способности и азотемия
- протеинурия встречается часто из-за наличия микроальбумина и глобулинов в моче
- протеинурия Бенс-Джонса может быть интермиттирующей
- белок Бенс-Джонса наблюдается в 50% случаев миеломы, но почти всегда формируется почечная недостаточность вследствие миеломы почки
- выраженная анемия непропорциональна азотемии
- непостоянные изменения вследствие поврежденной функции канальцев:
— снижение уровня мочевой кислоты в сыворотке
— потеря с мочой фосфатов со снижением сывороточного фосфора и увеличением уровня щелочной фосфатазы
— нефрогенный несахарный диабет
— олигурия или анурия с острой почечной недостаточностью из-за дегидратации.
- гиперхлоремия (повышение уровня хлора) или гипербикарбонатемия с нормой или снижением натрия в сыворотке снижает ионную проницаемость, и следует предположить миелому при конкретных клинических симптомах
- изменения вследствие ассоциированной гиперкальциемии
источник
Миеломная болезнь (множественная миелома) составляет около 1% всех злокачественных образований, частота встречаемости миеломной болезни колеблется в разных этнических группах от 1 до 10 на 100000 населения. Заболевание диагностируется в возрасте 40-70 лет в два раза чаще у женщин. В клинической картине характерны: остеодеструкция плоских костей, миеломная нефропатия, реже гепатоспленомегалия, поражение лимфатических узлов, бактериальные и вирусные инфекции, геморрагический синдром.
Существует несколько типов множественной миеломы: несекретирующая, дремлющая, индолентная миелома, плазмоклеточный лейкоз. Миеломная болезнь характеризуется присутствием в сыворотке крови и/или в моче моноклональных иммуноглобулинов (парапротеинов). Парапротеины часто не способны выполнить функцию антител! Молекула парапротеинов состоит из тяжелых или легких цепей одного типа, иногда они состоят только из отдельных легких цепей (каппа и лямбда) или только из тяжелых цепей (фрагментов иммуноглобулинов). Класс и тип цепей не меняется в течение болезни. Необходимо проведение электрофореза белков сыворотки крови, и иммуноглобулинов А, М, G в сыворотке крови. Так как все молекулы парапротеинов идентичны, то они определяются при электрофорезе белков по наличию узкого M- пика (М-градиента).
Для постановки диагноза врачом, как правило, назначаются три вида исследований:
Электрофорез белков (белковые фракции)
Иммуноглубулины (целая молекула):
Свободные легкие цепи лямбда и каппа:
— Лямбда и каппа легкие цепи в сыворотке крови;
— Лямбда и каппа легкие цепи в моче.
При несекреторной миеломе диагноз можно поставить только на основании исследования костного мозга (миелограмме).
боли в суставах у женщин старше 50 лет, потеря веса, повышенное содержание кальция в сыворотке крови, увеличение общего белка и снижение альбумина, увеличение мочевины и креатинина, в общем анализе крови: появление плазматических клеток в периферической крови тромбоцитопения, анемия, лейкопения, увеличение СОЭ.
При множественной миеломе; при системных заболеваниях иммунной системы: макроглобулинемия Вальденстрема, остромплазмобластном лейкозе, болезни тяжелых цепей, лимфоме с парапротеинемией.
- количественное определение лямбда и каппа легких цепей в сыворотке крови с помощью иммунотурбидиметрического метода на биохимическом анализаторе «АRCHITECT c8000»
- количественное определение лямбда и каппа легких цепей в моче с помощью турбидиметрического метода на биохимическом анализаторе «SAPPHIRE-400»
- белковые фракции с помощью электрофореза (выдача результата с распечаткой электрофореграммы с указанием результов в абсолютных и относительнах единицах) на автоматическом аппликаторе «SAS 1 plus» и автоматическом окрашивателе «SAS 2»
Необходимо воздержкться от физических нагрузок, приема алкоголя и лекарств, изменений в питании в течение 24 часов до взятия крови. Рекомендуется сдавать кровь на исследование утром, натощак (8-ми часовое голодание). В это время необходимо воздержаться от курения.
Желательно, утренний прием лекарственных средств провести после взятия крови (если это возможно).
Не следует перед сдачей крови осуществлять следующие процедуры: инъекции, пункции, общий массаж тела, эндоскопию, биопсию, ЭКГ, рентгеновское обследование, особенно с введением контрастного вещества, диализ.
Если все же была незначительная физическая нагрузка – нужно отдохнуть не менее 15 минут перед сдачей крови.
Очень важно, чтобы точно соблюдались указанные рекомендации, так как только в этом случае будут получены достоверные результаты исследования крови.
Находилась в отделении хирургии в январе 2019года по полипэктомии.
Хочу искренне поблагодарить доктора Зиновского Михаила Вячеславовича за высокий профессионализм , внимательное отношение к пациентам, прекрасное чувство юмора, умение оказать больному психологическую поддержку. Ваши профессиональные и человеческие качества вселяют надежду на выздоровление. Спасибо.
24.12.2018-27.12.2018 находился на лечении в 1м хирургическом отделении. Проведено лечение и лапароскопическая операция в брюшной области. Хочу высказать слова благодарности и признательности замечательному врачу, который проводил операцию — Иванову Юрию Викторовичу. Операция была не простая, но выполнена великолепно, о чем я сужу по отсутствию побочных явлений и плановой реабилитации. И сегодня, спустя 7 дней посл.
Хочется выразить огромную благодарность доктору Ищенко Роману Викторовичу. Спасибо за то, что дали шанс моей маме жить. Спасибо за внимательность, заботу и высокий профессионализм. Дай Вам Бог здоровья, успехов и всего самого хорошего за Ваш труд.
Очень грамотный специалист. Помог, огромное спасибо!
Хочу выразить огромную благодарность за чуткое и профессиональное отношение: кардиохирургу Терещенко Василию Ивановичу, зав. отделению Зотову Александру Сергеевичу, процедурной медсестре Толок Юлии Александровне, Сливке Дарье Ивановне, медсёстрам: Гребенниковой Оксане Сергеевне, Чуракаевой Ольге Витальевне, Карауловой Елене Александровне, Добродей Юлии Владимировне, Тарасовой Екатерине Петровне и младшему персоналу: Шушанфу Светлане Але.
Хочу выразить огромную благодарность врачу с большой буквы Хабарову Юрию Алексеевичу. Сделал операцию моему мужу и спас ему этим жизнь. Дай бог здоровья и долгих лет жизни доброму и отзывчивому человеку .
Спасибо огромное прекрасным врачам Калинкину Александру Александровичу и Винокурову Алексею Георгиевичу за их золотые руки, светлые головы и добрые сердца! Низкий поклон! Храни вас Бог!
Хочется выразить огромную благодарность доктору Ищенко Роману Викторовичу. Спасибо Вам за то, что дали маме шанс жить, спасибо за внимательность, заботу и высокий профессионализм. А так же хочется сказать слова благодарности всем медсестрам и другим докторам, которые помогали маме, поддерживали её и были рядом. Дай Вам Бог всего самого наилучшего, дорогие доктора. Спасибо за Ваш труд. Анна.
хочу выразить огромную благодарность врачу-хирургу Большакову Д.В. за профессионально проведенную операцию по удалению грыжи, за внимание и заботу после операции. Спасибо Вам, Дмитрий Владимирович за ваши золотые руки и чуткое сердце.
Будьте здоровы и хранимы судьбой!
Хочу выразить Огромную Благодарность доктору Лебенковой Ольге Алексеевне и ее медсестре! Спасибо Вам за доброту, отзывчевость, а главное за профессионализм! Отдельное пожелание Ольге Алексеевне, крепкого здоровья, долгих лет жизни и семейного счастья в Новом Году.
источник
Миеломная болезнь (множественная миелома) — это злокачественное иммунопролиферативное заболевание системы крови, выражающееся в образовании опухоли из лимфоцитов, продуцирующих антитела. Преимущественно процесс затрагивает костный мозг. Страдают от него чаще всего люди после 40 лет, особенно пожилые мужчины. Ежегодно болезнь диагностируется у 0,003−0,005% населения.
Что инициирует развитие болезни, точно неизвестно. Есть лишь данные, что её частоту увеличивает ионизирующая радиация.
Патологический процесс начинается с опухолевой трансформации полипотентной стволовой клетки. При этом наблюдаются множественные хромосомные нарушения. Однако болезнь никак не проявляет себя на протяжении 20—30 лет (поэтому случаи её диагностики в возрасте до 40 лет редки).
За это время получившая новые свойства клетка прорастает в костную ткань и почки, в организме появляется многоочаговая опухоль. Она локализуется в основном в позвоночнике и плоских костях черепа, рёбер и таза, инициирует остеолизис и остеопороз. Кальций из разрушенных костей попадает в кровь и оседает в виде плотных образований в выделительных органах — почках, лёгких, слизистой желудка.
Миеломная болезнь проходит несколько стадий развития, за время которых опухоль набирает массу. Идентифицировать их можно следующим образом:
- I стадия (малая масса). Концентрация гемоглобина в эритроцитах превышает 100 г/л. Патологического парапротеина класса lgG содержится менее 5% или иммуноглобулина класса lgA менее 3%. Концентрация микроглобулина бета-2 менее 3,5 мг/л, а альбумина 3,5 г/дл или более. Уровень ионов кальция нормальный. Отсутствуют клинические и рентгенологические изменения костей либо есть одиночная плазмоцитома или остеопороз. Больной может жить на этой стадии долгие годы без лечения.
- II стадия (средняя масса). Гемоглобин снижается до 85—100 г/л. Парапротеин lgG или lgA возрастает до 5—7 или 3—5%, соответственно. Микроглобулина бета-2 становится 3,58−5,5 мг/л. Уровень кальция незначительно повышается. Наблюдаются начальные рентгенологические изменения костей.
- III стадия (большая масса). Гемоглобин падает ниже 85 г/л. До 7 и 5%, соответственно, повышаются lgG и lgA. Микроглобулина бета-2 не менее 5,5 мг/л. Уровень кальция выше 2,75 ммоль/л. Выражено три или более клинических проявления поражения костей, остеолизис. Продолжительность жизни на этой стадии не превышает 2—3 лет.
Из-за размножения плазматических клеток и выработки моноклональных антител появляются симптомы миеломной болезни. Клиническая картина выглядит следующим образом:
- Поражение костей. Сильнее всего патология затрагивает плоские кости и позвоночник. Они начинают болеть, могут случаться переломы. Дополнительно разрушается костная ткань. В самом тяжёлом случае может возникнуть экстренная ситуация — сдавливание спинного мозга, диагностируемое при помощи миелографии или МРТ.
- Амилоидоз почек. Из-за миеломы в канальцах повышается концентрация белковых субъединиц иммуноглобулинов, а внутри клубочков, то есть скопления капилляров, по которым проходит кровь, они откладываются в виде зернистых депозитов.
- Анемия. У более чем половины всех больных миеломой крови диагностируется пониженная концентрация гемоглобина, а также других форменных элементов крови.
- Предрасположенность к инфекционным заболеваниям. Подавляющее большинство больных становится очень восприимчивыми к бактериальным инфекциям, поскольку у них нарушено образование и снижено содержание нормальных антител, нейтрофилы дефектны, и их хемотаксис и миграция нарушены. Несмотря на то что клеточный иммунитет при этом обычно не снижается, смерть при миеломной болезни крови часто случается по причине инфекционных осложнений.
- Нарушение свёртываемости крови. Миелома проявляет себя увеличением времени кровотечения, однако они случаются у больных довольно редко.
- Болезнь Рейно. Присутствие аномальных белков криоглобулинов может привести к поражению мелких концевых артерий и артериол, из-за которых верхние фаланги пальцев приобретают цианотичную окраску.
Клиническая картина миеломной болезни достаточно выраженная, однако окончательно подтвердить наличие злокачественной опухоли из лимфоцитов можно только по результатам анализов. Для диагностики используются следующие исследования:
- Общий анализ крови. На болезнь указывает пониженное содержание гемоглобина и лейкоцитов с одновременным возрастанием количества тромбоцитов и увеличением скорости оседания эритроцитов.
- Биохимический анализ крови. При миеломе диагностируется увеличение содержания общего белка за счёт специфических иммуноглобулинов, повышение уровня кальция, креатинина, мочевины, лактадегидрогеназы, микроглобулина бета-2.
- Иммунохимическое исследование крови и мочи. При заболевании обнаруживаются патологические белки класса lgG, реже lgA, lgD или lgE.
- Общий анализ мочи. На миеломную болезнь указывает сывороточный парапротеин — белок Бенс-Джонса, продуцируемый плазматическими клетками.
- Пункция костного мозга. Если в биологическом материале костного мозга содержится более 10% плазматических клеток или они в каком-либо количестве присутствуют в других тканях, диагностируется миелома. Клетки при этом характеризуются округлым или овальным эксцентрично расположенным ядром, хроматин внутри которого имеет колесовидный рисунок, широкой интенсивной синей с чёткими границами цитоплазмой с вакуолями или без них.
- Рентгенологическое исследование костей. Для болезни характерно появление зон разрушенной костной ткани, очаги поражения черепа в виде гладкостенных пробоин, компрессионные переломы позвоночника.
- МРТ или КТ. Этими методами осуществляется дифференциальная диагностика для исключения заболеваний костей и определяется распространение болезни.
Если при исследованиях парапротеина и плазматических клеток менее 30 г/л и 10%, значит заболевание характеризуется как моноклональная гаммапатия неопределённого значения.
Сходные миеломе признаки имеют другие злокачественные опухоли: остеомиелит и лимфоплазмоцитарная лимфома. Исключить их помогают дополнительные исследования.
Костные метастазы могут возникать при злокачественной гемангиоме, заболевании лимфоидной ткани, раке симпатической нервной системы или молочной железы. От миеломы эти заболевания отличает наличие первичного опухолевого очага, а морфологию подтверждает гистологическое исследование.
Отличительной чертой лимфоплазмоцитарной лимфомы, вызывающей увеличение лимфатических узлов и селезёнки, поражение костного мозга и лёгких, является продуцирование моноклонального протеина и больших полипептидных субъединиц антител.
Если уровень кальция опасно повышен, амилоидоз привёл к почечной недостаточности, костно-мозговое кроветворение угнетено, кости болят и имеют множественные поражения и патологические переломы, есть опасения, что на спинной мозг оказывается давление. В этом случае необходима химиотерапия. Она может осуществляться в нескольких режимах:
- В самом простом варианте назначается монохимиотерапия с чередованием курсов цитостатиков. Из препаратов применяются Мелфалан и Циклофосфамид. Первый принимается в низких дозах (0,5 мг/кг) перорально в течение 4 дней с перерывом на 4—6 недель и чередуется с регулярными внутривенными вливаниями 16—20 мг/м2 через каждые 2 недели. Циклофосфамид вводится внутримышечно по 150—200 мг в сутки.
- Для больных с худшим прогнозом проводят полихимиотерапию. Для этого используются не только Мелфалан и Циклофосфамид, но и Преднизолон, Винкристин, Доксорубицин или Дексаметазон. Однако существует мнение, что, несмотря на большую интенсивность, такая программа не увеличивает ни количество и продолжительность ремиссий, ни выживаемость.
- Во время ремиссии после химиотерапии могут применяться препараты альфа-интерферона. При их внутримышечном введении в дозе 3—6 млн единиц трижды в неделю, период улучшения продлевается. Интерферон эффективен как в сочетании с другими препаратами, так и сам по себе.
- В случаях, когда болеют люди в возрасте менее 65 лет, в основном применяется высокодозная химиотерапия Мелфаланом с последующей трансплантацией донорского или собственного костного мозга. Это позволяет с высокой степенью эффективности увеличить безрецидивную и общую выживаемость.
Потенциальное излечение может произойти только в случае успешной донорской трансплантации костного мозга. Однако этот метод ограничивается возрастом пациента и высокой вероятностью смертности (5—10%) от токсического действия самого лечения. Поэтому обычно доступным остаётся только контроль течения болезни и обеспечение продолжительной ремиссии.
Если очаг разрастания плазматических клеток один, можно провести хирургическое лечение. Также оно, как дополнение к химиотерапии, показано при признаках сдавливания жизненно важных органов, особенно спинного мозга. Хирургическое лечение в таком случае заключается в удалении патологических образований или даже части позвоночной кости. Дополнительно назначаются глюкокортикоиды и проведение лучевой терапии.
Последняя улучшает качество жизни ослабленных больных и обычно назначается в сочетании с другими методами. Её проведение обязательно при почечной недостаточности и резистентности к химиотерапии. Как основное лечение, лучевая терапия используется при локальных костных поражениях.
Дополнительно должно осуществляться симптоматическое лечение, заключающееся во введении жидкостей и коррекции гиперкальциемии, а также приёме анальгетиков, гемостатической терапии и ортопедической помощи. В качестве препаратов, останавливающих разрушение костной ткани и предотвращающих переломы, обычно применяют Памидронат, Золедроновую кислоту или другие бисфосфонаты. В некоторых случаях анемии требуется назначение эритропоэтина и переливание эритроцитарной массы.
Миелому не следует путать с острым миелоидным лейкозом (ОМЛ) и заболеваниями, связанными с разрушением миелиновой оболочки нервных волокон. При ОМЛ подавляется рост нормальных клеток крови за счёт размножения изменённых лейкоцитов. И хотя его также в основном лечат при помощи химиотерапии, проявления и диагностика ОМЛ и миеломной болезни сильно отличаются друг от друга.
Демиелинизирующие заболевания приводят к ухудшению проводимости сигналов в пострадавших нервах. В результате возникает рассеянный склероз, синдром Гийена-Барре и прочие нарушения. Диагностируется разрушение миелиновой оболочки нейронов при помощи МРТ и электромиографии. Лечение зависит от того, какие нарушения возникли в результате демиелинизации.
источник
Миеломная болезнь (миелома, плазмоцитома, миеломатоз и болезнь Рустицкого-Калера) – это тяжёлое заболевание кроветворной системы, которое чаще всего определяется на поздних стадиях протекания и вследствие этого имеет неутешительные прогнозы. Своевременно начатое лечение позволяет продлить жизнь пациента и достигнуть относительно длительной ремиссии. Поэтому ранняя диагностика миеломной болезни – важный вопрос для всех людей, находящихся в группе риска.
Миеломатоз – самое распространённое заболевание в группе раковых опухолей плазматических клеток крови. Частота встречаемости миеломной болезни составляет до 1 % всех случаев онкологии и около 10 % случаев рака крови. Ежегодно среди 1 миллиона населения мира обнаруживается 30 новых случаев миеломы.
При данном виде онкологии происходит мутация одного из видов клеток крови – плазмоцитов. Плазмоциты или плазматические клетки – это конечная форма В-лимфоцитов. Их функция состоит в распознавании чужеродных агентов и выработке специфичных к ним антител (иммуноглобулинов).
При мутации происходит патологическое размножение (пролиферация) одного из клонов плазматических клеток. Изменённые плазмоциты вырабатывают патологический иммуноглобулин – парапротеин, который является основным маркером миеломатоза при дифференциальной диагностике.
Болезни подвержены в основном пожилые пациенты, организм которых не в состоянии переносить тяжёлые интенсивные курсы химиотерапии. Поэтому срок между появлением первых мутировавших плазмоцитов и диагностикой заболевания непосредственно влияет на прогнозы выживаемости. При этом рост числа патологических клеток и развитие миеломной болезни могут происходить чрезвычайно медленно. От появления первых плазмоцитов с мутациями до образования очагов миеломы может проходить 20-30 лет.
Переломный момент наступает после проявления клинических признаков заболевания. Миелома начинает быстро прогрессировать. Избыток парапротеина негативно влияет на висцеральные органы (в основном на выделительную систему) и кости организма.
Миеломы классифицируются в зависимости от особенностей расположения изменённых плазмоцитов в здоровых тканях костного мозга и специфики их состава. В зависимости от локализации патологических клеток в кроветворных тканях различают диффузную, диффузно-очаговую и множественную (множественно-очаговую) форму заболевания.
Состав клеток позволяет классифицировать миеломатозные опухоли на плазмобластные, плазмоцитарные, мелко- и полимфортноклеточные. Вид атипичных плазмоцитов определяется при тканевом (гистологическом) исследовании. Эта характеристика позволяет спрогнозировать скорость роста опухоли.
Одна из распространённых в медицинской практике классификаций учитывает также особенности локализации патологического очага (очагов) в костной системе и внутренних органах.
Солитарные или одиночные миеломатозные опухоли располагаются в кости, содержащей костномозговую ткань, либо в лимфоузле. Лимфоузлы непосредственно участвуют в реакции иммунитета на инфекционных агентов, поэтому нередко поражаются миеломной болезнью.
Множественные очаги миеломатоза занимают сразу несколько мест. Особенно уязвима для мутировавших плазмоцитов костномозговая ткань позвоночника, подвздошных и черепных костей, лопаток, ребёр. Нередко очаги опухоли образовываются в селезёнке, нескольких лимфоузлах и центральной части трубчатых костей ног и рук.
При подозрении на множественную миелому, а также рецидиве солитарной неоплазии плазматических клеток проводится полное исследование тела методами томографии.
На раннем этапе заболевание может протекать практически без симптомов. Когда количество патологически изменённых клеток достигает критического значения, и миелома образует солитарный или множественный очаг, проявляются клинические признаки плазмоцитарного рака.
Основные симптомы миеломной болезни:
- ноющие боли в костях конечностей, лопаток, черепа или позвоночника;
- тянущие боли в сердце и суставах (вызваны отложением амилоида – формы хранения парапротеинов во внутренних органах);
- частые бактериальные инфекции;
- патологические переломы костей конечностей, рёбер и позвонков;
- слабость, заторможенность когнитивных функций, нарушения работы ЖКТ (обусловлены гиперкальциемией – высвобождением кальция из растворённой костной ткани в кровь);
- анемия;
- учащённое сердцебиение (как результат компенсаторного механизма в ответ на недостаток эритроцитов);
- одышка, головная боль;
- деформация грудной клетки вследствие изменения костной ткани;
- нефропатия (нарушение функции почек вследствие образования кальциевых камней в их протоках);
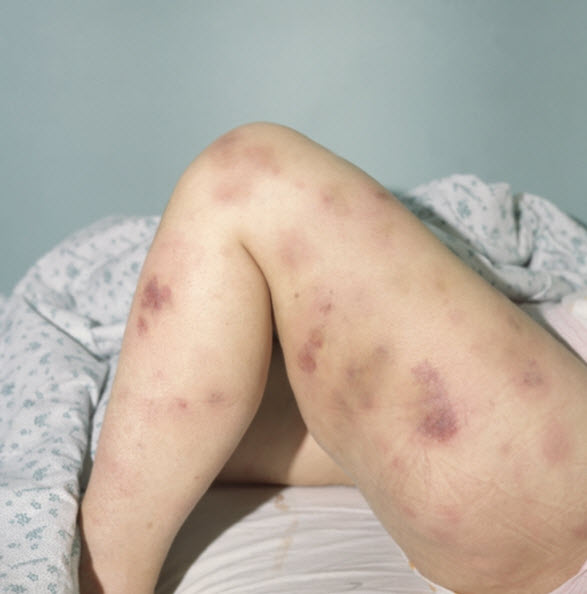
- снижение свёртываемости крови (с образованием множественных кровоподтёков), нередко – на фоне роста вязкости плазмы (в результате при частых кровотечениях у пациента могут образовываться тромбы).
У каждого десятого больного патологические плазмоциты не продуцируют парапротеин. В результате даже на стадии обширного развития миеломы заболевание протекает бессимптомно.
Интенсивность проявления симптомов и их перечень зависит от стадии болезни, её типа (например, при множественном миеломатозе в первую очередь фиксируют переломы и гиперкальциемию) и сопутствующих хронических заболеваний.
Признаки миеломы на разных стадиях
| Диагностические признаки | 1-я стадия | 2-я стадия | 3-я стадия |
|---|---|---|---|
| Остеопороз (хрупкость, разрушение костей) | Признаки остеопороза отсутствуют или наблюдаются в зоне миеломатозного очага | Признаки разрушения присутствуют, но не столь явные, как при 3-й стадии болезни | Наблюдается интенсивный остеопороз |
| Количество костей с миеломатозным очагом | Одиночная миелома | 1-2 | 3 и более костей поражено опухолью |
| Гиперкальциемия | >2,55 ммоль/л | >3 ммоль/л | |
| Уровень гемоглобина | >100 г/л | Анемия 1-й или 2-й степени | |
| Концентрация белка Бенс-Джонса | от 4 до 12 г белка в суточной моче | >12 г/сутки | |
| Сывороточные парапротеины | Менее 5 г/дл (IgG) Менее 3 г/дл (IgА) | Промежуточные значения | Более 7 г/дл (IgG) Вторая стадия болезни определяется чаще методом исключения, если показатели не соответствуют критериям 1-й и 3-й.Белок Бенс-Джонса является соединением, которое выделяется плазматическими клетками. В силу небольшой молекулярной массы оно сразу выводится почками, что делает его наличие важным диагностическим признаком при обследовании пациентов. Для определения миеломной болезни диагностика должна включать визуальные, аппаратные и лабораторные методы исследования. При осмотре хирург или онколог расспрашивает пациента о жалобах и времени проявления неприятных симптомов, измеряют частоту пульса, пальпируют болезненные участки костей, фиксируя, усиливается ли боль при нажатии. Также оценивается цвет кожного покрова (бледность может говорить об анемии), наличие синяков и кровоподтёков, припухлостей в местах частой локализации опухоли. При подозрении на миеломатоз пациенту назначают ряд исследований. Перечень аппаратных методов диагностики, которые применяются для выявления миелом, включает:
Все три метода позволяют выявить участки сниженной плотности костной ткани и дифференцировать патологию от других заболеваний опорно-двигательного аппарата. При поражении множественной миеломой на рентгенограмме отчётливо заметно, что кости черепа, позвоночника, лопаток и конечностей испещрены тёмными пятнами остеолитических повреждений. При солитарной (одиночной) опухоли нарушение плотности наблюдается лишь в месте её локализации. Томография является более информативным и полным методом. Она позволяет отследить костные поражения всего опорно-двигательного аппарата за короткое время и без облучения отдельных частей тела. Инструментальная диагностика включает забор пробы (пункцию) костного мозга для составления миелограммы. Миелограмма – это результат анализа биоматериала (миелоидной ткани), в которой указаны качественный и количественный составы костного мозга. Это исследование даёт возможность дифференцировать заболевание с другими видами рака крови. Основным диагностическим симптомом миеломы является патологически повышенная доля плазматических клеток (более 10-30 % при норме до 1,5 %). Параллельно с плазмоцитами может повышаться содержание недифференцированных бластов (норма составляет до 1,1 %). Содержание эритробластов, лимфоцитов и других кроветворных клеток, напротив, значительно снижено. Ключевая роль в постановке диагноза «миелома» отводится не только анализу миелоидной ткани, но и лабораторной диагностике (пробам крови и мочи). Для диагностики миеломатоза используются такие методы исследования:
Результаты общего анализа крови при миеломе значительно отличаются от нормы. Уровень гемоглоибна, а также количество тромбоцитов, лейкоцитов, эритроцитов, ретикулоцитов (предшественников красных кровяных клеток), нейтрофилов снижается. Растут скорость оседания эритроцитов (что свидетельствует о патологии без указания на её генез) и доля моноцитов в лейкоцитарной формуле. В пробе могут обнаружиться 1-2 плазмоцита. В общем анализе мочи определяются цилиндры, эритроциты и лёгкие цепи парапротеина (белки Бенс-Джонса). Выделяемая жидкость имеет более высокую плотность, чем у здорового человека (в основном за счёт патологических белков). В биохимическом анализе наблюдаются признаки поражения почек (повышенный уровень концентрации мочевой кислоты, мочевины и креатинина) и гиперкальциемии. На фоне малого количества альбумина за счёт присутствия парапротеина фиксируется аномально высокая концентрация общего белка. Иммуноэлектрофорез проводится для определения парапротеинов в моче или плазме крови. В зависимости от типа патологических клеток во время анализа могут быть выявлены парапротеины классов IgА (IgD, IgE, IgG) или бета-2 микроглобулины (уровень последнего указывает на стадию болезни). В качестве дополнительных методов диагностики используются анализы на концентрацию L-лактата (маркера повреждения тканей), электролитов и С-реактивного белка (его концентрация влияет на уровень содержания фактора роста миелом – интерлейкина-6). После постановки диагноза специалист-онколог проводит анализ для определения перспектив и скорости роста опухоли (индекс мечения плазмацитов). Симптоматика миеломатоза нередко напоминает проявление более распространённых заболеваний онкологического и доброкачественного генеза. Наибольшую сложность представляет дифференцирование признаков плазмоцитомы и доброкачественной моноклональной гаммапатии. Доброкачественные гаммапатии также характеризуются образованием клонов иммуноглобулинпродуцирующих клеток, однако рост их количества не происходит или происходит очень медленно. Концентрация моноклональных иммуноглобулинов в сыворотке крови не превышает 3 г/дл, а доля плазмоцитов в костномозговой ткани составляет до 5 %. Поражения костей и гиперкальциемия не фиксируются. Гаммапатия является наиболее частой причиной парапротеинемии (повышенного количества патологического белка в крови). По статистике, она наблюдается у 1-1,5 % людей старше 50 лет и у 3-10 % людей старше 70 лет. Это состояние не требует срочного лечения, но обязательно наблюдается врачами, т. к. в 16 % случаев оно способно развиться в миеломную болезнь, а в 17 % и 33 % (в течение 10 и 20 лет соответственно) – в другие виды гемобластозов. В половине случаев повышенное количество патологического белка наблюдается в течение всей жизни пациента, но не становится причиной его смерти. Дифференциальная диагностика с другими причинами остеолитических повреждений (низкая секреция эстрогенов, болезнь Реклингаузена, старческий остеопороз, метастазы карциномы предстательной и щитовидной желёз) производится по анализу концентрации парапротеинов и миелограмме. Схожесть с симптомами миеломы имеют и признаки болезни Вальденстрёма. Наблюдаются характерное повышение моноклональных иммуноглобулинов (IgM), избыточная выработка парапротеинов и повышенное количество лимфоплазмоцитарных клеток. Отличие заключается лишь в отсутствии литических поражений костей, что определяется на томографии. Дифференциальная диагностика миеломатоза и других синдромов, связанных с парапротеинемией, проводится также при почечной недостаточности невыясненной этиологии. Ранняя диагностика миелом возможна только при регулярном проведении общих клинических анализов и почечных проб (биохимии крови). Если пациент бережно относится к своему здоровью и ежегодно отслеживает динамику результатов, то у него есть все шансы обратиться к врачу задолго до появления клинических признаков миеломатоза и с помощью интенсивной терапии достигнуть длительной ремиссии заболевания. Мы будем очень благодарны, если вы оцените ее и поделитесь в социальных сетях источник Миелома (миеломная болезнь) – виды (множественная, диффузная, солитарная и др.), симптомы и стадии, диагностика, методы лечения, продолжительность жизни и прогнозСайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна! Миеломная болезнь также называется миеломой, болезнью Рустицкого-Калера, генерализованной плазмоцитомой, миеломатозом или ретикулоплазмоцитозом. Наиболее часто для обозначения данной патологии используются два термина – это миелома и миеломная болезнь. В дальнейшем тексте мы также будем пользоваться данными терминами в качестве синонимов. Итак, миеломная болезнь представляет собой одну из разновидностей гемобластозов , которые в обиходе называют «раком крови». То есть, миелома – это заболевание, характеризующееся злокачественным ростом количества клеток крови определенного вида (плазмоцитов), которые вырабатывают патологический белок — парапротеин . Причем количество плазмоцитов в крови и костном мозгу растет из-за мутации в этих клетках. И именно мутация обуславливает синтез ими большого количества парапротеина. Стойкое увеличение количества мутировавших плазмоцитов выше нормы является основным критерием того, что миелому относят к разновидности злокачественных опухолей. От рака другой локализации (например, рака яичников, кишечника и других органов) миеломная болезнь отличается тем, что опухолевые клетки могут сразу находиться в разных органах и тканях, куда их приносит кровоток. Вследствие большого количества плазмоцитов в костном мозгу нарушается нормальный процесс кроветворения и разрушаются кости, а парапротеин откладывается во многих органах и тканях, нарушая их функционирование и обуславливая развитие полиморфной и разнообразной клинической картины заболевания.
Чтобы понимать суть миеломы, необходимо знать, что такое плазмоциты вообще и моноклональные плазмоциты в частности, а также секретируемые ими парапротеины. Не менее важно четко представлять себе природу изменений в клетках, вызвавших их неконтролируемое размножение, и структуру патологических белков. Рассмотрим все эти понятия по-отдельности. Итак, любые плазмоциты (патологические и нормальные) представляют собой клетки, образовавшиеся из В-лимфоцитов. Процесс формирования нормальных плазмоцитов довольно сложен и всегда запускается попаданием какого-либо чужеродного микроорганизма в кровь. Дело в том, что после попадания микроба в кровь, в какой-то момент он «встречается» с циркулирующим В-лимфоцитом, который распознает в нем нечто чужеродное, а, следовательно, подлежащее уничтожению. После этого В-лимфоцит, встретившийся с антигеном, активируется и попадает в ближайший к его местоположению лимфатический узел. Например, если В-лимфоцит контактировал с патогенным микробом в сосудах кишечника, то он попадает в Пейеровы бляшки – особые скопления лимфоидной ткани кишок и т.д. В лимфатических узлах В-лимфоцит видоизменяется и получает способность вырабатывать только один вид антител (иммуноглобулинов), которые будут прицельно уничтожать встреченную им разновидность патогенного микроорганизма. То есть, если В-лимфоцит встретился с вирусом краснухи, то в лимфатических узлах он получит способность вырабатывать антитела только против этого микроба. Соответственно антитела против вируса краснухи не смогут уничтожать менингококк или любой другой микроб. Благодаря подобному механизму достигается избирательность действия иммунной системы, которая уничтожает только патогенные микробы и не наносит вреда представителям нормальной микрофлоры различных органов и систем. В-лимфоцит, получивший способность вырабатывать антитела против какого-либо микроба, становится зрелой иммунокомпетентной клеткой, которую уже называют плазмоцитом. То есть, плазмоцит и В-лимфоцит – это стадии зрелости одной и той же клетки иммунной системы. После превращения В-лимфоцита в плазмоцит, последний выходит в системный кровоток и начинает интенсивно размножаться. Это необходимо для того, чтобы клетки, способные вырабатывать антитела против обнаруженного патогенного микроба, оказались в кровотоке в большом количестве и максимально быстро уничтожили все микроорганизмы. Всю совокупность клеток, образовавшихся из одного плазмоцита, называют моноклональными, поскольку, по сути, они представляют собой многочисленные одинаковые клоны одной и той же клеточной структуры. Такие моноклональные плазмоциты вырабатывают совершенно одинаковые антитела, направленные против какого-либо одного патогенного микроба. Когда микроб будет уничтожен, большая часть моноклональных плазмоцитов погибнет, а несколько сотен клеток претерпят очередное преобразование и превратятся в так называемые «клетки памяти», которые будут обеспечивать иммунитет к перенесенному заболеванию в течение некоторого промежутка времени. Именно так происходит в норме. А при нарушениях описанного процесса образования плазмоцитов и выработки ими антител возникают различные заболевания, в том числе миелома. Так, миелома представляет собой результат нарушения процессов созревания и превращения В-лимфоцитов в плазмоциты и выработки ими антител (иммуноглобулинов). Дело в том, что миелома – это, по сути, безостановочное и постоянное образование моноклональных плазмоцитов, которые не погибают, а напротив, постоянно увеличиваются в числе. То есть, при формировании данного заболевания происходит нарушение механизма гибели плазмоцитов, которые из кровотока проникают в костный мозг и продолжают размножаться. В костном мозгу размножающиеся плазмоциты постепенно начнут вытеснять все остальные ростки, вследствие чего у человека разовьется панцитопения (уменьшение количества всех видов клеток крови – эритроцитов, тромбоцитов и лейкоцитов). Кроме того, патологические непогибающие моноклональные плазмоциты, являющиеся субстратом миеломы, вырабатывают дефектные иммуноглобулины (антитела). У этих иммуноглобулинов имеются какие-либо дефекты составляющих их легких или тяжелых цепей, из-за которых они в принципе не способны уничтожать какие-либо патогенные микроорганизмы. То есть, моноклональные плазмоциты миеломы вырабатывают и секретируют в кровь дефектные молекулы иммуноглобулинов, которые по своей структуре являются белками (протеинами), и потому называются парапротеинами. Данные парапротеины, неспособные уничтожать патогенные микробы, циркулируют в системном кровотоке и проникают в ткани различных органов и систем, куда их может принести кровь. То есть, парапротеины чаще всего проникают в ткани обильно кровоснабжаемых органов, таких, как почки, печень, селезенка, сердце, костный мозг, нервные волокна и т.д. Попадая в ткани, парапротеины откладываются в межклеточном пространстве, буквально нафаршировывая орган патологическими белками, что нарушает его нормальное функционирование. Именно с инфильтрацией парапротеинов в различные органы и системы связаны многочисленные и разнообразные клинические проявления миеломной болезни. То есть, непосредственно опухоль локализуется в костном мозге, а вырабатываемые ей парапротеины откладываются в разных органах. Патологические плазмоциты, образующие миелому в костном мозгу, выделяют биологически активные вещества, которые оказывают следующие эффекты:
Подводя итог, можно сказать, что миелома – это злокачественное заболевание, обусловленное неконтролируемым размножением моноклональных патологических плазмоцитов, вырабатывающих парапротеины, инфильтрирующие жизненно-важные органы и ткани и вызывающие нарушения их функционирования. Поскольку патологические плазмоциты размножаются неконтролируемо и их число постоянно растет, то миелому относят к злокачественным опухолям системы крови – гемобластозам. Миеломная болезнь обычно развивается у людей старшего возраста (старше 40 лет) и крайне редко регистрируется у молодых мужчин и женщин младше 40 лет. Частота встречаемости миеломы возрастает в более старших возрастных категориях, то есть, у людей 40 – 50 лет заболевание развивается реже, чем у 50 – 60 – летних и т.д. Мужчины болеют чаще женщин. Миелома течет и развивается очень медленно. От момента появления в костном мозгу патологических плазмоцитов и формирования первых очагов опухоли до развития клинических симптомов может проходить 20 – 30 лет. Но после манифестации клинических симптомов миеломы, заболевание в среднем в течение 2 года приводит к смерти человека от осложнений, связанных с поражением парапротеинами различных органов и систем.
Так, миелома Бенс-Джонса характеризуется выделением атипичного иммуноглобулина, который называется белком Бенс-Джонса, на основании чего опухоль и получила свое название. Миеломы G, А, М, Е и D секретируют, соответственно, дефектные иммуноглобулины типов IgG, IgA, IgM, IgE, IgD. А несекретирующая миелома не производит какого-либо парапротеина. Данная иммунохимическая классификация миелом в практической медицине используется редко, поскольку на ее основе невозможно выработать оптимальной тактики терапии и наблюдения за пациентом. Выделение данных разновидностей миеломы имеет значение для научных исследований. На практике применяются другие классификации миелом, основанные на клинико-анатомических особенностях расположения плазмоцитов в костном мозгу, а также на особенностях клеточного состава опухоли. Во-первых, в зависимости от того, в скольких костях или органах находятся очаги опухолевого роста, миеломы подразделяются на множественные и солитарные. Множественная миелома характеризуется формированием очагов опухолевого роста одновременно в нескольких костях, внутри которых имеется костный мозг. Чаще всего поражаются позвонки, ребра, лопатка, крылья подвздошных костей, кости черепа, а также центральная часть длинных костей рук и ног. Кроме того, помимо костей, могут поражаться и лимфатические узлы, и селезенка. Наиболее часто развивается множественная миелома, а наиболее редко – солитарная. Клинические проявления, а также принципы терапии данных разновидностей миелом одинаковы, поэтому, как правило, врачи выделяют конкретную форму заболевания для правильной постановки диагноза, а также оценки прогноза по жизни и по здоровью. В остальном каких-либо принципиальных различий между солитарной, множественной, диффузной и диффузно-очаговой миеломами нет, поэтому мы будем рассматривать их совместно. Если же для какой-либо разновидности миеломы необходимо будет подчеркнуть ее особенности, то это будет сделано. Так, в зависимости от того, как плазмоциты расположены в костном мозгу, миеломы подразделяются на следующие виды:
Диффузно-очаговая миелома сочетает в себе черты множественной и диффузной. В зависимости от клеточного состава миеломы ее подразделяют на следующие виды:
К симптомам миеломы, связанным с локализацией и ростом опухоли в костях, относят следующие:
Боли в костях связаны с их разрушением, деформацией и сдавлением растущей опухолью. Боль обычно усиливается в положении лежа, а также при совершении движений, кашле и чихании, но не присутствует постоянно. Постоянные боли обычно свидетельствуют о переломе кости. Остеопороз, хрупкость и склонность костей к переломам возникают из-за их разрушения растущей опухолью. Деформация костей и сдавление внутренних органов также связаны с нарушением их плотности. При компрессионном сдавлении спинного мозга деформированными позвонками нарушается нервная регуляция работы мочевого пузыря и кишечника, вследствие чего человек может страдать недержанием кала и задержкой мочи. Кроме того, при сдавлении позвоночника может нарушаться чувствительность ног или развиваться мышечная слабость. Гиперкальциемия развивается постепенно и на ранних этапах проявляется тошнотой, обезвоживанием, сильной жаждой, сонливостью, общей слабостью, усиленным мочевыведением (более 2,5 литров мочи в сутки), запорами, мышечной слабостью и анорексией. Если не проводится адекватное симптоматическое лечение, направленное на уменьшение уровня кальция в крови, то гиперкальциемия может спровоцировать прогрессирующее нарушение умственной деятельности, почечную недостаточность и кому. Частые инфекционные заболевания обусловлены тем, что плазмоциты в костном мозгу вытесняют нормальные кроветворные ростки, вследствие чего не образуется необходимого количества эритроцитов, лейкоцитов и тромбоцитов. Из-за дефицита образования в костном мозгу эритроцитов у человека, страдающего миеломой, развивается анемия. Из-за дефицита лейкоцитов – лейкопения, а тромбоцитов – соответственно, тромбоцитопения. Лейкопения, в свою очередь, приводит к резкому ухудшению иммунитета, вследствие чего человек начинает часто болеть различными бактериальными инфекциями, такими, как пневмония, менингит, цистит, сепсис и т.д. На фоне тромбоцитопении происходит ухудшение свертываемости крови, что проявляется с кровоточивости десен и т.д. Симптомами миеломы, обусловленными секрецией парапротеинов в кровь и их отложением в различных органах и системах, являются следующие:
Гипокоагуляция развивается вследствие двух факторов. Во-первых, это дефицит тромбоцитов в крови, а во-вторых, это функциональная неполноценность тромбоцитов, поверхность которых покрыта парапротеинами. В результате оставшиеся в крови тромбоциты не в состоянии обеспечивать нормальную свертываемость крови, что провоцирует кровоточивость и склонность к кровотечению. Повышенная вязкость крови проявляется кровоточивостью (спонтанные кровотечения из десен, кишки, носа, влагалища и др.), а также образованием синяков и ссадин на кожном покрове. Кроме того, на фоне кровоточивости при миеломе может развиваться так называемый синдром «глаз енота», который возникает из-за ломкости сосудов и повышенной вязкости крови. Суть данного синдрома заключается в образовании большого синяка в области мягких тканей орбиты глаза после почесывания или легкого прикосновения к ним (рисунок 1).
При исследовании сетчатки глаза, нафильтрованной парапротеином, видны характерные «сосисковидные» вены, растянутые слишком вязкой кровью. Повышенная вязкость крови всегда приводит к нарушениям зрения. Кроме того, из-за повышенной вязкости крови у человека развиваются различные неврологические нарушения, такие как синдром Бинга-Нила , который включает в себя следующий характерный симптомокомплекс:
Также из-за недостаточного кровоснабжения глубоко лежащих тканей и органов повышенная вязкость крови может вызывать сердечную недостаточность, одышку, гипоксию, общую слабость и анорексию. Вообще классической триадой проявлений повышенной вязкости крови считается сочетанное нарушение умственной деятельности, одышка и патологическая кома. Почечная недостаточность и нефротический синдром обусловлены несколькими факторами – гиперкальциемией, отложением парапротеинов в канальцах почек и частыми бактериальными инфекциями. Отложение парапротеинов в канальцах почек называется AL-амилоидозом, который относится к осложнению миеломы. Из-за амилоидоза канальцы не могут выполнять свои функции, а избыток белка и кальция в фильтруемой крови перегружают почки, вследствие чего ткани органа необратимо повреждаются с формированием недостаточности. Поражение почек при миеломе проявляется протеинурией (белок в моче) без гипертонии и гиперурикемией (мочевая кислота в моче). Причем в моче при специальном исследовании обнаруживается белок Бенс-Джонса, что является отличительной чертой миеломной болезни. Отеков и гипертонии при нефротическом синдроме, обусловленном миеломой, не бывает, как при классической почечной недостаточности. Изолированных форм миеломы, когда опухоль располагается в каком-либо органе, не существует. Даже солитарная миелома, при которой первичный очаг поражает либо костный мозг какой-либо одной кости, либо лимфатический узел, не может относиться к опухолям с определенной локализацией. Часто, не понимая сущности миеломы, люди пытаются описать ее в привычных терминах и понятиях, искусственно локализуя опухоль в каком-либо органе, например, почках, позвоночнике, костном мозгу, коже или черепе. Вследствие этого употребляются соответствующие термины, такие, как миелома костей, миелома позвоночника, миелома кожи, миелома почки и т.д. Однако все эти термины являются некорректными, поскольку миелома – это злокачественная опухоль, первичный очаг роста которой может располагаться в одной или нескольких костях, содержащих костный мозг. А поскольку костный мозг имеется в костях таза, черепа, рук и ног, а также в позвонках, ребрах и лопатках, то первичный очаг миеломы может располагаться в любой из указанных костей. Для уточнения локализации первичного опухолевого очага врачи могут часто в короткой форме говорить «миелома позвоночника», «миелома черепа», «миелома ребер» или «миелома костей». Однако во всех случаях это означает только одно – человек страдает злокачественным заболеванием, симптомы которого будут одинаковыми вне зависимости от того, в какой именно кости локализован первичный очаг опухоли. Поэтому на практике с точки зрения подходов к терапии и клинической симптоматики миелома позвоночника ничем не отличается от миеломы черепа и т.д. Поэтому для описания клинических проявлений и подходов к лечению можно пользоваться термином «миелома», не уточняя, в какой именно кости локализован первичный очаг опухолевого роста. Термины «миелома костей», «миелома костного мозга» и «миелома крови» являются некорректными, поскольку в них содержится характеристика, пытающаяся уточнить локализацию опухоли (кости, костный мозг или кровь). Однако это неправильно, поскольку миелома – это опухоль, которая всегда поражает костный мозг вместе с костью, в которой он содержится. Таким образом, термины «миелома костей» и «миелома костного мозга» — это наглядная иллюстрация известного выражения «масло масляное», описывающего избыточность и нелепость уточнений. Миелома кожи и миелома почки – это неправильные термины, которые также пытаются локализовать опухоль в данных органах. Однако это в корне неверно. Очаг роста миеломы всегда локализован либо в костном мозгу, либо в лимфатическом узле, но вот секретируемые ей парапротеины способны откладываться в различных органах, вызывая их повреждение и нарушение функционирования. У разных людей парапротеины могут больше всего повреждать различные органы, в том числе кожу или почки, что является характерологическими чертами заболевания. В зависимости от тяжести заболевания и объема поражения тканей миеломная болезнь подразделяется на 3 стадии (степени). I степень миеломы соответствует следующим критериям:
Множественная миелома 3 степени выставляется, если у человека имеется хотя бы один из нижеперечисленных признаков:
II степень миеломы является диагнозом исключения, поскольку ее выставляют, если перечисленные лабораторные показатели выше, чем при I стадии, но ни один из них не доходит до значений, характерных для III стадии. Диагностика миеломной болезни начинается с общего осмотра человека врачом, а также подробного расспроса о жалобах, времени их появления и особенностях течения. После этого врач ощупывает болезненные участки тела и спрашивает, усиливается ли боль и отдает ли она куда-либо. После осмотра при подозрении на миеломную болезнь производятся следующие диагностические исследования:
Наличие указанных признаков на рентгенограмме подтверждает миеломную болезнь. Однако только рентгена недостаточно для определения стадии и фазы миеломы, а также степени тяжести общего состояния. Для этого используются лабораторные анализы.
Для миеломы характерны следующие значения показателей общего анализа крови:
Кроме того, в мазке крови видны тельца Джолли, что свидетельствует о нарушении работы селезенки.
Определение концентрации белка бета2-микроглобулина производится отдельно при наличии подозрения именно на миелому и не входит в стандартный перечень показателей биохимического анализа крови. При миеломе уровень бета2-микроглобулина существенно выше нормы. В общем анализе мочи при миеломе обнаруживаются следующие изменения:
При нагревании мочи выпадает в осадок белок Бенс-Джонса, количество которого при миеломной болезни составляет 4 – 12 г в сутки или более. Указанные показатели анализов крови и мочи не специфичны только для миеломы, и могут встречаться при широком спектре различных заболеваний. Поэтому анализы мочи и крови в диагностике миеломы должны рассматриваться исключительно в комплексе с результатами других диагностических манипуляций, таких, как рентген, миелограмма, компьютерная томография и иммуноэлектрофоретическое определение парапротеинов. Единственными специфичными для миеломы показателями анализов являются резкое увеличение СОЭ более 60 мм/час, высокая концентрация бета2-микроглобулина в крови и белок Бенс-Джонса в моче, который в норме вообще не обнаруживается. В коагулограмме при миеломе отмечается увеличение МНИ более 1,5, ПТИ выше 160% и ТВ больше нормы, а АЧТВ, как правило, остается нормальным. Миелограмма представляет собой подсчет количества различных клеток костного мозга в мазке. При этом мазок готовится точно так же, как и мазок крови для обычного общего анализа. Костный мозг для миелограммы забирается при помощи специального мандрена из крыла подвздошной кости или грудины. В миелограмме при миеломной болезни обнаруживается более 12% плазмоцитов на различных стадиях созревания. Также имеются патологические клетки с вакуолями в цитоплазме и колесообразным хроматином ядра. Количество плазмоцитов более 12% и угнетение других ростков кроветворения подтверждают диагноз миеломной болезни. Определение парапротеинов методом иммуноэлектрофореза и иммуноглобулинов по Манчини являются специфическими анализами, результаты которых однозначно отвергают или подтверждают миеломную болезнь. Наличие парапротеинов в крови или моче, и концентрация иммуноглобулинов выше нормы – это точное подтверждение миеломы. Причем высокое содержание какого-либо иммуноглобулина в крови называется М-градиентом (мю-градиентом). После получения результатов всех анализов и обследований диагноз миеломы выставляется на основании различных диагностических критериев. Классическими диагностическими критериями миеломы считаются следующие показатели анализов:
То есть, если у человека по результатам анализов выявлены указанные критерии, то диагноз миелома считается подтвержденным. Во-первых, следует знать, что не существует методов радикального лечения миеломы, поэтому вся терапия заболевания направлена на продление жизни. То есть, миелому нельзя вылечить полностью, как например, рак прямой кишки, груди или другого органа, можно только остановить прогрессирование опухоли и ввести ее в состояние ремиссии, что и продлит жизнь человека. Лечение миеломы складывается из применения специализированных цитостатических методов, которые обеспечивают остановку прогрессирования опухоли и продлевают жизнь человека, и симптоматической терапии, направленной на коррекцию нарушений работы жизненно-важных органов и систем. К цитостатическим методам лечения миеломной болезни относят химиотерапию и лучевую терапию. Причем к лучевой терапии прибегают только в том случае, если химиотерапия оказалась неэффективной. К симптоматическим методам терапии миеломы относят хирургические операции при сдавлении органов, применение обезболивающих препаратов, коррекцию уровня кальция в крови, лечение почечной недостаточности и нормализацию свертываемости крови.
Монохимиотерапия проводится одним из следующих препаратов по схеме:
Полихимиотерапия проводится по следующим схемам:
Если химиотерапия оказалась эффективной, то после завершения курса производят трансплантацию собственных стволовых клеток костного мозга. Для этого в ходе пункции забирают костный мозг, выделяют из него стволовые клетки и подсаживают их обратно. Кроме того, в периоды между курсами химиотерапии для максимального продления периода ремиссии рекомендуется вводить внутримышечно препараты альфа-интерферона (Альтевир, Интрон А, Лайфферон, Реколин и т.д.) по 3-6 млн ЕД по 3 раза в неделю. Химиотерапия позволяет достичь полной ремиссии в 40% случаев и частичной – в 50%. Однако даже при полной ремиссии часто возникает рецидив миеломы, поскольку заболевание является системным и поражает большое количество тканей.
Для купирования болей сначала применяют препараты группы НПВС и спазмолитики – Спазган, Седальгин, Ибупрофен и Индометацин. Если эти препараты не эффективны, то для купирования болей принимают средства центрального действия, такие, как Кодеин, Трамадол или Просидол. Для усиления эффекта к средствам центрального действия можно добавлять препараты группы НПВС. И только если сочетанный прием препаратов НПВС и центрального действия не эффективен, то для купирования болей прибегают к применению наркотических анальгетиков, таких как, Морфин, Омнопон, Бупренорфин и др. Для устранения гиперкальциемии применяют препараты, содержащие ибандронат натрия, кальцитонин, преднизолон, витамин Д и метандростенолол, в индивидуальных дозировках. Для поддержания функций почек при почечной недостаточности рекомендуется принимать Хофитол, Ретаболил, Празозин и Фуросемид в индивидуальных дозировках. При выраженном повышении концентрации мочевины крови на фоне почечной недостаточности производят гемодиализ или плазмаферез. К сожалению, прогноз при миеломной болезни неблагоприятный. В среднем химиотерапия в сочетании с симптоматическим лечением позволяет добиться ремиссии на 2 – 3 года практически у всех больных, увеличивая продолжительность жизни более чем на 2 года. Без лечения продолжительность жизни больных миеломой не превышает 2 лет. В среднем продолжительность жизни при миеломе на фоне лечения составляет 2 – 5 лет, в редких случаях – до 10 лет, а без терапии – менее 2 лет. Полное излечение с продолжительностью жизни более 10 лет возможно только при солитарной форме миеломы. Множественная миелома (миеломная болезнь): симптомы и патогенез заболевания, прогноз и продолжительность жизни, отзывы пациентов и рекомендации врача — видеоАвтор: Наседкина А.К. Специалист по проведению исследований медико-биологических проблем. источник |
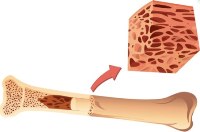 Согласно определению, миелома – это злокачественное заболевание, характеризующееся усиленной пролиферацией (размножением) и накоплением в костном мозгу моноклональных плазмоцитов, которые, в свою очередь, активно синтезируют и секретируют в кровоток патологические белки, называемые парапротеинами.
Согласно определению, миелома – это злокачественное заболевание, характеризующееся усиленной пролиферацией (размножением) и накоплением в костном мозгу моноклональных плазмоцитов, которые, в свою очередь, активно синтезируют и секретируют в кровоток патологические белки, называемые парапротеинами. В зависимости от того, какую именно разновидность парапротеинов секретируют патологические плазмоциты, миелома подразделяется на следующие иммунохимические разновидности:
В зависимости от того, какую именно разновидность парапротеинов секретируют патологические плазмоциты, миелома подразделяется на следующие иммунохимические разновидности: 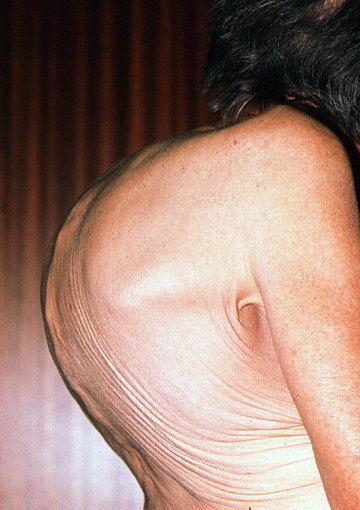
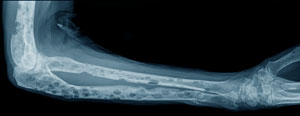

 Рентген при миеломной болезни позволяет выявить поражения костей опухолью. Характерными рентгенологическими признаками миеломы являются следующие:
Рентген при миеломной болезни позволяет выявить поражения костей опухолью. Характерными рентгенологическими признаками миеломы являются следующие:  Наиболее простыми в исполнении, но достаточно информативными являются общий анализ крови и мочи, а также биохимический анализ крови.
Наиболее простыми в исполнении, но достаточно информативными являются общий анализ крови и мочи, а также биохимический анализ крови. Химиотерапия при миеломе может производиться одним (монохимиотерапия) или несколькими препаратами (полихимиотерапия).
Химиотерапия при миеломе может производиться одним (монохимиотерапия) или несколькими препаратами (полихимиотерапия). Симптоматическая терапия направлена на купирование болей, нормализацию концентрации кальция и свертываемости крови, а также на устранение почечной недостаточности и сдавления органов.
Симптоматическая терапия направлена на купирование болей, нормализацию концентрации кальция и свертываемости крови, а также на устранение почечной недостаточности и сдавления органов.