Внутриутробные инфекции: понятие TORCH, этиология, пути инфицирования плода, методы диагностики, принципы терапии беременной и новорождённого.
Внутриутробные инфекции ( ВУИ , врождённые инфекции, TORCH-синдром) — группа инфекционно-воспалительных заболеваний плода и новорождённого, вызванных различными возбудителями, но характеризующихся общими эпидемиологическими закономерностями и нередко имеющими сходные клинические проявления. Для обозначения внутриутробных инфекций, манифестирующих с первого дня жизни, используют также термин «TORCH-синдром».
Данный термин образован первыми буквами латинских названий наиболее часто верифицируемых врождённых инфекций: T — токсоплазмоз (Тoxoplasmоsis), R — краснуха (Rubella), С — цитомегалия (Cytomegalia), Н — герпес (Herpes) и О — другие инфекции (Оther). К последним относят сифилис, листериоз, вирусные гепатиты, хламидиоз, ВИЧ-инфекция, микоплазмоз и др. Врождённые инфекции возникают в результате внутриутробного (антенатального или интранатального) инфицирования плода.
При этом в большинстве случаев источником инфекции для плода является мать. В последние годы использование инвазивных методов пренатальной диагностики и лечения (амниоцентез, пунктирование сосудов пуповины и др.) и внутриматочное введение препаратов крови через сосуды пуповины (переливание эритроцитарной массы плоду при гемолитической болезни), а также пролонгирование беременности при преждевременном разрыве околоплодных оболочек предрасполагают к ятрогенному внутриутробному инфицированию плода.
Истинная частота врождённых инфекций до настоящего времени не установлена, однако по данным ряда авторов распространённость внутриутробного инфицирования в человеческой популяции может достигать 10–15%. ВУИ относят к тяжёлым заболеваниям, которые во многом определяют уровень младенческой смертности. При этом актуальность проблемы ВУИ обусловлена не только существенными перинатальными и постнатальными потерями, но и нередким возникновением неблагоприятных отдалённых последствий для здоровья, приводящих к инвалидности у детей, перенёсших тяжёлые формы врождённой инфекции.
Основным источником инфекции при ВУИ является мать ребёнка, от которой возбудитель в антенатальном или интранатальном периоде проникает в организм плода. При этом вертикальная передача инфекции может быть осуществлена трансовариальным, трансплацентарным и восходящим путями в антенатальный период, а также контактным путём во время родов. Антенатальное инфицирование в большей степени характерно для вирусов (ЦМВ, вирус краснухи, Коксаки и др.), токсоплазмы и микоплазмы. Интранатальная контаминация более характерна для бактерий и грибов. При этом спектр возбудителей интранатальной инфекции значительно разнообразней и зависит от особенностей микробного пейзажа слизистых оболочек родовых путей матери. Наиболее часто в этот период происходит инфицирование плода такими микроорганизмами, как стрептококки группы В, энтеробактерии, эшерихии коли, а также вирусы простого герпеса, ВИЧ, микоплазмы, уреаплазмы, хламидии и др. В настоящее время известно более 100 микроорганизмов, способных вызывать ВУИ . Помимо «классических» возбудителей TORCH-инфекции, показано патогенное влияние на человеческий плод энтеровирусов, ВИЧ, хламидий, микоплазмы (Ureaplasma urealyticum, Mycoplasma hominis), вирусов гриппа, парагриппа, аденовирусов, парвовирусов B16, герпес-вирусов 4 и 6 типов и др.
При высокой распространённости внутриутробного инфицирования потенциальная угроза внутриутробной трансмиссии инфекционных агентов от матери к ребёнку существенно возрастает в тех случаях, когда женщина имеет отягощённый соматический, акушерско-гинекологический и инфекционный анамнез. При этом риск инфицирования повышают воспалительные заболевания урогенитального тракта, неблагоприятное течение беременности (тяжёлые гестозы, угроза прерывания, патологическое состояние маточно-плацентарного барьера, инфекционные заболевания). Развитие манифестных форм инфекционного заболевания во многом зависит и от состояния новорождённого. Так, риск реализации врождённой инфекции значительно возрастает при недоношенности; задержке пренатального развития; перинатальном поражении ЦНС; патологическом течении интранатального или раннего неонатального периода.
Помимо этого, прогноз внутриутробной инфекции зависит от срока гестации, в котором произошло инфицирование, особенностей возбудителя (патогенных и иммуногенных его свойств), длительности течения инфекции у матери (первичная или вторичная), функционального состояния иммунной системы матери, целостности маточно-плацентарного барьера и др.
Инфекция называется первичной в том случае, если организм матери инфицируется данным возбудителем впервые во время беременности. О первичном характере инфекции можно говорить, если специфические АТ (IgМ, IgG) обнаруживают у ранее серонегативного пациента. Если же инфекционный процесс развивается в результате активизации возбудителя, находившегося до этого в организме в латентном состоянии (реактивация), или из-за повторного инфицирования (реинфекция), то такую инфекцию классифицируют как вторичную. Наиболее часто инфицирование плода и развитие тяжёлых форм ВУИ отмечают в тех случаях, когда во время беременности женщина переносит первичную инфекцию.
В тех случаях, когда инфицирование происходит в период эмбриогенеза, чаще отмечаются самопроизвольные выкидыши или возникают тяжёлые, несовместимые с жизнью пороки развития. Проникновение возбудителя в организм плода в ранний фетальный период приводит к развитию инфекционно-воспалительного процесса, который характеризует преобладание альтернативного компонента и формирование в повреждённых органах фиброзно-склеротических деформаций. При этом нередко возникает первичная плацентарная недостаточность, сопровождающаяся хронической внутриутробной гипоксией плода и развитием симметричной ЗВУР. Инфицирование плода в поздний фетальный период сопровождает как воспалительное повреждение отдельных органов и систем (гепатит, кардит, менингит или менингоэнцефалит, хориоретинит, поражение кроветворных органов с развитием тромбоцитопении, анемии и др.), так и генерализованное поражение. При антенатальном инфицировании плода беременность, как правило, заканчивается преждевременными родами, а клинические симптомы инфекционного заболевания проявляются уже при рождении. В то же время при интранатальном заражении плода сроки реализации инфекционно-воспалительного процесса часто сдвинуты от момента родов, в результате чего манифестация внутриутробной инфекции может произойти не только в первые недели жизни, но даже и в постнеонатальный период. Тем не менее, в подавляющем большинстве случаев внутриутробной инфекции клинические проявления заболевания дебютируют в неонатальный период.
С практической точки зрения целесообразно выделять инфекции, клинические проявления которых возникли до рождения ребёнка (истинно врождённые инфекции), и перинатальные инфекции, клинические проявления которых манифестируют в течение раннего неонатального периода. При этом крайне важно проводить дифференциальную диагностику между внутриутробной инфекцией, которая развилась в результате интранатального инфицирования, и нозокомиальной инфекцией.
Следует отметить, что врождённую ВИЧ-инфекцию характеризует многолетнее латентное течение, а появление клинических симптомов обусловлено прогрессирующим снижением иммунитета, которое приводит к развитию тяжёлых форм оппортунистических заболеваний.
Установлено, что в подавляющем большинстве случаев врождённые инфекции различной этиологии у новорождённых имеют сходные клинические проявления. Наиболее типичные симптомы таких инфекций: ЗВУР; гепатоспленомегалия; желтуха; экзантемы; дыхательные расстройства; сердечно-сосудистая недостаточность; тяжёлые неврологические нарушения; тромбоцитопения, анемия и гипербилирубинемия с первых дней жизни.
источник
Многие женщины во время беременности, при регулярном визите к гинекологу, встречаются с таинственным термином TORCH. Анализ крови на ТОРЧ инфекции — это фраза, которую часто используют врачи. Эта аббревиатура образована из первых букв названий возбудителей инфекционных заболеваний.
Инфекция ТОРЧ вызывает следующие болезни:
- токсоплазмоз (T. Гонди);
- коревой (вирус краснухи);
- цитомегаловирус;
- герпетические инфекции (исследование крови на герпес);
- идругиеинфекции, такиекаксифилис, листериоз, гепатит С или ВИЧ.
Группа этих заболеваний может стать серьезной проблемой, если они появляются во время беременности, поэтому так важно регулярно проходить медицинский осмотр и сдавать анализы для их обнаружения, что позволяет пройти лечение на ранней стадии заболевания.
Частота специфических заболеваний различна, но чаще они выявляются при рекомендованных исследованиях в ходе беременности.
Эти данные указывают на то, что например, герпес встречаются у новорожденных 0,02-0,013%, цитомегаловирусная инфекция появляется в 1-4% беременных женщин и менее 50% женщин подвержены риску заражения токсоплазмозом.
Введение обязательной вакцинации в мировой практике значительно снизило заболеваемость корью и возможные ее осложнения. В последние несколько лет были зарегистрированы врожденные формы этого заболевания, хотя результаты анализа крови сообщают, что более 10% женщин в репродуктивном возрасте не имеет защитных антител.
Заболеваемость сифилисом, листериозом или корью колеблется от менее одного до нескольких случаев на 100 000 взрослых.
Некоторые из этих болезней представляют собой характерную клиническую картину, которая, вместе с эпидемиологической историей, позволяет поставить правильный диагноз.
В большинстве случаев должны быть проведены лабораторные испытания и сделана правильная и полная расшифровка анализа крови на ТОРЧ инфекции. Важную роль играют серологическое исследование на ТОРЧ, включая идентификацию соответствующих классов антител и молекулярные тесты, позволяющие обнаружить наличие генетического материала возбудителя (возбудителя заболевания) и, таким образом, бесспорно подтвердить или исключить инфекцию.
Тестирование крови на патогены TORCH должно быть сделано в первом триместре беременности. Наиболее удобно выполнить тест на стадии подготовки к беременности, это позволит наилучшим образом отслеживать возможные инфекции. Рекомендации Министерства здравоохранения, в частности, относятся к варианту тестирования на 10-й недели беременности для выявления сифилиса, токсоплазмоза, краснухи, вируса гепатита С (ВГС) и исследование крови на ВИЧ-инфекции.
Дальнейшие рекомендации относятся к беременным женщинам, у которых результаты исследований на токсоплазмоз, выполненные в первом триместре беременности, не выявили наличие заболевания (они были отрицательными). Анализ крови на ТОРЧ инфекции при беременности также должен проводиться между 21 и 26 неделями беременности. Повторная диагностика рекомендуется от 33 до 37 недель беременности на наличие заболеваний гепатита В (HBV) и С (ВГС), ВИЧ и сифилиса. Чрезвычайно важным является диагностика цитомегаловирусной инфекции с первого триместра беременности.
Полученные результаты, указывающие на возможную инфекцию требует дополнительного изучения и определения места, в котором произошла инфекция. Исследования включают в себя показатель авидности IgG (авидность — способность быстро реагировать на атакующей патоген), который говорит нам о степени поражения инфекцией (авидность увеличивается со временем).
Более подробная информация также можно получить определив уровень антител в крови, но часто наиболее важными являются молекулярные тесты из образца амниотической жидкости, крови или мочи, генетического материала возбудителя. Например, двухтрековая идентификация патогена цитомегаловируса. Мы ищем появления клинических симптомов инфекции или двусмысленность скрининга серологических тестов. Диагноз возможен после определения IgG и IgM и выделения вируса в моче, слюне и амниотической жидкости, полученной во время амниоцентеза.
В случае краснухи, защитные антитела получают после вакцинации или после болезни. Если их уровень низок, организм пациента не защищен от заболевания. Поэтому важным показателем является уровень защитных антител, который будет определять потенциальный риск заболевания.
Многие мамы задаются вопросом: как берут кровь у грудничка на торч инфекции. Это практически безболезненная манипуляция, на пяточке ребенка делают маленький прокол и берут кровь для анализа. Так, что нет поводов для беспокойства.
Возможные осложнения включают врожденный токсоплазмоз. Дефекты нервной системы, потеря слуха, нарушение зрения. При тяжелых формах инфекции могут иметь место выкидыши, мертворождения или осложнения в органах. Раннее обнаружение токсоплазмозом во время беременности может значительно сократить лечение и риск осложнений, которые наблюдаются у детей, рожденных от матерей, прошедших лечение.
Краснуха может бессимптомно протекать у беременных женщин, в то время, как плод может быть подвержен высокому риску серьезных осложнений — от абортов до многочисленных врожденных дефектов. Риск осложнений под влиянием времени инфицирования обратно пропорционален продолжительности беременности. В первом триместре беременности наибольшая степень риска, а наименьшая в третьем.
Среди наиболее распространенных осложнений кори являются:
Риск инфицирования плода при заражении цитомегаловирусом существует в каждом триместре беременности, хотя большая часть ущерба он наносит на ранней стадии беременности.
К сожалению, присутствие материнских антител против этого вируса не обеспечивает защиту от инфекции. Некоторые из симптомов врожденного цитомегаловируса могут быть видны на УЗИ — ультразвуковом исследовании (ретинит, глухота, нарушение психомоторного развития ребенка).
Инфекция после родов у новорожденного также связано с риском осложнений со смертельным исходом в 10% случаев. Изолированные два типа вируса простого герпеса HSV-1 и HSV-2.
Практически все из них нападают на отдельные части тела, HSV-1 поражает преимущественно кожу и слизистую оболочку полости рта, в то время как HSV-2 поражает кожу и слизистую оболочку половых органов мужчин и женщин. Во время первичной ТОРЧ инфекции вирус может атаковать плод. Внутриутробное инфицирование в 25% приводит к выкидышу или преждевременным родам. В других случаях, могут быть отклонения в развитии у детей.

При генитальном герпесе, повышается риск инфицирования новорожденного во время родов. В этом случае, самый безопасный способ прерывания беременности — кесарево сечение. Во время ухода за ребенком и кормления грудью очень важно соблюдать правила гигиены как при активной форме орального герпеса, так и при герпесе половых органов. Вирус может легко инфицировать ребенка. Поэтому анализ крови на ТОРЧ инфекции у ребенка делают в первые дни жизни.
Грипп распространенное заболевание, в том числе и у беременных женщин. Хотя в настоящее время и установлено, что грипп не увеличивает риск выкидыша, врожденных дефектов или внутриутробной смерти, все же существует риск преждевременных родов во время заболевания верхних дыхательных путей. Поэтому рекомендуются прививки также во время беременности и кормления грудью.
Прививки против кори во время беременности связаны с высокой частотой выкидышей, преждевременными родами и серьезными осложнениями для женщин, таких как: тяжелая пневмония, поражение сердечной мышцы, мозга и печени.
Врожденное заболевание может привести к смерти новорожденного до 60% случаев. Благодаря вакцинации в детском возрасте от краснухи и кори, у беременных женщин увеличивается устойчивость к данным заболеваниям.
Энтеровирусы являются более широкой группой и включают вирусы: Coxackie или вирус полиомиелита, вызывающих гепатит А. Заболевания, вызванные этими вирусами являются типичными «болезнь грязных рук». К сожалению, в то время как последствия для пациента невелики, для будущего ребенка могут быть очень серьезными, в том числе и внутриутробная смерть плода. Поэтому очень важно соблюдать основные правила гигиены.
Как вы можете ясно видеть, эти болезни часто могут представлять серьезную опасность для матери и ее ребенка. Чтобы свести к минимуму риск осложнений необходимо своевременно реагировать путем проведения диагностических тестов и анализа крови на ТОРЧ инфекции.
источник
ТОРЧ (TORCH) инфекции – это ряд инфекций, которые ВОЗ объединила в комплекс наиболее опасных для развития плода при беременности. Особенность ТОРЧ-инфекций заключается в том, что, будучи относительно безобидными для взрослых, они становятся чрезвычайно опасными для беременных.
В ТОРЧ группу входят вирусные и бактериальные инфекции, многие из которых протекают бессимптомно, но при первичном заражении ими во время беременности могут пагубно воздействовать на все системы и органы плода, главным образом на его нервную систему, повышая риск выкидыша и пороков развития.
В основе термина TORCH лежит сокращение (по первым буквам) латинских названий наиболее часто встречаемых врожденных инфекций. Синонимом термина «ТОРЧ-инфекции» является термин «внутриутробные инфекции» или «ВУИ».
В группу TORCH-инфекций включают следующие заболевания:
- Т – токсоплазмоз (toxoplasmosis);
- О – другие инфекции (others): сифилис (бледная трепонема), ВИЧ, ветряную оспу, хламидиоз, гепатит В и С;
- R – краснуху (rubella);
- С – цитомегаловирусную инфекцию или ЦМВ (cytomegalovirus);
- H – герпес (herpes simplex virus).
Анализ на ТОРЧ-инфекции желательно сдать до наступления беременности – на стадии планирования (за 2-3 месяца до планируемого зачатия) или на как можно более ранних сроках беременности. Причем анализы необходимо сдать вне зависимости от самочувствия беременной женщины, так как большинство ТОРЧ-инфекций никак себя не проявляют и протекают бессимптомно, но представляют реальную опасность нормальному внутриутробному развитию ребенка. Именно поэтому анализы на ТОРЧ-инфекций входят в базовый спектр обследования беременных женщин в женских консультациях в рамках оказания медицинской помощи женщинам в период беременности.
Обследование беременных на ТОРЧ-инфекции проводят только один раз – при постановке на учет в женской консультации. Для анализа на TORCH- инфекции используют сыворотку или плазму. Разные иммуноглобулины появляются в крови в разное время. Поэтому для диагностики ТОРЧ-инфекций в крови определяют наличие или отсутствие антител к возбудителю.
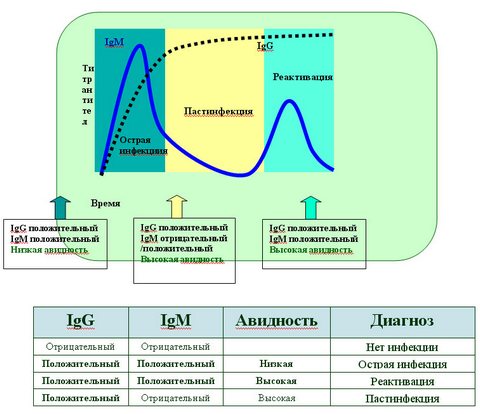
После заражения, первыми появляются (в минимальной концентрации) специфические IgM-антитела, которые достигают своего максимума к концу первого – началу третьего месяца заболевания, затем их содержание снижается и через несколько месяцев (от 2 до 6) они перестают определяться. Иммуноглобулины класса G появляются в сыворотке крови на второй-третьей неделе заболевания и достигают пика своей концентрации на месяц позже IgM-антител. В дальнейшем, содержание IgG-антител может снижаться, но они, как правило, продолжают определяться пожизненно.
Диагностика TORCH-инфекции заключается в определении антител (иммуноглобулинов) к группе инфекций. Антитела – это защитные белки иммунной системы, образующиеся в организме при попадании чужеродных веществ, международное обозначение их – Ig. Для диагностики TORCH-инфекции используются антитела IgG и IgM.
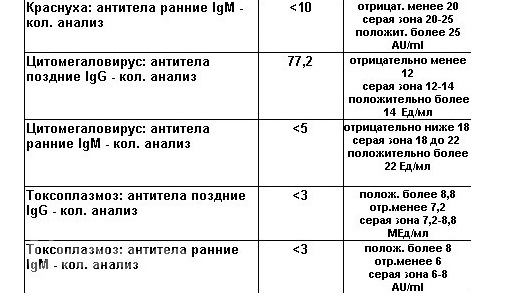
Анализ крови на TORCH-инфекции является комплексным исследованием, в его состав входит 8 тестов — определение антител IgM и IgG:
- к вирусу простого герпеса 1,2 типа;
- к цитомегаловирусу IgM и IgG;
- к вирусу краснухи IgM и IgG;
- к Toxoplasma gondii IgM и IgG;
Антитела IgM – титры говорят об острой фазе заболевания. В некоторых случаях антитела IgМ могут сохраняться в организме после первичного заражения долгое время. Для определения давности заражения беременной используется сопоставление результатов обнаружения IgM с титром и авидностью IgG.
Антитела IgG – повышение говорит о том, что организм уже когда-то встречался с этой инфекцией и выработал иммунитет.
Лаборатории могут определять наличие антител IgG и IgM для каждого показателя ТОРЧ-инфекции как качественно (в результате будет указано, обнаружены/не обнаружены или отрицательно/положительно), так и количественно (результат покажет количество антител — титры).
| IgG | IgM | Значение |
|---|---|---|
| – | – | Нет иммунитета к инфекции (организм с данной инфекцией ранее не встречался). Существует вероятность первичного заражения во время беременности. Необходимы профилактические мероприятия и мониторинг уровня антител во время беременности. |
| – | + | Начало болезни, заражение было недавно |
| + | + | Острая стадия заболевания. Существует опасность внутриутробного инфицирования. Рекомендуется проведение дополнительных методов обследования – тест на авидность антител IgG. |
| + | – | Ваш организм уже встречался с данным возбудителем и выработал иммунитет. Опасности для малыша нет. |
Основной задачей проведения скрининга на TORCH-инфекции, является выделение группы риска по первичному инфицированию и диагностика внутриутробных инфекций.
Наиболее опасным для плода является первичное инфицирование (заражение) беременной ТОРЧ-инфекциями, особенно на ранних ее сроках, поэтому если при обследовании на ТОРЧ-инфекции до беременности в крови женщины обнаруживаются антитела к ним, то женщина может спокойно планировать беременность – сформировавшийся иммунитет защитит ее и будущего малыша. Если же антител к ТОРЧ-инфекциям не обнаруживается, значит, беременной женщине необходимо будет принимать дополнительные меры для того, чтобы обезопасить от них себя и своего будущего ребенка.
Если заражение ТОРЧ-инфекцией произошло в первые несколько недель после оплодотворения, то повышается риск неразвивающейся беременности и выкидышей, либо, если беременность сохранилась, у малыша могут развиться многочисленные пороки развития органов вследствие поражений на клеточном уровне.
Если первичное заражение ТОРЧ-инфекцией произошло в третьем триместре, у малыша развиваются воспаления различных органов, у таких деток всегда имеются симптомы неврологического поражения центральной нервной системы различной степени выраженности.
Чем опасен токсоплазмоз для беременной? Тяжесть поражения плода токсоплазмозом находится в зависимости от срока инфицирования (стадии внутриутробного развития). Первичное заражение токсоплазмозом в ранние сроки нередко для эмбриона заканчивается его гибелью. При инфицировании на более поздних сроках процент передачи токсоплазмоза плоду очень высок, но риск тяжелых поражений плода снижается. При этом возможно развитие заболевания через несколько лет: заболевания сетчатки глаза, дефекты слуха, эндокринные нарушения и др. Если женщина переболела токсоплазмозом до беременности (не менее чем за полгода до нее), ее будущему ребенку токсоплазмоз не угрожает.
Чем опасна краснуха для беременной? Особенно опасно заболевание в первом триместре беременности. В этом случае больше половины детей рождаются с синдромом врожденной краснухи (СВК) который может включать серьезные врожденные аномалии органов зрения (катаракта, глаукома), пороки сердечно-сосудистной системы, пороки органов слуха, поражения центральной нервной системы, пищеварительной и мочеполовой систем. Задержку роста и сахарный диабет также связывают с поздними осложнениями внутриутробной краснухи. Потенциальная опасность внутриутробного инфицирования плода происходит в 100% случаев в первые 12 недель беременности. Если инфицирование произошло на 13-16 неделе беременности, то у родившегося ребенка может быть выявлена глухота. На более поздних периодах беременности (17-20 недель) инфицирование плода наблюдается редко.
Чем опасна цитомегаловирусная инфекция для беременной? Цитомегаловирусная инфекция занимает одно из первых мест по внутриутробному инфицированию плода. Заражение чаще всего происходит в родах. Опасность цитомегаловирусной инфекции для плода возникает только при первичном заражении женщины во время беременности. ЦМВ может привести к внутриутробной гибели плода или рождению ребенка с врожденной цитомегаловирусной инфекцией (гепатит, желтуха, увеличение печени и селезенки, пневмония, пороки сердца, врожденные уродства). Родившийся ребенок может страдать задержкой психического развития, глухотой, эпилепсией, церебральным параличом, мышечной слабостью.
Чем опасен герпес для беременной? При первичном заражении герпесвирусной инфекцией в первые 20 недель беременности повышается риск спонтанного аборта, а в последние недели – способствует преждевременным родам, либо к врождённому герпесу у ребенка, который характеризуется желтухой, увеличением печени и селезенки, аномалиями развития центральной неровной системы (ЦНС) и т. д. При первичном заражении герпесом во время беременности, особенно на начальной ее стадии, когда закладываются все органы и системы будущего ребенка, герпесная инфекция может быть смертельно опасной для плода.
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
TОRCH-синдром, или TОRCH-инфекции, – это обобщенное название, используемое для обозначения группы внутриутробных инфекций (ВУИ). В основе термина, который предложил Andre J. Nahmias в 1971 г., лежит сокращение (по первым буквам) латинских названий наиболее часто верифицируемых врожденных инфекций:
T – токсоплазмоз (Тoxoplasmоsis)
О – другие инфекции (Оther)
R – краснуха (Rubella)
С – цитомегалия (Cytomegalia)
Н – инфекции, вызванные вирусом простого герпеса (Herpes).
В отечественной педиатрической практике наиболее часто используют термин «внутриутробные инфекции», что является синонимом термина «TОRCH-инфекции».
ВУИ – инфекционно-воспалительные заболевания плода и новорожденного. Несмотря на то, что ВУИ имеют различную этиологию, их объединяют общие эпидемиологические закономерности и сходные клинические проявления [1–3, 7–9]. ВУИ возникают в результате анте- или интранатального инфицирования плода.
ВУИ считаются одной из наиболее острых проблем современной медицины, решение которой возможно только при междисциплинарном подходе и совместной работе специалистов-медиков различных профилей (акушеры-гинекологи, инфекционисты, неонатологи, педиатры, эпидемиологи). Актуальность ВУИ обусловлена целым рядом факторов, главными среди которых являются:
– широкая распространенность потенциальных возбудителей среди всех групп населения;
– бессимптомное течение или отсутствие патогномоничных клинических симптомов;
– высокий риск развития патологии у плода или новорожденного при первичном инфицировании женщины во время беременности;
– возможность обострения латентной инфекции у иммунокомпрометированных женщин во время беременности с потенциальным риском внутриутробного заражения плода;
– существенное место ВУИ в структуре неблагоприятных исходов беременности (выкидыши, мертворождение, преждевременные роды);
– тератогенное влияние возбудителей ВУИ на эмбриогенез и ранний фетогенез, приводящее к развитию у плода врожденных пороков. Неблагоприятное влияние внутриутробного инфекционно-воспалительного процесса с поражением ЦНС, сердца, печени, почек и других органов и систем;
– высокий уровень летальности среди новорожденных и грудных детей с манифестными формами ВУИ;
– неблагоприятное воздействие ВУИ на состояние здоровья детей в последующие периоды постнатального развития, в ряде случаев приводящее к инвалидизации и снижению качества жизни в целом.
Истинная частота врожденных инфекций до настоящего времени не установлена, хотя, по данным ряда авторов, распространенность внутриутробного инфицирования в некоторых случаях может достигать 10–15%.
ВУИ во многом определяют уровень перинатальной и младенческой смертности, а также инвалидизацию выживших детей. В подавляющем большинстве случаев источником инфекции для плода является мать. Механизм передачи инфекции – вертикальный. В антенатальный период передача инфекции может происходить трансовариальным, трансплацентарным и восходящим путями, в интранатальный период – контактным, алиментарным. Ятрогенное инфицирование плода встречается крайне редко и только в тех случаях, когда нарушены правила асептики при проведении инвазивных методов пренатальной диагностики (амниоцентез, кордоцентез и др.) и лечения (введение лекарственных средств и препаратов крови через сосуды пуповины и др.) [2, 5, 8, 9].
При антенатальном инфицировании этиология ВУИ представлена, как правило, различными вирусами (цитомегаловирус, вирус краснухи, Коксаки и ЕСНО-вирусы и др.), токсоплазмой и микоплазмой. Интранатальное заражение характеризуется более широким спектром возбудителей и зависит от особенностей микробного пейзажа слизистых оболочек родовых путей матери. Наиболее часто в этот период происходит инфицирование плода такими микроорганизмами, как стрептококки группы В, различные энтеробактерии, стафилококки, герпес-вирусы, ВИЧ, микоплазмы, уреаплазмы, хламидии, грибы и др.
Помимо «классических» возбудителей TОRCH-инфекции установлено патогенное влияние на плод энтеровирусов, ВИЧ, хламидий (Chlamydia trachomatis), микоплазм (Mycoplasma hominis, Mycoplasma genitalium), уреаплазмы (Ureaplasma urealyticum), вирусов гриппа, парагриппа, аденовирусов, парвовируса B19, вирусов герпеса человека 4 и 6 типов и других микроорганизмов [1, 7–9, 11].
Фактором риска внутриутробного инфицирования плода является отягощенный соматический, акушерско-гинекологический и инфекционный анамнез. При этом риск инфицирования значительно повышается при воспалительных заболеваниях урогенитального тракта, неблагоприятном течении беременности (инфекционные заболевания, тяжелый гестоз, угроза прерывания, патологическое состояние маточно-плацентарного барьера) и патологических родах.
Прогноз при ВУИ зависит от срока гестации, в котором произошло инфицирование, особенностей возбудителя (патогенные свойства, тропность и т. д.), функционального состояния иммунной системы матери, состояния маточно-плацентарного барьера и др. Наиболее часто инфицирование плода и развитие тяжелых форм ВУИ отмечают в тех случаях, когда во время беременности женщина переносит первичную инфекцию.
Инфицирование в период эмбриогенеза приводит к самопроизвольному выкидышу или возникновению тяжелых, несовместимых с жизнью пороков развития (табл. 1). Проникновение возбудителя в организм плода в ранний фетальный период ведет к развитию инфекционно-воспалительного процесса, который характеризуют преобладание альтернативного компонента и формирование в поврежденных органах фиброзно-склеротических деформаций. Инфицирование плода в поздний фетальный период может приводить как к поражению отдельных органов и систем, так и к генерализованному воспалению (гепатит, кардит, менингоэнцефалит, хориоретинит, поражение органов кроветворения и др.) (табл. 1). При интранатальном инфицировании клиническая манифестация ВУИ в подавляющем большинстве случаев происходит в ранний неонатальный период, но может отмечаться и в последующие недели жизни.
В МКБ-10 ВУИ представлены в классе XVI «Отдельные состояния, возникающие в перинатальном периоде» в блоках Р35–Р39 «Инфекционные болезни, специфичные для перинатального периода». В зависимости от этиологии выделяют ВУИ вирусного, бактериального и паразитарного генеза (табл. 2).
Клинические проявления TОRCH-синдрома в подавляющем большинстве случаев зависят не только от этиологии, но и от сроков беременности, когда произошло инфицирование. Манифестные формы ВУИ у новорожденных имеют сходные клинические проявления. При этом очень часто дети рождаются раньше срока или с признаками задержки внутриутробного развития, гепатоспленомегалией. Нередко у детей с ВУИ отмечаются желтуха, экзантемы, дыхательные и разнообразные неврологические нарушения, геморрагические синдромы, анемия (рис. 1). При этом необходимо особо подчеркнуть крайне низкую достоверность диагноза, если используется анализ только клинических особенностей заболевания. В то же время достоверную верификацию этиологии ВУИ следует провести как можно раньше, учитывая, что в настоящее время возможно применение эффективных этиотропных лекарственных препаратов для целого ряда ВУИ (ацикловир – при врожденном герпесе, бензилпенициллин – при врожденных сифилисе и стрептококковой В инфекции, ампициллин – при врожденном листериозе, макролиды – при внутриутробных микоплазмозе, хламидиозе и уреаплазмозе, пириметамин + сульфаниламид или спирамицин – при врожденном токсоплазмозе и др.).
Лабораторная верификация этиологии TОRCH-синдрома является ключевым звеном диагностики и определяет возможность своевременного назначения специфической терапии. При этом однотипность клинических проявлений ВУИ обосновывает необходимость безотлагательного проведения лабораторной расшифровки этиологии заболевания. Для этиологической верификации врожденных инфекций используют 2 основные группы методов, условно обозначаемых как «прямые» и «непрямые».
К «прямым» лабораторным тестам относятся методы, направленные на обнаружение самого возбудителя (классические микробиологические, вирусологические), его ДНК или РНК (молекулярно-биологические) или антигенов (иммунохимические). «Непрямые» тесты – методы, позволяющие обнаружить в сыворотке крови пациента специфические антитела к антигенам возбудителя. В последние годы для этого наиболее часто используют иммуноферментный анализ (ИФА).
«Золотым стандартом» лабораторной диагностики ВУИ считается комбинация «прямых» и «непрямых» методов диагностики, что позволяет существенно повысить диагностические возможности лабораторной верификации этиологии ВУИ. При этом наиболее часто из «прямых» методов используют полимеразную цепную реакцию (ПЦР) (специфичность и чувствительность – более 90%), а из «непрямых» – ИФА (специфичность и чувствительность – более 75%) [2, 5, 8–15].
Применяя ПЦР, целесообразно использовать современные методики количественного определения ДНК или РНК инфекционных агентов, основанные на амплификации с гибридизационно-флуоресцентной детекцией продуктов анализа в режиме реального времени, а также параллельно тестировать несколько биологических сред (кровь, спинномозговая жидкость, моча, назофарингеальные мазки, эндотрахеальные аспираты и др.). Подобный подход достоверно увеличивает клиническую информативность проводимых исследований, позволяет оценить динамику развития инфекционного процесса и эффективность этиотропной терапии.
ИФА должен проводиться до введения плазмы и иммуноглобулинов. При этом диагностическое значение ИФА существенно повышается, если обследование новорожденного проводится одновременно с обследованием матери с обязательным определением индекса авидности специфических IgG. Использование «парных сывороток» для определения нарастания концентрации антител в динамике возможно только в тех случаях, если новорожденный не получал препаратов крови (плазмы, иммуноглобулинов и др.) [2, 8, 10].
Критериями верификации этиологии ВУИ является выявление у новорожденного ребенка специфических IgM и/или генома (ДНК, РНК) возбудителя. Косвенным лабораторным признаком ВУИ определенной этиологии является детекция специфических IgG c низким индексом авидности при отсутствии специфических IgM (рис. 2). Диагностическое значение низкоавидных специфических IgG существенно повышается, если при параллельном серологическом обследовании матери у нее выявляют высокоавидные специфические IgG [2, 5, 8, 10].
Таким образом, в настоящее время имеются высокочувствительные и высокоспецифичные методы лабораторной диагностики, которые позволяют быстро и с высокой степенью достоверности верифицировать этиологию заболевания, что определяет возможность раннего начала этиотропной терапии для улучшения прогноза ВУИ.
- Врожденные, перинатальные и неонатальные инфекции: пер. с англ. / под ред. А. Гриноу, Дж. Осборна, Ш. Сазерленд. М.: Медицина, 2000.
- Заплатников А.Л., Коровина Н.А., Корнева М.Ю., Чебуркин А.В. Внутриутробные инфекции: диагностика, лечение, профилактика // Лечащий врач. 2005. №8. С. 54–62.
- Учайкин В.Ф., Нисевич Н.И., Шамшева О.В. Инфекционные болезни у детей. М.: ГЭОТАР-Медиа, 2013. 688 с.
- Ивановская Т.Е., Леонова Л.В. Патологическая анатомия болезней плода и ребенка. М.: Медицина, 1989.
- Протоколы диагностики, лечения и профилактики внутриутробных инфекций у новорожденных детей Российской ассоциации перинатологов (методические рекомендации). М.: ГОУ ВУНМЦ МЗ РФ, 2001.
- Цинзерлинг В.А., Мельникова В.Ф. Перинатальные инфекции. Вопросы патогенеза, морфологической диагностики и клинико-морфологических сопоставлений. Руководство для врачей. СПб.: Элби-СПб, 2002.
- Шабалов Н.П. Неонатология. СПб., 2006.
- Дегтярев Д.Н., Заплатников А.Л. Внутриутробные инфекции. В кн: Неонатология. Национальное руководство. Краткое издание / под ред. акад. РАМН Н.Н. Володина. М.: ГЭОТАР-Медиа, 2013. С. 725–729.
- Red Book: Report of the Committee on Infectious Diseases. 29h ed. Elk Grove Village, IL: American Academy of Pediatrics, 2010. Р. 964.
- Заплатников А.Л. Специфическая иммунотерапия внутриутробной цитомегаловирусной инфекции. В кн.: Иммуноглобулины для внутривенного введения в педиатрической практике / под ред. Н.А. Коровиной, А.Л. Заплатникова. М., 2008. С. 42–58.
- Nandyal R.R. Update on group B streptococcal infections: perinatal and neonatal periods // J Perinat Neonatal Nurs. 2008. Vol. 22 (3). Р. 230–237.
- Шипулина О.Ю., Пиксасова О.В., Садова Н.В. и др. Значение молекулярно-биологических методов в диагностике листериоза беременных и новорожденных. М., 2008.
- Сафонова А.П., Пиксасова О.В., Скачкова Т.С. и др. Разработка методики выявления и количественного определения ДНК Streptococcus agalactiae на основе ПЦР в режиме реального времени: Материалы II Ежегодного Всероссийского конгресса по инфекционным болезням. М., 2010. С. 282.
- Principles and Practice of Infectious Diseases / Ed. Mandell G.L., Bennett J.E., Dolin R. Seventh Edition. New York.: Mandell, Douglas and Bennett’s, 2010. Р. 876.
- Textbook of Pediatric Infectious Diseases / Ed. J.D.Cherry, Seventh Edition, New York – London: Feigin and Cherry’s, 2009. Р. 265.
Только для зарегистрированных пользователей
источник
Внутриутробные инфекции новорожденного (TORCH-инфекции).
Диагностика, лечение и профилактика ВИЧ у новорожденных.
Классификация, этиология, патогенез, клиника, диагностика, дифференциальная диагностика, лечение, профилактика, прогноз.
Внутриутробные инфекции ( ВУИ ) — группа заболеваний, при которых заражение происходит от матери в ант е- и интранатальном периоде развития плода . В современной литературе встречается под названием TORCH — инфекция, которая означает T (toxoplasmosis), R (rubeola), C (cytomegalia), H (herpetica infectio), O (other).
A ктуальность изучения ВУИ предопределена рядом причин:
Во-первых , на протяжении последних лет наблюдается рост частоты данной патологии, что, очевидно, связано, с о дной стороны, с более информативными методами диагностики, расширением спектра исследуемых возбудителей; а с другой, с существенны м рост ом данной патологии. Это предопределено ростом инфицированности женщин детородного возраста возбудителями, которые влекут внутриутробные инфекции плода , — вирусные ( цитомегаловирусн ые, герпетичные , энтеровирусные ), хламидийные , микоплазмовые , паразитарные, грибковые, бактериальные.
Данное положение подтверждает грустная статистика: на сегодняшний день при обследовании беременных цитомегаловирус обнаруживают в 13-91 % случаев, энтеровирус Коксаки В — в 2-74 %, герпесвирус ІІ типу — в 7- 47 %, хламидии — в 25-40 %, микоплазмы — в 17-50 %, стрептококки группы В — до 35 %. Частота заражения плода при этом составляет от 5 до 70 %, в зависимости от характера возбудителя, срока беременности, напряженности гуморального и клеточного иммунитета и других факторов.
Во-вторых , ВУИ на протяжении последних лет занимают 1-3 место в структуре причин смертности новорожденных, поскольку удельный вес их составляет от 2 до 65 %, а также им принадлежит существенная роль в патогенезе многих патологических состояний.
В-третьих , затруднена диагностика ВУИ , поскольку:
инфекционный процесс у матери часто протекает безсимптомно или в легкой форме без выраженных клинических признаков; особенно это касается вирусных инфекций ( цитомегаловирусной , вирусного гепатита, герпетичной инфекции);
заболевание плода может предопределяться не только прямым действием возбудителя, но и инфекцией микста, интоксикацией, иммунологическими изменениями, нарушениями обмена веществ у матери;
данная патология в новорожденного часто скрывается под маской внутриутробной гипотрофии, асфиксии, родильной травмы.
Как правило, ВУИ диагностируются лишь после рождения ребенка. Для диагностики ВУИ имеет значение детально собранный анамнез, в частности определение срока гестации при инфицировании (периоду инфицированности). Почему именно?
Инфицирование плода на определенном этапе внутриутробного развития имеет разный патологический эффект . Различают э мбри о- и фетопатии . Для лучшего понимания стоит вспомнить, что внутриутробный период состоит из двух фаз — эмбрионного (до 9 недель) и плацентного (после 9 недель) развития. Во время фазы эмбрионного развития закладываются органы и системы, формируются внешние части тела и внутренние органы. Действие неблагоприятных факторов (инфекции) именно в этом периоде влечет развитие инфекционных э мбриопатий , которые проявляются прерыванием беременности в ранние сроки, мертворождением, формированием врожденных изъянов развития (в результате альтернативных, пролиферативних воспалительных изменений). Наиболее часто врожденные изъяны возникают под воздействием вирусов (краснухи, кори, простого герпеса, вирусного гепатита, гриппа, респираторных инфекций). Например, поражение эмбриона на 5-10 неделе внутриутробного развития вирусом краснухи вызывает дефект межжелудочковой перегородки, аномалию глаз и внутреннего уха.
Инфицирование плода в фазе плацентного развития (во время тканевой дифференциации органов плода , то есть его роста) влечет развитие фетопатий . При этом патогенные изменения непосредственно испытывают плацента и плод.
Поражение плаценты содействует развитию фетоплацентарной недостаточности (в разных отделах развиваются функциональные и морфологические изменения — дегенеративные, дистрофичные), в результате чего создаются предпосылки для хронической гипоксии плода , гипотрофии, которая приводит к снижению сопротивляемости детского организма ( плода ), развития имунодефицитного состояния. Схематически это можно изобразить так:
хроническая гипоксия плода
снижена сопротивляемость организма ,и мунодефицитное состояние.
Фетопатии проявляются преждевременными родами, рождением ребенка с очень малой массой тела (меньше 1500 г ), задержкой внутриутробного развития, множественными стигмами . Кроме того, в этом периоде формируются врожденные изъяны развития тех систем, которые не закончили своего формирования (мозг, легкие, сердце). Например, формирование мозга длится на протяжении всей беременности, потому изъяны мозга могут возникнуть в любом периоде внутриутробного развития — гидроцефалия, микроцефалия, а также поликистоз других органов.
І. При антенатальному инфицировании:
1. Аборты, выкидыши, мертворождения.
2. Изъяны развития, дисплазии внутренних органов (почки, легкие, мозг и тому подобное).
5. Персистенция возбудителя у клинически здорового ребенка.
ІІ. При интранатальном инфицировании: дисбаланс развития, функциональные и органические нарушения (энцефалопатии, ендокринопатии , хронические заболевания как в результате дисплазии органов, так и в результате персистенции микроорганизмов — хронический нефрит, пиелонефрит, пневмония и тому подобное).
Этиология ВУИ — полиетиологична , то есть возбудителями могут быть вирусы, бактерии, грибы, самые простые, хламидии, микоплазмы.
цитомегаловирус — ДНК-вирус из из группы герпетичной инфекции;
простой герпес 1-2 типов — ДНК-вирус из группы герпетичной инфекции;
ветреной оспы — ДНК-вирус из группы герпетичной инфекции (семья герпесов);
краснухи, кору, э пидпаротиту — РНК-вирус, миксовирус ;
энтеровирус — РНК-вирус из групп КОКСАКИ , ЕСНО ;
респираторные вирусы — гриппу, парагриппу, аденовирусы, РС-вирусы;
ІІ. Бактерии — листерии , трепонема, микобактерии Коха, условно патогенная флора (стрептококки В , Д, кишечная палочка, э нтеробактерии ).
ІІІ. Паразиты — токсоплазма .
По данным современной литературы, подавляющими возбудителями антенатальних ВУИ является микоплазмы и вирусы ( цитомегалия , простой герпес, энтеровирусы, грипп, РС-вирусы и тому подобное), а интранатальниы — хламидии и микробная инфекция (стрептококк группы В , листерии , условно патогенные микроорганизмы). Стоит подчеркнуть всевозрастающую роль условно патогенной микрофлоры (аэробов, анаэробов), особенно грамнегативных бактерий, облигатных анаэробов, что предопределено широким использованием антибиотиков, которые подавляют аеробну флору.
Пути проникновения — пути инфицирования:
Гематогенний ( трансплацентарний ) — при этом, как правило, поражается плацента, нарушается плацентный барьер; хотя в некоторых случаях (вирусы, бледная трепонема) возможно проникновение возбудителя через неповрежденную плаценту.
Контаминационный — происходит через инфицированные околоплодные воды:
· восходящим путем — при проникновении инфекции из влагалища, шейки матки;
· нисходящим путем — при проникновении инфекции из брюшной полости через маточные трубы;
· контактным путем — при размещении очага непосредственно в стенке матки, в плаценте.
Интранатальний — при прохождении плода через инфицированные родильные пути матери.
Около 2 % новорожденных детей инфицируются в антенатальному периоде, 10 % — во время родов ( интранатально ), или же сразу после родов.
При изучении механизмов заражения плода установлено, что гематогенный путь передачи более характерен для цитомегаловирусной и энтеровирусной инфекций, вирусов простого герпеса, ветреной оспы, гриппа, а также при листериозе , микоплазмозе, некоторых бактериальных инфекциях. Восходящий путь более свойствен для условно патогенной микрофлоры, хламидиоза , микоплазмоза, листериоза , гепатита В и других инфекций.
При прохождении плода через инфицированные родильные пути матери к появлению ВУИ приводит возбудитель как бактериальной, так и вирусной (вирус простого герпеса, цитомегаловирус ) природы.
Факторы риска ВУИ ( ант е- и интранатального происхождение):
Отягощенный акушерский анамнез — выкидыши, мертворождения, невынашивания при предыдущих беременностях, рождение детей с множественными врожденными изъянами развития или тех, которые умерли в раннем возрасте.
Патологический ход данной беременности — угроза прерывания, многоводие, гестозы , преждевременный отход околоплодных вод, преждевременное отслоение плаценты или приращение плаценты.
Заболевание мочеполовой системы — урогенитальная инфекция (кольпит, э ндоцервицит , вульвовагинит , дисбиоз генитального тракта, пиелонефрит, пиелит , инфекция мочевыводных путей, уретрит), эрозия шейки матки, кисты яйникив . Урогенитальная инфекция широко распространена среди женщин репродуктивного возраста. Да, на сегодняшний день воспалительные гинекологические заболевания бактериально-вирусной этиологии составляют около 50 %, а бактериальный вагиноз с глубокими нарушениями микроэкологии генитального тракта встречается среди беременных в 34 % случаев.
Экстрагенитальная патология беременной, ГРВИ во время беременности.
Патологический ход родов — длительный безводный период (больше 6 час ), грязные околоплодные воды, акушерская помощь при родах.
Воспалительные инфекционные процессы, повышение температуры у матери во время и после родов (э ндометрит , мастит).
Рождение ребенка с такими клиническими признаками:
а) недоношенность , задержка внутриутробного развития, гипотрофия, стигмы дизембриогенезу а изъяны развития, гидроцефалия;
б) проявления неспецифического инфекционного процесса — врожденная пневмония, фетальный гепатит, менингоэнцефалит, инфекция мочевыводных путей, повышения температуры в первые два дня, ухудшение общего состояния ребенка в первые часы жизни и тому подобное;
в) проявления специфического инфекционного процесса — врожденная краснуха, сифилис, листериоз , токсоплазмоз и тому подобное;
г) синдром дыхательных расстройств, асфиксия, потребность в интенсивной терапии и реанимационных мероприятиях, желтуха неизвестного генезиса, неврологическая симптоматика, которая дает возможность заподозрить ВУИ .
К величайшему сожалению, большинства ВУИ (перинатальной инфекции) в периоде новорожденности не имеют специфической клинической симптоматики. Признаками инфекционного процесса в новорожденного могут быть такие синдромы (синдромы фетального инфицирования):
· интоксикационный — снижение аппетита, задержка увеличения массы, гипотрофия, вялость, склерема, бледность кожи (с сероватым оттенком) и слизистых или желтуха, пурпура ;
· респираторный — одышка, тахипноэ , апноэ, цианоз носогубного треугольника, участие вспомогательной мускулатуры в акте дыхания;
· диспепсический – срыгивание, рвота, вздутие живота, частые жидкие опорожнения, пастозность передней брюшной стенки, увеличения печенки и селезенки;
· кардиоваскулярный — тахикардия, послабление тонов, расширения границ сердца, бледность, мраморность, холодные конечности, отеки, пастозность, снижение артериального давления;
· поражение нервной системы — выражена вялость, адинамия или, напротив, возбуждение, судороги, мозговой крик, набухание темечка, мускульная гипотония, гипорефлексия ;
· гематологические нарушения: анемия, тромбоцитопения, лейкопения или лейкоцитоз, повышена кровоточивость, спленомегалия.
Диагностика ВУИ основывается на :
детально собранном анамнезе (учитывая все факторы риска);
лабораторных данных, данных дополнительных методов исследования.
Одним из основных методов диагностики ВУИ есть трансабдоминальный амниоцентез с последующей идентификацией инфекционного агента в околоплодных водах. За рубежом предлагают проведения кордоцентеза с определением возбудителя или уровня специфических антител в пуповинной крови.
К непрямым методам диагностики принадлежат бактериологические и вирусологические исследования цервикального канала, уретры, влагалища, а также серологичные методы, которые определяют уровень специфических антител в крови женщины.
Большую роль в диагностике играет исследование амниотичной жидкости с определением уровня глюкозы, концентрации С-реактивного белка, соотношения количества палочкоядерных гранулоцитов и общего количества лейкоцитов и содержания гаптоглобулина , которые имеют прогностическое значение для ВУИ .
В антенатальному периоде диагностическое значение имеет ультразвуковое сканирование . Об инфицировании плода свидетельствуют такие признаки:
несоответствие размеров плода сроку беременности;
синдром задержки развития плода ;
выявление кальцификатов в печенке, почках, желудочках мозга, плаценте;
аномальное количество околоплодных вод;
нарушение структуры плаценты (варикозное расширение ее сосудов, наличие гиперехогенных включений, отек плаценты);
признаки преждевременного или запоздалого дозревания плаценты.
В случае врожденного токсоплазмоза , краснухи, цитомегалии , сифилиса, листериоза УЗД нередко обнаруживает увеличение размеров живота, асцит, водянку плода неиммунного происхождения.
Метод кардиотокографии позволяет заподозрить наличие ВУИ на основе кардиотокографичных изменений плода : у некоторых инфицированных плодов в антенатальному периоде наблюдается снижение частоты сердцебиения с монотонностью ритма, на интранатальних кардиотокограмах — выражена тахикардия (свыше 180 за 1мин).
Гистологическое исследование плаценты также обнаруживает признаки ВУИ :
· очаговая задержка дозревания ворсин;
· редукция сосудистого русла;
· сужение межворсинчатого пространства;
· полиморфно ядерная инфильтрация оболочек;
· стаз форменных элементов крови в сосудах плаценты;
В последнее время особенное значение приобретает метод определения генома возбудитееля в гистологических срезах с помощью полимеразной цепной реакции и ДНК-гибридизации.
С целью профилактики, диагностики и лечения инфекционных осложнений в плода и новорожденные в ряде стран принятл и» альтернативную» стратегию ведения беременных и рожениц , которая предусматривает полное охватывание скринингом беременных группы риска относительно ВУИ и адекватное лечение инфицированных женщин. Только в США она предотвращает рождение 3200 инфицированных детей и дает экономический эффект (66 млн. долларов).
ЦИТОМЕГАЛОВИРУСНАЯ ( ЦМВ ) ИНФЕКЦИЯ — CYTOMEGALIA.
Европейским регионарным бюро ВООЗ ЦМВ-инфекция отнесена к группе заболеваний, которые определяют будущее инфекционной патологии, так как имеет выраженный оппортунистичный характер и проявляется в условиях иммунодефицита разной этиологии. К факторам, которые определяют развитие заболевания принадлежат: 1) массивность инфицирования (в организм поступают большие дозы вируса); 2) угнетение клеточного иммунитета, причинами которого является СПИД, цитостатична я терапия, трансплантация органов и тканей; 3) низкий социально-экономический уровень; 4) вакцинация; 5) беременность. Все эти факторы, особенно их сочетание, создают условия для активации ЦМВ-инфекции (в первую очередь среди лиц из категории повышенного риска: беременные, новорожденные, реципиенты гемотрансфузий и трансплантантов органов) на фоне имуносупресивной терапии.
Наиболее опасным является инфицирование цитомегаловирусами в периоды внутриутробного развития и раннего детского возраста. Цитомегалиею заражается до 2,5 % новорожденных и 50-60 % детей грудного возраста. Установлено, что ЦМВ-инфекция в 7 раз чаще является причиной инфицирования плода , чем вирус краснухи.
Это одно из распространенных заболеваний, которое встречается с такой же частотой, как и вирусный гепатит В. Известно, что 50 % женщин детородного возраста инфицированные вирусами цитомегалии ; в 10-30 % беременных шейка матки поражена цитомегаловирусами . Однако у беременных данная патология протекает безсимптомно , а потому истинная частота ЦМВ-инфекции на сегодняшний день неизвестна.
Цитомегаловирус — ДНК-вирус герпетичной природы имеет ряд особенностей:
1) чрезвычайно большая ДНК;
2) возможность репликации вируса без повреждения клетки;
3) медленная репликация вируса;
4) вызывает резкое снижение клеточного иммунитета (уменьшается соотношение Тх /Т с);
5) экскреция вируса сохраняется на протяжении 2-8-ми лет.
Источником является мать (носитель, или больная), в частности, биологические жидкости и выделения (кровь, слюна, моча, грудное молоко, влагалищный секрет).
Инфицирование : трансплацентарным путем, при прохождении через родильные пути (колонизация шейки матки), при кормлении грудным молоком, при гемотрансфузиях. Без сомнения, характерной является передача ЦМВ-инфекции через слюну во время поцелуев («болезнь поцелуев»).
Характер поражения плода зависит от периода инфицирования. При инфицировании (заражении) на ранних этапах внутриутробного развития возможные — гибель плода , самовольный выкидыш, врожденные изъяны развития. Инфицирование в поздние сроки беременности предопределяет рождение плода с признаками заболевания. Врождена цитомегалия носит генерализований характер и характеризуется множественными поражениями разных органов и систем.
Классическая форма ЦМВ-инфекции проявляется недоношенностью , врожденной гипотрофией, гепатоспленомегалией, желтухой, которая предопределена поражением печеночных клеток, — ( паренхиматозной ), а также холестазом ; начинается с первых дней, однако интенсивность постепенно растет до 2-х недель, достигает максимума на 3-4 недели и постепенно уменьшается, хотя может сохраняться до 3-6 месяцев; поражением нервной системы, которая проявляется синдромами притеснения или судорожным, гидроцефальним , а также развитием ЦМВ менингоэнцефалита, для которого характерное образование некрозов вокруг боковых желудочков, кальцификатов и кист, что свидетельствует о давности процесса, с развитием микро- или гидроцефалии, отставанием в психомоторном развитии; поражением органов дыхания — с развитием интерстициальной пневмонии (выражена одышка, цианоз, кашель с незначительными физикальными изменениями), бронхита, перибронхита ; поражением слюнных желез, глаз ( хориоретинит , увеит , кератоконьюнктивит ), внутреннего уха (снижение слуха); поражением почек (протеинурия, лейкоцитурия, в осадке — цитомегаловирусные клетки), геморрагическим синдромом (анемия, тромбоцитопения, петехии , мелена). Очень часто характерной является тетрада:
3. геморрагический синдром (тромбоцитопения);
4. тяжелая форма поражения нервной системы.
Особенности поражения органов и систем при ЦМВ-инфекции:
поражение нервной системы — в виде грубых органических нарушений (гидро-микроцефалия; судороги, общие изменения — энцефалит, менингоэнцефалит, множественные стигмы дизембриогенеза );
поражение органов дыхания — интерстициальная пневмония, которая часто совмещается с инфекцией микста в виде гнойно-деструктивных процессов, ателектазов, бронхиальной обструкции;
поражение органов пищеварения — печенки, кишечника , поджелудочной, слюнных желез, что часто совмещается с врожденными изъянами развития;
поражения органов мочеотделения — мочевыводящих путей и интерстицию почки, которые часто совмещаются с врожденными изъянами развития (аномалии мочевыводной системы);
выражен токсикоз без температурной реакции.
Дополнительные методы исследования.
Лабораторная диагностика основывается на разных методах выявления ЦМВ-инфекции ее антигенов и специфических антител .
Методы лабораторной диагностики ЦМВ-инфекции
Выявление ЦМВ-инфекции (гигантские клетки с крупным ядром — «совиные глаза»)
Слюна, моча, ликвор, зараженныеы ткани, органы
Выделение ЦМВ-инфекции на чувствительных культурах клеток или чувствительных лабораторных животных
Кровь, зараженные ткани-ни , экскреты
Микроскопический (імуно-флюоресцентный, имуноелектронна микроскопия)
Выявление вирусных антигенов и антител
Сыворотка крови и другие биологические жидкости
Иммунологический метод (имуноферментний (ИФА), радиоиммунный (РИА))
Выявление антител к ЦМВ-инфекции антигенов
Сыворотка крови и другие биологические жидкости
Сыворотка крови, заражены ткани, екскрети
Цепная полимеразна реакция
Кровь, зараженные ткани, экскреты
Гигантские клетки с ядром — «совиные глаза» при цитомегаловирусной инфекции
Для лечения ЦМВ-инфекции предлагают использовать специфические противовирусные препараты и патогенетические средства иммунотерапии. Противовирусные препараты широко применяются в лечении герпетичних заболеваний, однако в лечении ЦМВ-инфекции полностью себя не оправдали. Неэффективность лечебного действия видарабину , виразола , ацикловира предопределена отсутствием определенного гена в ЦМВ-инфекции, который детерминирует синтез клеточной тимидинкиназы , что существенно отличает ее от других герпетичних вирусов. Позитивный эффект наблюдается при использовании ганцикловира , цитотекта .
Цитотект (специфический антицитомегаловирусный иммуноглобулин) — по 2 мл/кг каждых два дня или 4 мл/кг каждых 4 дня внутривенно, к уменьшению клинических симптомов. Применяют поливалентные иммуноглобулины: пентаглобин , сандоглобин , интерглобин — для внутривенного введения.
Ганцикловир ( цимевен ) — препарат, который ингибирует репликацию вируса, подавляя ДНК-ПОЛИМЕРАЗУ . Назначается в дозе 5 мг/кг внутривенно венно на протяжении 14-21 дня с последующим переходом на пероральное употребление (5 мг/кг/ сутки) . Фоскарнет ( фоскавир ) 60мг/кг 3 раза в день внутривенно на протяжении 14-21 дня.
В основном лечение ЦМВ-инфекции патогенетическое. Учитывая существенное угнетение Т-клеточного звена иммунитета при ЦМВ-инфекции, можно утверждать, что иммунокорректирующая и иммуностимулирующая терапия имеет важное значение. В связи с этим, оправдано назначение препаратов группы интерферона, которые способствуют активации иммунных и неспецифических механизмов защиты, обладают противовирусной, имуномодулирующей , противовоспалительной активностью: Лаферон ( интрон А , роферон , реальдерон ) 50-70-100тыс. МО/кг в сутки, внутримышечно на протяжении 7-10 дней. Циклоферон — из расчета 6-10 мг/кг массы внутривенно или внутримышечно. Надлежащая роль отводится питанию и уходу за больными. Стоит помнить, что выкармливать грудным молоком младенцев, рожденных от матерей с цитомегаловирусной инфекцией, запрещается, поскольку риск заражения при этом — 58 %.
В связи с трудностями, которые появляются при лечении ЦМВ-инфекции, возникает потребность в мероприятиях профилактики. Женщинам с отягощенным акушерским анамнезом и верифицированной ЦМВ-инфекцией назначают лечение. В случае рождения больного ребенка следующая беременность рекомендуется не раньше, чем через 2 года после проведенного лечения. Специфическая профилактика связана с созданием цитомегаличных вакцин, целесообразность использования которых вполне обоснована.
Схема лечения ЦМВ-инфекции во время беременности
После 12 недель беременности
5мл 2 раза в неделю 14 дней 4мл/кг массы 1 раз в 14 дне й( всего — 3 курса)
Нормальный человеческий иммуноглобулин
По 3 мл внутримышечно №5 каждые 3 дня или по 25 мл внутривенно капельно по 200 мл физ. раствора 3 раза в неделю (3 курса)
2 свечи на время per rectum
После 12 недель беременности
Курсы метаболической терапии:
После 12 недель беременности
Внутривенное введение физ. раствора с концентрацией озона 1,5-2,0 мг/л
После 12 недель беременности
ГЕРПЕТИЧНАЯ ИНФЕКЦИЯ — INFECTIO HERPETICA
Тяжелое заболевание с поражением детей в перинатальном периоде, которое вызывается вирусом простого герпеса, ДНК-вирусом, вирусом герпетичной природы. Различают 2 типа вируса простого герпеса ( ВПГ ): HSV-1 — оролабиальный , HSV-2 — генитальный. Однако в настоящее время исследованиями доказано, что абсолютного соотношения между типом вируса и локализацией инфекции нет. Особенностями этих вирусов является персистенция в ЦНС , поддержка латентной инфекции.
При врожденной герпетичной инфекции наблюдаются высокая летальность у новорожденных (до 90 % больных с генерализованой формой при отсутствии адекватной терапии) и тяжелые психоневрологические последствия у 50 % детей, которые выжили. Установлено, что у младенцев, которые родились через инфицированные родильные пути, риск заражения этой болезнью составляет 40-60 %, а риск смерти или развития серьезных неврологических последствий среди инфицированных — 50 %.
Клиника неонатальной герпетичной инфекции в 80-90 % случаев вызывается HSV-2. ВПГ — распространены возбудители инфекции женских половых органов. Да, носительство генитального герпеса регистрируется у 46 % женщин.
Инфицирование происходит 1) контаминационно — через восходящий путь (после разрыва плодных оболочек — критический период, который длится 4-6 года ), а также при прохождении через родильные пути (в 85 % случаев) — интранатально (инфицирована шейка матки, вагина ); 2) трансплацентарно — при вирусемии у матери. Установлено, что вирусемия во время беременности приводит к 30 % спонтанных абортов в раннем периоде, больше 50 % поздних выкидышей; при заражении на 20-34-й неделе беременности в 30 % случаев возникают преждевременные роды. По своей тератогеннистостю в ирус простого герпеса уступает лишь вирусу краснухи, а также способствует формированию привычного невынашивания.
Клинически заболевание проявляется в виде генерализованой (летальность без лечения составляет 90 %) и локализованной форм — с подавляющим поражением центральной нервной системы (летальность без лечения составляет 50 %), кожи и слизистых (летальность без лечения составляет 18 %).
Локализованная форма инфекции с подавляющим поражением нервной системы в виде энцефалита проявляется на 1-4 недели жизни синдромом угнетения (летаргия, вялость, ступор) развитием коматозного состояния или гипервозбудимостью (мозговой крик, беспокойство, гиперестезия , тремор) судорогами, изменениями в спинномозговой жидкости. При э хоенцефалографии характерными являются такие морфологические изменения: 1) отек и набухание головного мозга, клеточная инфильтрация; 2) снижение мозгового кровотока, инфильтрат, некроз участков мозга; 3) кисты, кальцификаты в лобной и височных долях, вентрикуломегалия ; 4) атрофические, рубцы изменения, глиоз , поренцефаличные кисты. Тяжелые поражения нервной системы предопределяют неблагоприятные последствия — дефекты в психомоторном развитии, ДЦП , парезы, эпилепсию. Часто поражение нервной системы совмещается с поражением кожи (тип везикулярный , эритематозно-пятнастые высыпания), поражением слизистых рта ( афтозный стоматит ) или глаз (конъюнктивит, кератоконъюнктивит , хориоретинит , катаракта, атрофия зрительного нерва).
Генерализованная форма проявляется на 1-2 недели жизни картиной септического процесса с развитием ДВЗ-синдрома, типичным поражением нервной системы, кожи, слизистых оболочек (рта, глаз), желтухой, гепатоспленомегалией, дыхательными расстройствами с развитием пневмонии, геморрагическим синдромом, выраженным интоксикационным синдромом.
Дополнительные методы исследования:
Вирусологическое исследование — выделение вируса из элементов высыпаний, мазков из слизистых, спинномозговой жидкости, шейки матки.
Метод имуноферментного анализа (метод ELISA) обнаруживает специфические антитела, которые относятся к классам Ig M, Ig G.
Выявление специфических антигенов (метод цепной полимеразной реакции, ДНК-гибридизация).
Гистологическое исследование плаценты обнаруживает большие клетки с гиперхромными ядрами и базофильними включениями, участки фибриноидного некроза. Такая трансформация наблюдается в хориальной пластинке, амнионе, экстраплацентных оболочках. ВПГ 2 типа, как правило, локализуется в амнионе, децидуальной оболочке, которая свидетельствует о восходящем пути инфицирования; ВПГ 1 типа — в базальной пластинке и ворсинчатому хориони , что доказывает гематогенный путь распространения инфекции.
В лечении врожденной герпетичной инфекции заметный успех достигнут за счет использования внутривенных препаратов иммуноглобулинов. Чем раньше начато лечение, тем более шансов на радикальное выздоровление, хотя все же остается большой процент осложнений.
Ацикловир ( зовиракс , виралекс , вальтрекс ) ингибирует репликацию вируса, назначается в дозе 30-40 мг/кг в сутки в 3 приема внутривенно на протяжении 2-3 недель.
Видарабин ( цитостатик, подавляет размножение вируса) — 15-30 мг/кг на время довенно капельно в 2 приема на протяжении 10-14 дней.
При наличии у беременной первичной инфекции или ее рецидива целесообразно родоразрешения осуществлять путем кесарева сечения (к разрыву плодотворных оболочек). Альтернативным является назначение специфического лечения.
Схема лечения герпетичной инфекции во время беременности
Нормальный человеческий иммуноглобулин
По 3 мл внутримышечно №5 каждые 3 дня или по 25 мл внутривенно капельно по 200 мл физ. раствора 3 раза в неделю (3 курса)
После 12 недель беременности
2 свечи на время per rectum, 5 дней
После 12 недель беременности
Курсы метаболической терапии:
После 12 недель беременности
Внутривенное введение физ. раствора с концентрацией озона 1,5-2,0 мг/л
После 12 недель беременности
Вирусная инфекция, способная вызывать хроническую внутриутробную инфекцию, изъяны развития плода . Возбудителем является РНК-вирус из группы миксовирусов . Стоит отметить, что чем раньше заболела женщина (в ранние сроки беременности), тем большая вероятность инфицирования и частота патологий развития плода . Да, инфицирование на 1-8 неделе беременности предопределяет развитие патологий в 85 % случаев, инфицирование на 9-12 неделе — формирование патологий в 34 % случаев, до 24 недель — в 20 %, до 28-36 недель — в 12 %. Инфицирование плода вызывают самовольные выкидыши, мертворождения, множественные врожденные патологии развития, инфекционные заболевания с поражением многих органов и систем.
Путь передачи — трансплацентарный .
В 1942 году австралийский офтальмолог Norman Gregg выделил триаду, характерную для врожденной краснухи:
· Поражение глаз — катаракта, микроофтальмия, глаукома, хориоретини т.
· Поражение сердца (патологии) — дефект межжелудочковой перегородки, открыт артериальный проток, стеноз аорты, стеноз легочной артерии.
· Поражения уха как органа слуха — глухота.
В клинике врожденной краснухи не наблюдается лихорадки, симптомов интоксикации. Характерными является:
· малая масса при рождении (меньше 1200), недоношенность , задержка внутриутробного развития;
· поражение кожи — элементы высыпаний темно синюшного цвета, полиморфные, диаметром 1- 3 мм , густо локализуются на лице, сохраняются на протяжении 2-3 месяцев. Могут возникать изменения дерматоглифики — нарушения линий ладони, от печатков пальцев;
· поражение опорно-двигательного аппарата — изменение костей черепа, трубчатых костей (латеральная ротация стоп, голеней); рентгенологически: повышена прозрачность костной ткани;
· поражение сердца — дефект межжелудочковой перегородки, открыт артериальный проток, стеноз аорты, стеноз легочной артерии;
· поражение нервной системы — развитие энцефалита, который проявляется изменением синдрома угнетения на возбуждение, судорогами, запрокидыванием головки назад, опистотонусом , белково-клеточной диссоциацией в ликворе . Дальше развиваются ДЦП , задержка психо-моторного развития;
· поражение глаз — пигментная ретинопатия, в виде участков черной пигментации и депигментации, которая напоминает «соль с перцем»;
· поражение органа слуха — глухота;
· изменения со стороны крови — анемия, тромбоцитопения.
Дополнительные методы исследования:
· вирусологическое исследование — выделение вируса на протяжении первых 3 мес. до 1,5 года;
· метод имуноферментного анализа (метод ELISA) — обнаруживают специфические антитела, которые относятся к классу Ig M, Ig G;
· выявление специфических антигенов (метод цепной полимеразной реакции, ДНК-гибридизация).
Лечение направлено на повышение неспецифических иммунологических факторов защиты, специфической, — нет.
Большое значение имеет вакцинация детей, особенно девочек. Как следствие несвоевременного внедрения в клиническую практику обязательной вакцинации, врожденная краснуха повлекла 30 % всех ВУИ . Вакцинация в 12 мес. комбинированной вакциной. Ревакцинация моновакциной (девочки) в 14-15 лет.
ЛИСТЕРИОЗ ( гранулематоз новорожденного)
LISTERIOSIS (Granulomatosis neonatorum) — заболевание, возбудителем которого является Listeria monocytogenesis. Граммположительная палочка, которая является частой причиной выкидышей, мертворождения, преждевременных родов.
Источником болезни является мать (больная, носитель). Беременная заражается при контакте с домашними животными, птицами (коровы, козы, овцы, свиньи, куры, утки, собаки, коты), при уходе за ними, при укусе, при употреблении сырых инфицированных продуктов (яиц, молока).
Листериоз протекает у беременной безсимптомно или в виде повышения температуры, озноба, боли в поясничном участке, иногда проноса, явлений пиелита .
Плод инфицируется трансплацентарно . Возбудитель через пораженную плаценту попадает в пупочную вену, вызывает у плода генерализовану форму инфекции, в результате чего дети рождаются недоношенными , с малой массой, больные. Околоплодные воды при этом грязные, зеленые.
Врожденный листериоз протекает тяжело, с высокой летальностью (до 70-80 %) у доношенных, особенно в первые дни жизни, и практически всегда приводит к летальному исходу у недоношенных . Перинатальная смертность в Европе, предопределенная листериозом , составляет 1-7 %.
Клиника : проявляется в виде сепсиса гранулематозного, поскольку сопровождается образованием специфических гранулем во многих органах. На первый план выступают симптомы интоксикации, расстройства дыхания и кровообращения. У ребенка повышается температура до 38-39 С , появляется тахипноэ , диспноэ, нападения апноэ, которые тяжело купируются, цианоз кожных покровов; рентгенологически — множественные, густо размещенные инфильтративные тени, которые напоминают картину милиарного туберкулеза.
Гранулема в головном мозге при листериозии .
На коже туловища, конечностей наблюдают папулезно-петехиальные высыпания, узелковые екзантемы . Кожные покровы бледны с землистым оттенком, иногда иктеричны . На миндалинах , задней стенке глотки , конъюнктиве развиваются инфекционные гранулемы , мелкие узелки, диаметром 1- 3 мм К этим изменениям присоединяются признаки ринита, конъюнктивита.
Поражение нервной системы проявляется в виде гнойного менингита, менингоэнцефалита (с повышением температуры тела, судорогами, опистотонусом ). Как правило, наблюдается увеличение печенки, селезенки, рвота, пронос.
Признаки вентрикулита и отека головного мозга при при листерио зии
Признаки листериозног о менингита с признаками вентикуломегал ии
• в анамнезе — контакт с домашними животными; во время беременности — повышение температуры тела, озноб, явления пиелит а; самовольные выкидыши, мертворождения, недоноше нные дети;
• околоплодные воды — грязные;
• в клинике у ребенка — повышение температуры тела, расстройства дыхания, судороги, высыпания на коже, слизистых;
• специфические методы исследования:
• бактериологическое исследование околоплодных вод, плаценты, мекония, слизи из носа, зева, спинномозговой жидкости, крови;
• гистологическое исследование плаценты: в терминальных ворсинах наблюдаются отеки и воспалительный инфильтрат, а также дистрофичные и некробиотичные изменения трофоблас та и мелкоочаговые некрозы во внутренних органах;
• серологичн е исследование — метод парных сывороток (диагностическое значение имеет увеличение титра антител в 4 раза и больше).
Лечение листериоз а проводится по принципам генерализован ой формы инфекции. Наиболее эффективной является комбинация ампициллина в дозе 200 мк/кг в сутки и гентамиц ина (5-7 мг/кг/сутки) на протяжении 10-14 дней. Можно применять макролид ы: азитром ици н( сумамед) из расчета 10мг/кг массы в сутки в 2 прие ма, кларитро ми цин ( клацид) 15мг/кг массы в сутки в 2 пр иема, джо за мицин (ви льпрофен) 30-50 мг/кг на сутки в 3 приема, макропен 30-50мг/кг в сутки. Анти биотики цефалосп оринового ряда не эффективны.
ВРОЖДЕН НЫЙ СИФИЛИС — SIPHILIS CONGENITA
Венерическое заболевание, возбудителем которого является Treponema pallidum.
Эпидемия сифилиса, которая продолжается в Украине, значительное увеличение числа случаев латентного сифилиса, роста наркомании является предпосылкой для распространения врожденного сифилиса.
Аксиомой является то, что плод заражается только от больной матери. Инфицирование происходит
трансплацентарно или во время родов — при прохождении через инфицированные родильные пути.
Возможны последствия беременности в зависимости от срока инфицирования матери:
· · Женщина заразилась в канун беременности или на протяжении первых месяцев — частые спонтанные аборты.
· Заражение состоялось на 4-5 месяце беременности — преждевременные роды мертвого плода (мацерированного).
· Инфицирование на 6-7 мес. беременности — рождение ребенка с активными проявлениями сифилиса.
· Заражение в последние месяцы беременности, в канун родов — признаков инфицирования у ребенка может еще не быть, но при прохождении через родильные пути — инфицируется и развивается приобретенный сифилис.
Клинические признаки врожденного сифилиса наблюдаются уже с момента рождения или же появляются на первом месяце жизни. Клиническая картина характеризуется появлением:
· Сифилитической пузырчатки, которая появляется в первые дни, недели жизни в виде волдырьков, диаметром 1- 3 мм , заполненных серозным, геморрагическим содержанием, на инфильтрованной основе; локализуется на ладонях, подошвах, редко на туловище, лице.
· Диффузного уплотнения кожи (инфильтрация Гохзингера) на ладонях, подошвах, лице (вокруг рта, губ, подбородка, лба), ягодицах, половых органах.
· Сифилитического ринита (наиболее ранний признак). Сначала возникает затрудненное носовое дыхание, дальше слизистые, слизисто гнойные, «сукровичные» выделения. При распространении процесса на носовую перегородку возникает деформация носа (седловидный нос), на гортань — афония, охрипший голос.
· Гепатоспленомегалии (патогномонический синдром) — печенка, селезенка увеличенные , плотные.
· Сифилитического хориоретинита — на глазном дне участка пигментации, депигментации, «симптом соли и перца».
· Костных нарушений — сифилитический остеохондрит , периостит с развитием спонтанных переломов, псевдопараличей, остеомиелита .
· У 25-30 % больных — серозного менингита.
· Гематологических нарушений — анемия, тромбоцитопения, моноцитоз.
Типичной триадой сифилиса является:
1. сифилитическая пузырчатка с уплотнением тканей;
Общими симптомами врожденного сифилиса является малая масса при рождении, бледность кожи с сероватым оттенком, морщинистость со многими складками, старческий вид ребенка, часто беспокойство, коряги, дистрофизация .
Дополнительные методы исследования:
· микроскопия в темном поле зрения — выделение возбудителя из везикул, выделений из носа, ликвора ;
· серологичное исследование ребенка, матери ( РВ , РИФ , РИТ );
· гистологическое исследование плаценты: наблюдают нарушение формы и величины ворсин (увеличенные в размерах, колбоподобные формы), с явлениями фиброзование и облитерации сосудов, пролиферации э ндотелиоцитов . Периваскулярно отмечают лимфоцитарный инфильтрат, а также дистрофичные изменения трофобласта с образованием сифилом ;
· рентгенологическое исследование костной системы, исследования глазного дна;
· трепонемы и нетрепонемы ( реагиновые ) тесты.
Лечение проводится пеницилином в дозе 200 жал . / к г на сутки в 6 приемов на протяжении 28 дней.
С целью профилактики врожденного сифилиса внедрены трехкратные обязательные серологические исследования крови беременных. Последнее исследование необходимо проводить не позже 36 недель беременности. При выявлении сифилиса у беременной, назначается лечение согласно с действующими инструкциями.
Известно, что 20-30 % женщин детородного возраста инфицированы токсоплазмами – внутриклеточными паразитами, которые относятся к самым простым. Токсоплазмоз — антропозоонозное заболевание, которое в детской патологии занимает значительное место. Врожденный токсоплазмоз встречается у новорожденных с частотой 1:1000 живорожденных.
Токсоплазмы имеют 2 цикла развития: половой, бесполый. Половой происходит в кишечнике животных семьи кошачьих с выделением во внешнюю среду ооцист . Бесполый — в организме разных животных, птиц, человека с образованием псевдоцист, настоящих цист, которые со временем превращаются на кальцинаты .
Цикл развития токсоплазмы
· алиментарный — через инфицированные продукты — мясо, молоко, овощи, фрукты, грязные руки, предметы быта;
· контактный — проникновение возбудителя через поврежденную кожу (царапины кошки, микротравмы).
У беременных заболевание протекает бессимптомно или в виде неспецифических признаков: быстрая усталость, кратковременный субфебрилитет, миалгия, лимфаденопатия .
Инфицирование плода — гематогенно . Чем раньше состоялось инфицирование, тем более тяжелые последствия. Так, при инфицировании плода в И триместре беременности возможно мертворождение. При инфицировании в ІІІ триместре, ребенок рождается с признаками генерализованной формы инфекции — токсоплазмоза .
Инфицирование в первые 8 недель беременности (резидуальная стадия)
Смерть плода с ранним прерыванием беременности или патологии развития несовместимы с жизнью.
Инфицирование в 9-28 неделю беременности (хроническая форма токсоплазмоза)
Инфицирование в 9-28 неделю беременности (хроническая форма токсоплазмоза) Ребенок рождается с остаточными явлениями перенесенного внутриутробного менингоэнцефалита с задержкой формирования головного мозга, развитием гидроцефалии, поражением глаз. Характерная триада: 1) гидроцефалия, судороги 2) кальцинаты головного мозга 3) хориоретинит Возможна микроцефалия с внутренней гидроцефалией, спастические парезы, параличи
Инфицирование в 29 недель — до родов (подострая форма токсоплазмоза)
Патоморфологический: в головном мозге есть участки некроза разной локализации и давности процесса, участка звапнення и производительного воспаления, в процесс втягиваются мозговые оболочки .У ребенка картина менингоэнцефалита: беспокойство, возбуждение, блевота, вялость, сонливость; парезы, параличи, судороги, нарушения мъязевого тонуса, нарастает гидроцефалия. Поражение глаз в виде хориоретиниту, атрофии зрительного нерва, увеит, катаракта .П ри исследовании спинномозговой жидкости — высокий белок, цитоз за счет лимфоцитов.
Инфицирование перед родами (острая генерализована форма)
Протекает в виде острого инфекционного процесса с поражением всех органов и систем. Клиническая картина сепсиса — поражение печенки, почек, кишечника, развитие пневмонии, миокардита, геморрагического синдрома
Генерализована форма токсоплазмоза характеризуется:
· интоксикацией — повышение температуры, лихорадка, рвота;
· гепатоспленомегалией с желтухой;
· высыпаниями на коже в виде розеол , пятен, макулезно-папулезных элементов;
· изменениями в ликворе — спинномозговая жидкость ксантохромна , увеличено количество белка, незначительный плеоцитоз (белково-клеточная диссоциация);
· развитие пневмонии, миокардита, нефрита и тому подобное;
· гематологическими нарушениями: анемия, тромбоцитопения.
В отдельных случаях врожденный токсоплазмоз может сказаться через несколько лет после рождения олигофренией, еписиндромом , хориоретинитом .
Магнито-резонансная томография головного мозга
Прогрессирующая гидроцефалия при токсоплазмозы
Дополнительные методы исследования:
· выделение возбудителя из ликвора , крови, плаценты, тканей мозга;
· метод имуноферментного анализа (метод ELISA) — обнаруживают специфические антитела;
· реакция из метиленовым синим (Сейбина-фельдмана) — выявление специфического Ig G;
· кожная проба с токсоплазмином (если диаметр больше 10 мм — реакции «+»);
· гистологическое исследование плаценты: наблюдаются отек терминальных ворс, вилуизиты . Для последних характерным является круглоклитинный инфильтрат, который содержит плазматические клетки. Отмечают также дистрофичные изменения трофобласта и выражены сосудистые расстройства. Реже в плаценте находят кальценированные цисты или некротические очаги с паразитами, которые могут проникать в капилляры терминальных ворс.
· рентгенография черепа, нейросонография , консультация окулиста, невролога.
· Лечение . Считают, что лечение матери уменьшает тяжесть заболевания плода , снижает вероятность его инфицирования. Однако, к сожалению, в большинстве случаев об инфекции у матери не подозревают. Этиотропное лечение проводят при остром и подостром врожденном токсоплазмозе , а также при хроническом — во время заострения процесса. При носительстве токсоплазмоза дети до 10 лет от роду подлежат диспансерному присмотру, особенно при неблагоприятной экологической ситуации.
Специфическое лечение заключается в назначении:
· Сульфадимезин ( сульфадиазин ) в дозе 50-100 мг/кг в сутки в 2 приема + Хлоридин ( пириметамин , дараприм , тиндурин ) из расчета 2 мг/кг в сутки первые 2 дня, дальше 1 мг/кг в сутки на протяжении 6-ти месяцев и на протяжении 12-ти месяцев 3 раза в неделю. По другой схеме — комбинация хлоридин+сульфадимезин в соответствующих дозах назначается на 4-6 неделю, на протяжении одного года — 4 раза. В промежутках назначают 1-1,5-месячный курс спирамицина . Новый препарат — фансидар ( пириметамин 25мг+сульфадоксим 500мг) из расчета 1-1,5мг/кг разовая доза 1 раз в неделю на протяжении 6-8 месяцев .Р ядом с препаратами этой группы назначают фоллиевую кислоту по 5мг.
· Спирамицин (ровамицин) — антибиотик-макролид — 100 мг/кг в сутки в 2 приема на протяжении 1-1,5 мес. (всего 4 курса в год).
· Глюкокортикоиды (преднизолон) — при выраженной воспалительной реакции из расчета 1,5-2 мг/кг в сутки с постепенным снижением дозы при стихании воспалительного процесса.
І вариант (явный врожденный токсоплазмоз)
Хлоридин+сульфадимезин+фолиевая кислота; 4 курса в год (по 4-6 недель), между курсами спирамицин (1-1,5 мес )
6 месяцев хлоридин+сульфадимезин+фолиевая кислота; дальше до года дежурства с спирамицином (по 1 мес.)
Субклинический врожденный токсоплазмоз, доказанный иммунологически
6 нед. хлоридин + сульфадимезин + фоллиевая кислота; потом 6 нед. спирамицин. Дальше те же курсы до года
Здоровые дети от матерей с доказанным активным приобретенным токсоплазмозом во время беременности
4 нед. хлоридин + сульфвдимезин + фоллиевая кислота, дальше курс спирамицина
Здоровые дети с (+) результатами иммунологического обследования на токсоплазмоз
Спирамицин 1 мес., потом курс хлоридина + сульфадимезина + фоллиевая кислота
Профилактика токсоплазмоза начинается с обследования женщин детородного возраста при планировании семьи или при первичном обращении беременных в женские консультации. Всем женщинам дважды определяют наличие комплементзвязывающих антител с токсоплазмовым антигеном. При выявлении токсоплазмовой инфекции в первой половине беременности назначают спирамицин (2г/сутки в 2 приема) на протяжении 1 месяца. Такое лечение снижает перинатальную смертность и частоту ВУИ на 50 %. Во второй половине беременности назначают комплекс хлоридина (25 мг/сутки)+сульфадимезина (4г/сутки в 2 приема) на 3-4 недели.
Стоит обратить особенное внимание на роль кошачьих как источника токсоплазмоза и сырых мясных продуктов как факторов передачи токсоплазмоза .
ХЛАМИДИЙНАЯ ИНФЕКЦИЯ – CHLAMYDIASIS
В последнее время успехи микробиологии и иммунологии позволили более детально расшифровать этиологическую структуру ВУИ . Так, обнаружено значительное распространение паразитарных инфекций у новорожденных, прежде всего хламидийной . Это, в свою очередь, связано с ростом хламидиоза среди женщин детородного возраста. По данным разных авторов, частота обнаруженной патологии у беременных колеблется от 10 % до 40 %, в зависимости от контингента обследуемых и использованных диагностических методов. При этом , вероятность инфицирования ребенка хламидийной инфекцией составляет 40-70 %. У новорожденных, соответственно, может проявляться разными клиническими формами — от стертых, бессимптомных до тяжелых, генерализованных , с подавляющим поражением органов дыхания. Установлено, что у 35 % — 50 % инфицированных детей развиваются конъюнктивиты; у 15 % — назофарингиты; у 10 % — 40 % — бронхиты, пневмонии; у 5 % — гастроэнтериты; у 15 % — вульвити , уретриты. Описаны хламидийные менингиты, миокардиты
Реактивные артриты, хронические фарингиты. Однако , диагноз хламидийной инфекции не всегда устанавливается своевременно, что предопределяет неадекватную терапию и формирование персистующей или латентной инфекции, развитие вторичного иммунодефицита, аутоимунных заболеваний. Все это указывает на необходимость своевременного выявления и э тиотропного лечения данной инфекции у новорожденного.
Хламидии занимают промежуточное место между бактериями и вирусами, является облигатными внутриклеточными паразитами, то есть размножаются только внутри клетки, а потому их присутствие в клинических анализах всегда расценивается как наличие инфекционного процесса.
На сегодняшний день известны 3 вида хламидий: Chlamidia trachomatis, Chlamidia pneumoniae, Chlamidia psittaci. Именно Chlamidia trachomatis передается половым путем и вызывает заболевание урогенитального, желудочно-кишечного тракта, дыхательных путей, нервной системы, глаз и тому подобное.
Хламидийна урогенитальная инфекция, как правило, протекает бессимптомно . При заражении во время беременности могут появиться слизисто гнойные выделения из канала шейки матки, признака кольпита, незначительные дизуричные явления. Данная симптоматика является всегда подозрительной относительно хламидийной инфекции в случае присоединения осложнений беременности: угрозы прерывания, позднего токсикоза, многоводья, преждевременного отслоения плаценты, преждевременных родов.
Хламидии будут поражать плаценту, оболочки, предопределяют образование патогенных иммунных комплексов, в результате чего возникает плацентная недостаточность, задержка внутриутробного развития, гипотрофия плода .
Инфицирование плода происходит ант е- или интранатально (при прохождении через родильные пути), что зависит от локализации и выраженности хламидийного процесса. Возбудитель попадает на слизистые оболочки конъюнктиви, вульвы , уретры, а также верхних дыхательных путей, желудочно-кишечного тракта при заглатывании и/или аспирации инфицированных околоплодных вод.
Острый ход внутриутробной хламидийной инфекции имеет такие клинические формы:
· генерализованная инфекция с поражением легких, сердца, желудочно-кишечного тракта, печенки и тому подобное; заканчивается, как правило, смертью ребенка в первые часы, дни жизни после рождения;
· менингоэнцефалит с повторными нападениями клонико-тонических судорог, апноэ;
· синдром дыхательных расстройств;
Симптомы поражения ЦНС — ранние признаки заболевания. Ребенок беспокоен, возбужден, наблюдают нарушение сна, мускульного тонуса, угнетение физиологичных рефлексов, тремор конечностей. Длительно сохраняется локальный цианоз, «мраморность» кожных покровов. Конечности холодны, тепло не удерживает. Впоследствии, несмотря на проведенное лечение, нарастает неврологическая симптоматика, функциональные нарушения приобретают стойкий характер.
Поражение сердечно-сосудистой системы свидетельствует о нарушении гемодинамики в легких. Симптомы появляются рано (на 3-4 день жизни) в виде послабления сердечных тонов, появления систоличного шума, признаков перегрузки правых отделов сердца на ЭКГ. При рентгенологическом исследовании органов грудной клетки — усиление сосудистого рисунка, вздутие легких, увеличение размеров сердца за счет правых его отделов («шаровидное сердце»).
У большинства инфицированных доношенных детей дыхательные нарушения на протяжении первой недели жизни отсутствуют или выраженные незначительно (затруднено носовое дыхание, незначительная одышка, послабление дыхательных шумов). Воспалительная инфильтрация в легких у 60 % детей проявляется в конце первой недели, у остальных — на 2-3-й неделе жизни синдромом дыхательных расстройств: выраженной одышкой, участием в акте дыхания вспомогательной мускулатуры, наличием в легких мелкопузырчатых образований. В тяжелых случаях при нарастании сердечно легочной недостаточности присоединяется геморрагический синдром — мелена , ДВЗ-синдром.
При поражении хламидиями желудочно-кишечного тракта наблюдается срыгивание, рвота, вздутие живота, раннее появление опрелостей при нормальном характере опорожнений. Увеличение размеров печенки, селезенки оказывается у каждого 3-го ребенка.
Конъюнктивит в раннем неонатальном периоде наблюдается у 60-70 % детей. Заболевание развивается на 3-15 день жизни, проявляется сначала слезотечением, незначительным покраснением и отеком конъюнктивы, а впоследствии появлением слизисто гнойных выделений (бленнорея) и выраженной воспалительной реакцией глаз (двустороннее поражение). Заболевание характеризуется рецидивирующим ходом, иногда осложняется дакриоциститом .
Диагностика хламидийной инфекции основывается на данных анамнеза (наличие у матери хронических заболеваний урогенитального тракта, вторичного бесплодия, хронических генитальных заболеваний, внематочной беременности, воспалительных осложнений после предыдущих родов, смерть детей в раннем возрасте от пневмонии, а также усложнен ход данной беременности), клинической картине, данных лабораторных и инструментальных методов исследования:
· в общем анализе крови — умеренная анемия, эозинофилия (больше 7 %), моноцитоз (больше 10 %);
· микробиологическое обследование матери (скребок из слизистой оболочки цервикального канала) и ребенка (выделение из конъюнктивы, задней стенки глотки , вульвы ).
· метод прямой имунофлуоресценции — выявление хламидий в мазках-отпечатках ( скрининговый тест);
· иммуноэнзимный метод (метод ELISA) — обнаруживают специфические антихламидийные антитела, которые относятся к классу Ig M, Ig G (титр 1:64 и его нарастание — свидетельствуют об активном инфекционном процессе);
· выявление специфических антигенов (метод цепной полимеразной реакции, ДНК-гибридизация);
· исследование плаценты — увеличение в объеме клеток амниона и выявления в них хламидий, участков некроза; скопление лейкоцитов в межворсинчатом пространстве; фиброз стромы, терминальных ворсинок, сосудистые расстройства.
Лечение . Этиотропное лечение включает использование антибиотиков-макролидов:
Эритромицин — в дозе 40 мг/кг в сутки, per os, на протяжении 21 дня; дает хороший клинический эффект, однако на первом году жизни сохраняется персистенция хламидий у 55 % доношенных и 75 % недоношенных младенцев.
Сумамед ( азитромицин ) — препарат новой группы макролидных антибиотиковазалидов с широким спектром антимикробного действия; назначается из расчета на И-й день — 10 мг/кг, per os, дальше на протяжении 4-7 дней — по 5 мг/кг в сутки; значительно быстрее нормализует общее состояние ребенка и обеспечивает полную элиминацию возбудителя из организма, без любых косвенных действий.
Клацид ( кларитромицин ) назначается из расчета 10 мг/кг/сутки, per os, в 2 приема, на протяжении 14 дней; можно использовать и для внутримышечного, внутривенного введения.
Для лечения хламидийного конъюнктивита — э ритромициновая , тетрациклиновая мази, 0,5 % раствор левомицетина.
Антибиотикотерапию проводят в сочетании с иммуноглобулинами, витаминами (А, С, Е), глютаминовой кислотой, интерфероном, бактериальными препаратами ( бифидум-бактерин ). В зависимости от клинического состояния, используют оксигенотерапию , дегидратацию и другие симптоматические средства.
Эффективность лечения новорожденных оценивают за результатами контрольного микробиологического исследования ребенка в 6-месячном возрасте. При выявлении персистенции хламидий есть необходимость повторного курса антибактериальной терапии.
Надежный способ профилактики хламидийной инфекции у новорожденных заключается в раннем выявлении и лечении инфицированных беременных. Хламидиоз во время беременности — прямое показание к назначению лечения.
Схема лечения урогенитального хламидиоза во время беременности
После 12 недель беременности
Аллергические реакции, тошнота, рвота
0,5 г 2 раза в сутки, 7 дней
0,3 г 3 раза в сутки, 10 дней
2 г 3 раза в сутки, 10 дней
2 г 3 раза в сутки, 10 дней
0,3 г 2 раза в сутки, 7 дней
2 свечи на время per rectum, 5 дней
После 12 недель беременности
5 драже 3 раза в сутки, 3 недели
После 12 недель беременности
500 000 ЕД 4 раза в сутки, 7-10 дней
После 12 недель беременности
Микоплазмы — мельчайшие микроорганизмы, которые занимают промежуточное место между бактериями и вирусами. Насчитывается около 40 видов микоплазм , однако патогенными для человека является Mycoplasma pneumonia — вызывает заболевание респираторных органов (считают, что 15 % всех пневмоний, 5 % острых респираторных заболеваний вызываются микоплазмами ), распространяется воздушно-капельным путем; Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma ureliticum — возбудители урогенитальных воспалительных заболеваний, выделяются из мочеполовых органов, распространяются половым путем; Mycoplasma incognitum — вызывает генерализованный , малоисследуемый воспалительный процесс.
Результаты исследований свидетельствуют о широком распространении так называемого бессимптомного носительства микоплазм в урогенитальном тракте и связок с воспалительными заболеваниями внутренних органов.
Микоплазмовая контаминация цервикального канала у женщин репродуктивного периода вне беременности составляет приблизительно 13 %, однако увеличивается при кольпитах (24 %), эрозиях шейки матки и э ндоцервицитах (38 %), при этом часто совмещаясь с другими этиологическими факторами (бактериями, трихомонадами , вирусами). У беременных частота выделения Ureaplasma ureliticum колеблется от 50 % до 75 %, Mycoplasma hominis — до 20-25 %, что объясняется изменениями в иммунологическом и гормональном статусе женщины.
Микоплазмовая инфекция беременных, особенно урогенитальный микоплазмоз, может повлечь внутриутробную инфекцию плода и новорожденного
Патогенность микоплазм предопределена их большой подвижностью, способностью прикрепляться к любым клеткам (лейкоцитам, сперматозоидам, эпителию), осуществляя при этом токсичное и деструктивная действие. Структурное сходство мембран клеток человека и микоплазм ослабляет их распознавание как инородных антигенов, что предопределяет вероятность аутоиммунизации организма.
Инфицирование плода происходит в ант е- и интранатальном периодах, как правило, гематогенным и контаминационным путями. Наиболее часто реализуется восходящий путь инфицирования, которое обеспечивается подвижностью микоплазм , а также заражение плода происходит в результате заглатывания и аспирации околоплодных вод.
По данным литературы, инфицирование в ранние сроки беременности может повлечь прерывание беременности, спонтанные выкидыши, развитие хориоамнионита , преждевременные роды, нарушения развития плода . Инфицирование в поздние сроки предопределяет рождение детей недоношенными , с низкой массой при рождении (клинический опыт показывает, что у 50 % детей с массой тела меньше 1500 г при рождении выделяется Ureaplasma ureliticum), а также с клиническими проявлениями микоплазмовой инфекции ( генерализованная форма инфекции, микоплазмовая пневмония).
Микоплазмы способные вызывать необратимые изменения в хромосомном аппарате клеток, таким образом осуществляя тератогенное влияние на плод.
Клиника генерализованой микоплазмовой инфекции полиморфна и неспецифическая. Характерным является поражение респираторного тракта с развитием врожденной пневмонии (у недоношенных — по типу болезни гиалиновых мембран), печенки с развитием желтухи, почек, ЦНС (в виде менингита, менингоэнцефалита, абсцесса мозга, гидроцефалии), глаз, кожных покровов, то есть полиорганный характер патологического процесса.
Для идентификации микоплазмовой инфекции используют такие методы диагностики: микробиологический , серологичний , прямой и непрямой имунофлюоресценции , имуноферментного анализа, полимеразной цепной реакции, ДНК-гибридизации. Морфологическое исследование плаценты обнаруживает своеобразную трансформацию клеток, в цитоплазме, которых находят микоплазмы.
Стоит отметить, что малоинформативными являются серологичные методы диагностики, поскольку микоплазмы не вызывают стойкого иммунитета, а также существует большое количество серотипов возбудителей.
Для лечения микоплазмовой инфекции используют эритромицин (50 мг/кг/сутки) или азитромицин-сумамед (5 мг/кг/сутки), на протяжении 5-10 дней, через рот, или клиндамицин (20 мг/кг/сутки).
Профилактика внутриутробного инфицирования микоплазмами плода и новорожденного заключается во всестороннем обследовании женщин с отягощенным акушерским анамнезом и урогенитальными заболеваниями при планировании беременности (то есть, еще до беременности). В случае выявления во время беременности в родильных путях микоплазм целесообразно назначить специфическое лечение.
Схема лечения микоплазмовой инфекции во время беременности
После 12 недель беременности
Аллергические реакции, тошнота, рвота
0,5 г 2 раза в сутки, 7 дней
0,3 г 2 раза в сутки, 7 дней
1свечка на время per vaginum, 10 дней
После 12 недель беременности
1 капс. 2 раза в сутки, 14 дней
5 драже 3 раза в сутки, 3 недели
После 12 недель беременности
500 000 ЕД 4 раза в сутки, 7-10 дней
После 12 недель беременности
Прогноз . При раннем выявлении и адекватном лечении ВУИ прогноз для жизни, по большей части, благоприятный; для полного выздоровления — сомнительный, поскольку после перенесенной вирусной инфекции возбудитель часто персистирует в организме, вызывая разнообразные заболевания.
КЛАССИФИКАЦИЯ ПЕРИНАТАЛЬНЫХ ИНФЕКЦИЙ У ДЕТЕЙ.
Внутриутробная эмбриопатия фетопатия
Генерализованная (указать поражение органов)
Таким образом, несмотря на разнообразие этиологической структуры, ВУИ имеют общие характерные особенности, в частности большинство заболеваний беременных, которые вызывают инфицирование плода , протекают в латентной или субклинической форме; в клинике ВУИ преобладают общие, неспецифические симптомы над специфическими . Все это утруждает своевременную диагностику данной группы заболеваний.
конфликт по системе АВО, Rh ф-ром;
мертворождение, выкидыши в анамнезе;
контакты с домашними котами
употребление полусырых мясных продуктов
отек головного мозга, кровоизлияние
с-м плавающих глазных яблок, Грефе
патологические примеси фекалий
Задержка внутриутробного развития плода . ( ЗВУР )
Одной из важнейших проблем современной медицинской науки является проблема выхаживания и реабилитации новонародженных , которые родились с низкой массой тела, предопределенной пренатальной гипотрофией или задержкой внутриутробного развития ( ЗВУР ). Задержку внутриутробного роста и развития диагностируют у детей, которые имеют недостаточную массу тела при рождении по отношению к их гестацийному возрасту. Согласно определению ВООЗ , дети, которые родились с массой тела меньше 2500,0г, определяются как “малые для срока ”. Низкая масса тела при рождении влечет за собой не только высокий риск неонатальной заболеваемости и смертности, но и негативно отображается на последующем физическом и психическом развитии. Доказано, что последствия ЗВУР не исчезают до 3-6 годов. Как правило, такие дети должны меньшую массу тела, рост и обвод головы; они представляют группу риска в плане формирования разных проявлений гипофункции яичников и нарушения репродуктивной системы в будущем, получают наиболее низкие баллы в тестах на умственное развитие. Перинатальная смертность у детей из ЗВУР в 4-10 раз выше, чем при неусложненной беременности. Наиболее частой причиной мертворождения при ЗВУР является внутриутробная асфиксия, которая связана с дефицитом гликогена в сердце плода . У детей, которые родились с массой тела (меньше 2500,0г), смертность достигает 30%.
Среди детей с малой массой при рождении выделяют 3 группы:
I — недоношенные с массой тела, которое отвечает гестационному возрасту;
II — недоношенные с массой тела меньше, чем должа быть по срокам беременности;
III — доношенные, которые родились по окончании 37 недели беременности, или перенашиваемые, которые родились на 42-й неделе беременности и позже, имеют массу тела ниже 10% нормы для данного срока гестационного возраста. Скорость внутриутробного развития плода I -и группы нормальна, а ІІ и ІІІ групп — медленная.
Выделяют 4 группы факторов риска:
І груп а- со стороны матери: дефекты питания ( резкий дефицит белков и витаминов, цинка, селена и других микроэлементов), гипогликемия, гипертоническая болезнь, заболевание сердечно-сосудистой системы, хронические заболевания почек и легких, гемоглобинопатии , сахарный диабет типа с сосудистыми осложнениями, ожирение, заболевание соединительной ткани, длительный бесплодный период, выкидыши, мертворождения в анамнезе, рождение предыдущих детей в семье с низкой массой, гестозы , вредные привычки матери: курение, алкоголизм, наркомания, прием некоторых медикаментов (например, антиметаболиты , бет а- блокаторы , дифенин , оральные антикоагулянты и др.)
ІІ груп а- со стороны плаценты: малая масса и поверхность плаценты (меньше 8% массы тела новорожденного), аномалии плаценты ( инфаркты, кальциноз , фиброз, гемангиома, единственная артерия пуповины, тромбозы сосудов, плацентит и ин ) и частичное отслоение, а также аномальное прикрепление (низкое размещение плаценты, предлежания и др.), патологии развития плаценты.
ІІІ группа — социально биологические — низкий социально — экономический уровень и образование матери, подростковый возраст, обитания в высокогорной местности, профессиональные вредности у матери (работа в горячем цехе, вибрация, проникающая радиация, химические факторы).
ІY группа — со стороны плода — многоплодная беременность, хромосомные болезни, аномалии обмена веществ, врожденные патологии развития, генерализованные внутриутробные инфекции.
ЗВУР может возникнуть в разные периоды внутриутробной жизни.
Установлено, что если у ребенка, который родился в срок, имеет место лишь малая масса при рождении, то фактор, который замедлял темп его внутриутробного развития, действовал в последние 2-3 месяца беременности — гипотрофичный вариант. Если одновременно отмечается дефицит массы и длины тела, тогда неблагоприятные факторы действовали на плод в ІІ триместре беременности — гипопластичный вариант.
ЗВУР может сопровождаться также обезображенным развитием плода — формированием патологий развития, дизэмбриогенетичных стигм , нарушением пропорций тела, телосложения. Это вариант ЗВУР- диспластический — бывает у детей с хромосомными и геномными мутациями, генерализованными внутриутробными инфекциями, влиянием профессиональных вредных факторов у матери и тератогенных факторов на плод (мать, которая страдает наркоманией, алкоголизмом, токсикоманией, употребляла во время беременности антиметаболиты , антикоагулянты-антагонисты витамина К , противосудорожные средства и др.).
Гипотрофия плода чаще встречается при первых родах у женщин, которые имеют низкие показатели роста (меньше 150см) и массу тела меньше чем 45 кг В литературе содержится информация о существовании генетического фактора, который приводит к гипотрофии плода .
Основной причиной развития ЗВУР является недостаточность маточно-плацентарного кровообращения. При этом больше всего страдает печенка, несколько меньше это отображается на развитии тимуса и мозга.
Это выглядит так: И ) гипоксия ® снижение активности ферментов® уменьшения усвоения питательных веществ или ІІ) количественное и качественное уменьшение нутриенто в- гипотрофия.
· этиологические факторы и состояние риска (материнские, плацентные, плодные, смешанные);
· клинический вариант: гипотрофичный , гипопластичный , диспластичный;
· степень тяжести: легкая, средняя, тяжелая;
· ход интранатального и неонатальное периодов (без осложнений, или с осложнениями и сопутствующими состояниями — указать которыми).
В англоязычной литературе вместо термина гипотрофичный вариант ЗВУР использую т — асимметричный, а гипопластичный и диспластичный вариант объединяют- симметричный ЗВУР .
При гипотрофичном варианте ЗВУР можно ставить диагноз внутриутробная (пренатальная) гипотрофия.
Основным диагностическим критерием врожденной гипотрофии у доношенных новорожденных следует считать снижение масов о- ростового коэффициента ниже 60, дефицит массы в %.
Диагностические критерии ЗВУР по степени тяжести для доношенных детей.
Использования массово ростового коэффициента для оценки степени тяжести пренатальной гипотрофии у недоношенных детей неприемлемо . Это связано с тем, что у данного контингента детей необходимо учитывать степень недоношености .У недоношенных новорожденных с гестационным возрастом от 28 до 37 недель степень тяжести определяют по индексом трофики( ИТ ), который равняется разнице длины бедра (см) и обводу бедра (см) ( ИТ = длина бедра (см) — обвод бедра (см)).
Диагностические критерии ЗВУР по степени тяжести для недоношенных детей
Дефицит массы при рождении
Учитывая то, что у 68% недоношенных после рождения оказываются признаки отечного синдрома, рекомендуется оценивать массу тела после гидрофильной адаптации организма: у детей с массой тела 1500г при рождении — на 8-10-ые сутки, 2000г — на 6-8-ые сутки, выше 2000г — на 5-6-ые сутки.
По клинически — антропометрическим параметром ЗВУР делится на два варианта. К первому варианту принадлежат дети, которые рождаются со значительным дефицитом массы тела, роста, обводу головы, симптомы сниженного питания выражены умеренно, и внешне младенцы напоминают недоношенных . В данном случае отставание плода в развитии отмечается со второго триместра.
Второй вариант пренатальной гипотрофии характерезуется значительным дефицитом массы тела, нормальным ростом и обводом головы. У них отмечаются сухость, лущение, свисание складок кожи, снижения тургора мягких тканей, утончение подкожно — жировой основы. Действие неблагоприятных факторов, которые задерживают развитие плода в данном случае длилась последний триместр.
Для детей с задержкой внутриутробного развития характерные гипотония, снижены физиологичные рефлексы, ухудшение аппетита, нарушение терморегуляции, склонность к гипогликемии, позднее отпадение пуповинного остатка с в ялым заживанием пуповинной ранки, длилась транзиторная желтуха, срыгивание, неустойчивые опорожнения.
І степень — легкий , характеризуется уменьшением массы новорожденного на 10-20% от массы здорового доношенного ребенка того же гестационного возраста. Отмечается умеренное уменьшение подкожно жирового слоя, снижения тургора тканей, тонуса мышц.
ІІ степень — средний, выставляется при отставании массы тела до 30%. Такие дети отстают также в росте на 1-1,5см по сравнению со здоровыми новорожденными. Подкожно жировой слой резко утончен, эластичность кожи снижена.
ІІІ степень — тяжелая форма. Дефицит массы составляет больше 30%, имеет место дефицит длины тела на 2-4см по сравнению со здоровыми новорожденными. Подкожно жировой слой отсутствует, кожа дряблая , шелушится, с трещинками в участках стоп, складок, нижней части живота. У детей из ЗВУР сразу после рождения отмечается вялость, снижение сосательного рефлекса, гипотония, часто сниженные или отсутствуют рефлексы новонарожденного , нарушен сон. При исследовании оказывается метаболический ацидоз. Дыхание поверхностно, аритмично, тона сердца ослаблены, возможна ( неблагоприятный признак). Часто имеют место срыгивание и рвота О тмечается значительное послеродовое падение массы, задерживается отпадение пуповинного остатка, плохое заживление пупочной ранки. Эти дети восприимчивые к разным инфекционным заболеваниям. Желтуха у них появляется ко 2-3-му дню жизни после рождения и долго содержится из-за снижения конъюгированной функции печенки. Мекониальный характер опорожнений задерживается до 4-5-го дня жизни.
Клинические проявления алкогольного синдрома плода -з адержка физического и умственного развития в сочетании с черепного — лицевыми уродствами. Возможны аномалии конечностей, внутренних органов, внешних половых органов и др. Наиболее типичными нарушениями строения лицевой части черепа — микрофтальмия , удлинение лица, низкий лоб, недоразвитие подбородка, маленький седловидный нос, дисплазия ушных раковин, птоз, большой рот с тонкими губами, выпуклая верхняя губа с узким красным краем (рот рыбы), косоглазие, укорачивание длины глазных щелей, уплощения затылка, микроцефалия или гидроцефалия. В результате внезапного отсутствия алкоголя и наркотиков у новонародженных появляются признаки абстиненции. В течение первых 6-12-24час у них у чащается дыхание, частая зевота, чихания, появляются пронзительный крик, тремор, клинические судороги, иногда развивается опистотонус , нередко со временной остановкой дыхания, рвотой, диареей, субфебрильной и фебрильной температурой тела, внезапная смерть, но могут быть и длительные проявления (до нескольких недель) с постепенным улучшением состояния.
При рассечении обнаруживают тяжелые органические поражения головного мозга.
Клинические проявления радиационного синдрома не имеют специфической картины. Часто отмечается микроцефалия, в дальнейшем — разной степени проявления дефекта психомоторного развития. Повышена частота комплекса аномалий в клетках периферической крови.
Синдром профессиональной вредности также не является характерной клиникой, но чаще проявляется выраженной транзиторной желтухой, склонностью ребенка к повышенной кровоточивости, инфекционным заболеваниям, функциональным нарушением печенки и мозга.
Табачный синдром проявляется повышенной частотой выкидышей, гезтозив , кровотечений в родах, гипоксией и гиповитаминозами плода , накоплением в крови плода карбоксигемоглобина , никотина, тиоционата и проч., рождением ребенка в асфиксии .В дальнейшем задержка психомоторного развития, синдром внезапной смерти.
Диагностика. Проводится по масоростовому индексу (индекс Пондераля). Необходимо цифру массы тела новорожденного в граммах разделить на цифру его длины в сантиметрах. При получении цифры меньше 60 можно думать о пренатальной гипотрофии или дефиците массы тела 10%, когда масса тела при рожденные меньше 2800г. Длина тела и обвод головы также ниже нормы. Имеет значение анамнез, данные обзора ребенка.
Параклиничные методы обследования:
Общий анализ крови (признаки анемии, замедленная ШОЭ );
Биохимические исследования крови ( гипопротеинемия и / или диспротеинемия , повышение щелочной фосфатазы при сопутствующем рахите);
Копрологическое исследование кала (нарушение пищеварения и всасывание в желудке и кишечнике );
Микробиологическое исследование кала (признаки дизбактериоза );
Исследование иммунного статуса ребенка (возможны уменьшения показателей гуморального и клеточного иммунитета).
Лечение . Необходимо верно организовать вскармливание и уход за новорожденным. При отсутствии сосательного рефлекса — кормить через зонд материнским грудным молоком 7-8 раз в сутки, при улучшении состояния и аппетита — прикладывать к груди 8-10 раз в сутки. Расчет потребности необходимо проводить так же, как и для недоношеного младенца. Дети из ЗВУР нуждаются в постоянном согревании, пристальном уходе за пупочной раной и кожей. В комплекс лечения должны быть включены витамин С — по 100 мг в день, через рот; В1 — по 10-15 мг через рот, витамин В6 — по 15-20 мг внутримышечно через день с витамином В12 — по 50 мкг поочередно, витамин Е — по 20 мг/кг. С целью улучшения процессов гидролиза и всасывания в пищеварительном канале назначают желудочный сок, панкреатин, пепсидил , фестал и другие ферментные препараты на протяжении 2-3 недель. В зависимости от характера и степени дизбактериоза , используют бактериальные препараты ( бифидумбактерин , лактобактерин , линекс , хилак и другие), длительными курсами (на протяжении всего периода наличия дизбактериоза плюс две недели после нормализации микрофлоры толстой кишки).
Для стабилизации сниженных обменных процессов, резервных возможностей организма, повышения тонуса регуляторных систем назначают на первом этапе заболевание необходимы легкодействующие курсы терапии апилаком (пестиковые пчелиные молоки) в свечах по 0,0025 г 2-3 раза в сутки. Проводится контроль и коррекция электролитных нарушений.
При наличии синдрома отмены назначается фенобарбитал — 6, потом 8 мг/кг в сутки; седуксен — 0,1-0,2 мг/кг каждые 12 часов внутривенно .П ри улучшении состояния дозы препаратов уменьшаются. Необходимо присматривать за новорожденным после отмены медикаментозного лечения, так как наблюдаются рецидивы симптоматики синдрома отмены.
Лечение гипотрофии нуждается в исключительной внимании и терпении, индивидуальном подходе. Улучшение общего состояния, аппетита, появление интереса к окружающему при отсутствии увеличения веса ребенка с ІІІ степенью недостаточности питания расцениваются как позитивная динамика и надежда на выздоровление.
Профилактика. Необходимо устранить все факторы, которые способны вызывать ЗВУР и рекомендовать родителям посещать школы будущих родителей и матерей; организовывать перестройку всего уклада жизни семьи с постоянным акцентом на интересы будущего ребенка, обеспечить позитивный психоэмоциональный тонус беременной женщины, организовать ее рациональное питание.
1. Шабалов Н.П. Неонатология: учеб. пособие: в 2 т. / Н.П.Шабалов. – 5-е изд., испр. и доп. – М. : МЕДпресс-информ, 2009. Том 1. – 2009. – 736 с.
2. Шабалов Н.П. Неонатология: учеб. пособие: в 2 т. / Н.П.Шабалов. – 5-е изд., испр. и доп. – М. : МЕДпресс-информ, 2009. Том 1. – 2009. — 768 с.
1. Неонатология: национальное руководство. Антонов А.Г., Арестова Н.Н., Байбарина Е.Н. и др. / Под ред. Н.Н. Володина. 2009. — 848 с.
2. Практическое руководство по неонатологии. Яцык Г.В., Одинаева Н.Д., Боровик Т.Э., Скворцова В.А., Беляева Е.А. 2008. — 344 с.
3. Новорожденный ребенок. Основы оценки состояния здоровья и рекомендации по профилактике и коррекции его нарушений: руководство. Черная Н.Л., Шилкин В.В. Издательство: СпецЛит. 2009. — 352 с.
Мат ериалы для подготовки составила ассистент Ковальчук Т.А.
источник


