В филиале МКНЦ имени А.С. Логинова «Маммологическом центре «Клиника женского здоровья» у вас появилась возможность сдать генетический анализ на предрасположенность к раку молочной железы .
Что важно знать о гене BRCA-1 и BRCA-2
В большинстве случаев онкологические заболевания являются наследственными и связаны с носительством мутаций в определенных генах, полученных от одного из родителей.
Одним из эффективных подходов, способствующих раннему выявлению рака молочной железы и рака яичников, является молекулярно-генетическое определение их наследственных форм. Данное исследование позволяет подтвердить наличие наследственной предрасположенности к развитию рака и сформировать группы повышенного риска развития для патогенетически обоснованной профилактики и/или ранней диагностики заболевания на начальном этапе развития.
Известно, что 5-10% случаев рака молочной железы и 10-17 % рака яичников являются наследственными и их развитие связано с мутациями в генах BRCA-1 и BRCА-2. По данным многочисленных исследований, ими обусловлены 20-50% наследственных форм рака молочной железы, 90-95% случаев наследственного рака яичников у женщин, а также до 40% случаев рака грудных желез у мужчин.
Что такое гены BRCA1 и BRCA2?
Известно, что большинство наследственных форм рака молочной железы связаны с генами BRCA1 и BRCA2 (BREAST CANCER GENES 1 и 2). Данные гены отвечают за регуляцию процессов восстановления генетического материала (ДНК) и предупреждают возможную опухолевую трансформацию клеток. Однако при наличии дефектов и мутаций в этих генах значительно повышается риск развития рака молочной железы и яичников.
5 фактов о гене BRCA-1 и BRCA-2
человек уже рождается с мутацией гена BRCA1 или BRCA2, изменить данный факт невозможно
не все носители этого гена заболеют раком
измененный ген можно унаследовать как от матери, так и от отца
вероятность передачи детям измененного гена BRCA составляет 50%
ген передается из поколения в поколение
Зачем мне нужен анализ на мутации генов BRCA1 и BRCA2?
Данный анализ поможет Вам узнать, унаследовали ли Вы генетическую мутацию, в связи с которойриск заболеть раком молочной железы и/или яичников повышается.
Выявление генетического дефекта у клинически здоровых женщин позволяет провести своевременную диагностику и профилактику развития рака молочной железы и/или яичников. Для пациенток, у которых опухоль уже возникла, обнаружение мутаций генов BRCA1 и BRCA2 позволяет определить ее наследственную природу и правильно подобрать лечение.
Как можно заподозрить наследственную форму рака молочной железы?
Большая вероятность того, что у Вас имеется наследственная предрасположенность к раку молочной железы, возможна при:
- Выявлении рака молочной железы в молодом возрасте (до 40 лет);
- Наличии прямых родственников (мать, бабушка, сестра, тетя) с материнской или отцовской стороны, у которых был выявлен рак молочной железы в возрасте до 50 лет;
- Наличии в Вашей семье родственницы с раком молочной железы и яичников;
- Случаях в Вашей семье множественного или двустороннегорака одной или обеих молочных желез;
- Если в Вашей семье был случай рака грудной железы у мужчины;
- При сочетанном раке (например, рак яичников и поджелудочной железы).
Как проводится анализ на мутации генов BRCA1 и BRCA2?
Анализ заключается в заборе небольшого количества крови из вены или заборе щечного эпителия. Специальной подготовки для исследования не требуется.
Что делать если анализ на мутации генов BRCA1 и BRCA2 оказался положительным?
Положительный результат свидетельствует о том, что Вы унаследовали дефект генов BRCA1 и BRCA2 и имеете предрасположенность к развитию некоторых видов рака (рака молочной железы, яичников, предстательной железы (у мужчин), кишечника, гортани и др.). Анализ указывает лишь на вероятность возникновения рака и не означает, что генетический дефект будет у всех кровных родственников. При обнаружении мутаций в генах BRCA1 и BRCA2 у женщины риск развития рака молочной железы и/или яичников составляет от 50 до 90%.
Положительный результат анализа – важная информация, которая позволяет как можно раньше предпринять профилактические меры и снизить вероятность развития онкологических заболеваний.
А если анализ на мутации генов BRCA1 и BRCA2 отрицательный?
Отрицательный результат вовсе не означает, что рак у Вас не возникнет. Это значит, что для Вас риск рака среднестатистический и не требует столь повышенного внимания к его профилактике, как в случае наличия данных мутаций. Ну и конечно же, отрицательный результат не отменяет таких общеклинических профилактических обследований как осмотр маммолога и маммография.
источник
Рак молочной железы и рак яичников — тема, волнующая многих женщин. Это связано с тем, что рак молочной железы — самое распространенное онкологическое заболевание среди женщин. При продолжительности жизни до 80 лет риск заболеть раком молочной железы составляет 12,5%, то есть им заболевает каждая восьмая женщина.
Приблизительно 10% от общего количества заболеваний раком молочной железы наследственные и связаны с определенными генами. Нормальное функционирование генов BRCA1 и BRCA2 препятствует развитию рака молочной железы и рака яичников. Если в одной из копий генов происходит «поломка» (мутация), сильно возрастает вероятность развития рака молочной железы (до 85%).
Рак яичников является первым по смертности среди гинекологических злокачественных заболеваний. Его особенность заключается в том, что, несмотря на новейшие диагностические возможности, до сих пор 85% женщин с раком яичников обращается к онкогинекологу уже на 3-й и 4-й стадиях, когда шансы на излечение даже с самыми прогрессивными хирургическими техниками и новейшими схемами химиотерапии остаются не очень высокими.
При наличии мутации гена BRCA1, например, риск заболеть раком яичников составляет 54%, а риск умереть от этого заболевания у каждого здорового носителя этой мутации – около 20%.
Ген, ответственный за возникновение рака молочных желез и яичников, может передаваться как от матери, так и от отца. Если этот ген присутствует у кого-то из одного родителей, то риск его наследования составляет 50%. Если ген передался по наследству, то риск развития рака зависит от специфичности гена, его проявления в семейном анамнезе, а также от индивидуальных особенностей организма. Риск развития рака молочной железы в таких семьях колеблется в пределах от 40 до 80%, а рака яичников – от 25 до 54%.
Следует помнить, что рак молочных желез и яичников, возникший в результате генетической предрасположенности, проявляется и лечится точно так же, как онкологические заболевания, возникающие у неносителей мутаций, но чаще поражает более молодых женщин.
Многие женщины, родственницы которых больны раком молочной железы или раком яичников, хотят знать, повышен ли у них риск развития данных заболеваний, чтобы по возможности предотвратить возникновение опухоли.
Сдав кровь на исследование, Вы можете определить, унаследована ли Вами предрасположенность к возникновению рака молочной железы и рака яичников, связанная с генами BRCA1 и BRCA2.
Показания для проведения исследования генетической предрасположенности к возникновению рака молочной железы и рака яичников:
наличие двух или более родственников, имеющих рак молочной железы;
выявление рака молочной железы в возрасте до 45 лет;
двусторонний или мультифокальный рак молочной железы;
заболевание раком яичников;
наличие даже одного родственника с раком яичников или раком молочной железы, который был диагностирован до 40-летнего возраста;
если раком молочной железы страдает мать, сестра или дочь;
если у многих поколений в семье был рак молочной железы или яичников;
родственницы, страдающие раком молочной железы в относительно молодом возрасте (моложе 50 лет);
родственницы, страдающие раком обеих молочных желез.
Информация о наследственной предрасположенности к раку груди и/или яичников в комплексе с гинекологическим и маммологическим обследованием поможет врачам определить индивидуальную профилактическую и лечебную тактику.
Цели генетического исследования:
оценка риска возникновения наследственного рака молочной железы и рака яичников;
разработка оптимальной тактики наблюдения пациенток с повышенным риском, составление плана лечения рака молочной железы и рекомендаций для проведения профилактических операций, значительно снижающих риск возникновения рака яичников в будущем.
Если у вас есть родственники с этой генетической аномалией, генетическое исследование имеет неоспоримые преимущества:
Если мутации генов не обнаружены, врач с большой вероятностью может сказать, что у вас такой же низкий риск развития рака молочной железы или рака яичников, как и у остальных женщин.
Если результаты генетического тестирования положительные, то тщательный контроль за состоянием молочной железы и яичников может помочь выявить рак на ранних стадиях, когда он еще излечим. Для этого используются принципиально иные протоколы ранней диагностики, чем в обычных случаях, скрининг начинается на 5-10 лет раньше.
Вам могут рекомендовать определенные препараты для профилактики развития рака груди, например, тамоксифен или гормональные препараты.
Вам могут предложить профилактическое оперативное вмешательство (удаление молочной железы, яичников, маточных труб или всех этих органов).
Если у вас обнаружен рак, генетическая характеристика может дать больше информации для выбора наиболее оптимального и специфичного метода лечения.
Наконец, если вы знаете, что являетесь носителем мутации гена рака яичников и молочной железы, вы можете изменить прежний образ жизни.
Главными целями диагностики наследственных форм рака молочной железы и рака яичников являются не только выявление носительства мутаций в генах, но и определение наиболее оптимальной, индивидуальной тактики дальнейшего скрининга и профилактики возникновения этих серьезных заболеваний.
источник
Смертность от рака яичников стоит на 8-м месте среди причин смертности женщин от онкологических заболеваний. Из-за отсутствия свойственных только этому заболеванию симптомов, рак яичников до сих пор диагностируют довольно поздно. Что может современная медицина, с ее генетическими исследованиями и новыми препаратами, а что зависит от самих женщин, рассказывает Светлана Викторовна Хохлова, д.м.н., старший научный сотрудник отделения химиотерапии РОНЦ им. Н.Н. Блохина.
Почему большинство случаев рака яичников у женщин приходится на возраст после 50 лет? Как связан рак яичников с отсутствием беременности и грудного вскармливания? С раком груди?
На сегодняшний день выделяют несколько факторов, которые повышают риск развития рака яичников: гормональный, генетический, алиментарные факторы, к которым относится экология и питание, и социальные факторы.
Многочисленные эпидемиологические исследования показывают влияние гормональных факторов в группах пациенток, у которых либо раньше начиналась менструация, либо поздно наступала менопауза.
Прямой связи с гормональными нарушениями в организме в этих исследованиях не наблюдалось. Однако установлено, что повышенное количество эстрогенов, во-первых, участвует в развитии рака молочной железы, а во-вторых, может повысить риск развития рака яичников.
Эти гормональные нарушения связаны, в основном, с процессами овуляции. При выходе яйцеклетки из яичника в каждом менструальном цикле происходит незначительное повреждение коркового слоя яичника. Эти повреждения эпителия накапливаются и могут приводить к перерождению эпителия в рак, поэтому женщины в возрасте после 40 лет и попадают в группу риска. Также приводить к перерождению ткани в рак могут воспалительные процессы, кисты яичников, эндометриоз.
Напротив, беременность и грудное вскармливание уменьшают количество овуляций в жизни женщины, с чем и связано предположение, что материнство снижает риск развития онкологии. Это подтверждает статистика: установлено, что в странах с низкой рождаемостью (а это, как правило, развитые страны) рак яичников встречается чаще. В развивающихся странах с высокой рождаемостью риск развития рака яичников намного ниже.
Сейчас проверяются гипотезы о том, насколько повышают риск развития рака препараты, стимулирующие работу яичников, например, эстрогены. В то же время, имеются данные, что контрацептивы с эстрогенами и прогестинами уменьшают риск развития данного заболевания.
Что такое гены BRCA и как они связаны с раком яичников и раком груди? Надо ли носителям мутировавших генов на всякий случай удалять яичники, как Анджелина Джоли удалила грудь?
Наиболее важным фактором развития рака яичников последние годы считают генетический. Всевозможные повреждения ДНК происходят в организме каждую секунду и могут приводить к развитию опухоли. Однако выявлены определенные гены-супрессоры, которые блокируют опухолевый рост. К таким генам, которые участвуют в восстановлении ДНК и сдерживают развитие опухолевого процесса, как раз и относятся BRCA1 и BRCA2.
Если же в этих генах имеются мутации, то механизм, который восстанавливает поврежденные ДНК, не работает, количество мутаций в ДНК накапливается и развивается злокачественная опухоль. По имеющейся статистике, к 70 годам у 44% носителей мутированного гена развивается злокачественная опухоль яичников. А частота мутации гена BRCA среди больных раком яичников превышает 15%.
Генетические мутации BRCA1/2 наследуемы и часто встречаются в семьях, где кто-то болел или болеет раковым заболеванием. Не обязательно раком яичников или молочной железы — сейчас уже есть данные, что меланома, рак поджелудочной железы и ряд других опухолевых заболеваний в семьях также влияют на предрасположенность к развитию рака яичников. Поэтому члены таких семей должны быть на особом учете и проходить обследования.
Что касается таких решительных мер, как профилактическое удаление яичников и молочных желез, то исследования действительно показывают значительное снижение риска развития опухоли в этих случаях. Однако в нашей стране юридически данные виды операции не разрешены.
Какие есть способы ранней диагностики рака яичников? Диагностируется ли он на УЗИ?
К сожалению, скрининг для рака яичников не показал свою значимость. Ни УЗИ, ни определенные маркеры не показывают на ранних этапах данную патологию. С помощью ультразвукового исследования можно увидеть кисты, опухолевые изменения, и если есть подозрения на злокачественную опухоль, то пациентку обязательно нужно направить к онкологу и сделать анализ крови на маркер CA125.
Так что на сегодняшний день раннюю диагностику ракового заболевания может обеспечить онконастороженность самих женщин.
Действительно ли симптомы рака яичников могут напоминать расстройство желудка? Если женщина пойдет с болью в животе к гастроэнтерологу, он заподозрит неладное?
Рак яичников имеет имплантационный характер прогрессирования: метастазирование идет по серозной оболочке кишечника, желудка, печени, также появляется жидкость в брюшной полости. Поэтому часто пациентка жалуется на расстройство желудка, боли в эпигастральной области, в правом подреберье. Такие симптомы, как увеличение живота и запоры, появляются уже на 3-4-й стадии рака.
Проблема своевременной постановки диагноза заключается в отсутствии уникальных симптомов. Даже в Москве, где медицина на достаточно высоком уровне, с момента появления у женщины жалоб до первого визита к онкологу проходит от 4 месяцев до полутора лет. Все это время она может проходить обследования по месту жительства у терапевта, но правильный диагноз установлен не будет. 80% пациенток попадают к онкологу уже на 3-4-й стадии рака яичников. Единственный путь, который может изменить скорбную ситуацию — это информирование и обучение медицинских работников первичного звена.
Если опухоль обнаружена, то операция обязательна? Существуют ли варианты лекарственной терапии?
Да, основным методом лечения рака яичников является, конечно, оперативное: удаление первичной опухоли, большого сальника, всех видимых опухолевых изменений в брюшной полости.
Вне зависимости от стадии заболевания после операции пациенты проходят химиотерапию. Обойтись без химиотерапии можно только на очень ранней стадии, но из-за сложности обнаружения заболевания таких случаев мало. Часто во время операции оказывается, что стадия рака гораздо больше, чем предполагалось по данным обследования.
За многие годы большое количество всевозможных таргетных (или целевых) препаратов изучалось при раке яичников, но на сегодня из этой группы только один препарат зарегистрирован для лечения данной патологии.
С увеличением наших познаний в биологии рака ученые обнаружили, что в опухолевых клетках с мутацией гена BRCA ряд механизмов восстановления ДНК выключены. Для пациенток — носителей данных мутаций разработали препараты, которые блокируют другие механизмы восстановления ДНК, ДНК не восстанавливается, и опухолевая клетка погибает.
Это так называемые PARP-ингибиторы. Практическое применения этих препаратов показало преимущество использования их в поддерживающем режиме у пациенток с рецидивом рака яичников с мутацией гена BRCA1/2, у которых удалось достичь полного или частичного ответа на химиотерапию с применением препаратов платины. Такие препараты выводят лечение пациенток, страдающих раком яичников, на качественно новый уровень и улучшают их выживаемость.
Иммунотерапия — новое модное на сегодня направление, которое при раке яичников только изучается. Иммунная система человека очень сложная, и, к примеру, сейчас уже установлено, что рак «прячется» от иммунного ответа организма. В последние годы активно изучается группа препаратов — ингибиторов контрольных точек (checkpoint-ингибиторы), которые делают опухоль «видимой» для собственной иммунной системы, и уже сам организм человека подключается к уничтожению рака. Ингибиторы контрольных точек уже зарегистрированы в лечении меланомы и рака легкого, и нам остается лишь держать руку на пульсе современных медицинских исследований и ожидать выхода новых инновационных препаратов.
Можно ли сформулировать порядок действий для профилактики рака яичников — в каком возрасте какие обследования проходить женщине?
Профилактика рака яичников связана с уже упомянутыми факторами риска: правильное питание, своевременное лечение воспалительных процессов, обследование и лечение кист, лечение эндометриоза и других предраковых заболеваний.
Те, у кого выявлена генетическая мутация, встают на учет к генетику и проходят специальную скрининговую диагностику с раннего возраста. Мутация BRCA1/2 может проявляться и в виде рака молочной железы, и виде рака яичников, поэтому женщины группы риска должны проходить осмотр у гинеколога и маммолога регулярно с 25 лет. С 25-30 лет раз в год необходимо делать МРТ молочных желез и маммографию, с 35 лет — УЗИ яичников, малого таза и брюшной полости, а также анализ крови на определение маркера CA125.
Главным помощником женщины может быть ее собственная информированность и онконастороженность. Рекомендую каждой женщине после 30-35 лет регулярно проходить осмотр у гинеколога и проверять молочные железы.
источник
Состав генетического комплекса:
- Рак молочной железы 1 (BRCA1). Полиморфизм: 5382InsC
- Рак молочной железы 1 (BRCA1). Полиморфизм: 4153DelA
- Рак молочной железы 2 (BRCA2). Полиморфизм: 6174DelT
- Рак молочной железы 1 BRCA1: 185delAG
- Рак молочной железы 1 BRCA1: 3819delGTAAA
- Рак молочной железы 1 BRCA1: 3875delGTCT
- Рак молочной железы 1 BRCA1: 300 T>G (Cys61Gly)
- Рак молочной железы 1 BRCA1: 2080delA
Рак молочной железы – самая распространённая форма рака у женщин. Так, в России, из всех женщин, заболевших раком, каждая пятая (21%) имеет именно эту патологию – рак молочной железы.
Каждый год страшный диагноз слышат более 65 тысяч женщин, из них уходят из жизни более 22 тысяч. Хотя полностью избавиться от болезни на ранних стадиях возможно в 94% случаев. В этот комплекс входит определение мутаций в генах BRCA1 и BRCA2.
Рак молочной железы и наследственность:
Рак молочной железы в семейной истории болезни вот уже многие годы считается фактором риска. Около ста лет назад были описаны случаи семейного рака молочной железы, передающиеся из поколения в поколение. В некоторых семьях болеют только раком груди; в других появляются и другие виды рака.
Около 10-15% случаев заболеваний раком молочной железы – наследственные. Риск заболеть раком груди для женщины, мать или сестра которой болели этой болезнью, в 1,5-3 раза выше по сравнению с женщинами, чьи ближайшие родственники не болели раком молочной железы.
Рак молочной железы во всем мире считается наиболее исследованным онкологическим заболеванием. Каждый год появляется новая информация о природе этого онкологического заболевания и разрабатываются методики лечения.
Еще в начале 90-х годов BRCA1 и BRCA2 были идентифицированы как гены предрасположенности к раку молочной железы и раку яичников.
Наследственные мутации в генах BRCA1 и BRCA2 приводят к возрастающему в течение жизни риску развития рака груди. Оба этих гена имеют отношение к обеспечению стабильности генома, а точнее, в механизме гомологичной рекомбинации для репарации двухцепочечной ДНК.
Помимо рака молочной железы, мутации в гене BRCA1 проявляются при раке яичников, причем оба типа опухолей развиваются в более раннем возрасте, чем при ненаследственном РМЖ.
BRCA1-ассоциированные опухоли в целом связаны с неблагоприятным прогнозом для пациентки, поскольку чаще всего относятся к трижды негативному РМЖ. Этот подтип назван так из-за отсутствия в клетках опухоли экспрессии сразу трёх генов — HER2, рецепторов эстрогенов и прогестерона, поэтому и лечение, основанное на взаимодействии лекарств с этими рецепторами, невозможно.
Ген BRCA2 также вовлечен в процессы репарации ДНК и поддержание стабильности генома, — отчасти вместе с комплексом BRCA1, отчасти через взаимодействие с другими молекулами.
Мутации, характерные для определенных сообществ и географических групп, описаны также и для жителей нашей страны. Так, в России мутации BRCA1 представлены в основном пятью вариациями, 80% из которых — 5382insC. Мутации генов BRCA1 и BRCA2 приводят к хромосомной нестабильности и злокачественной трансформации клеток молочной железы, яичников и других органов.
Риск заболевания раком груди у женщин с мутацией генов BRCA1 и BRCA2:
У женщин – носительниц мутаций в одном из генов BRCA1 и BRCA2, риск заболеть раком молочной железы и раком яичников (реже – другими видами рака) выше, чем у других.
Следует подчеркнуть, что степень риска заболеть раком груди меняется в зависимости от семейного анамнеза. Степень риска повторно заболеть раком груди у женщины – носительницы мутации, уже переболевшей раком груди, составляет 50%. Риск заболеть раком яичников у носительниц мутации в гене BRCA1 составляет 16-63%, а у носительниц мутации в гене BRCA2 – 16-27%.
Показания к назначению исследования:
- В рамках программы скрининга и профилактики рака молочной железы с целью выявления вероятности наследственной предрасположенности.
- Женщинам, у родственников которых была обнаружена мутация в одном из генов.
- Женщинам с раком молочной железы или яичников в семейном анамнезе.
- Женщинам, переболевшим раком груди до 50 лет или переболевшим двусторонним раком груди.
- Женщинам, переболевшим раком яичников.
источник
Альтернативные названия: ген рака молочной железы, выявление мутации 5382insC.
Рак молочной железы по-прежнему остается самой частой формой злокачественных новообразований у женщин, частота встречаемости составляет 1 случай на каждые 9-13 женщин в возрасте 13-90 лет. Следует знать, что РМЖ встречается и у мужчин – примерно 1% всех пациентов с этой патологией составляют мужчины.
Исследование онкомаркеров, таких как СА-15-3, РЭА, HER2, СА27-29, позволяет выявить заболевание на ранней стадии. Однако существуют методы исследования, с помощью которых можно определить вероятность развития рака молочной железы у конкретного человека и его детей. Подобным методом является генетическое исследование гена рака молочной железы – BRCA1, в ходе которого выявляются мутации этого гена.
Материал для исследования: кровь из вены или соскоб буккального эпителия (с внутренней поверхности щеки).
Задача генетического исследования состоит в выявлении людей с высоким риском развития генетически детерминированного (предопределенного) рака. Это дает возможность предпринять усилия для снижения риска. Нормальные гены BRCA обеспечивают синтез белков, ответственных за защиту ДНК от спонтанных мутаций, способствующих перерождению клеток в раковые.
Пациентам с дефектными генами BRCA следует предохраняться от воздействия мутагенных факторов – ионизирующего излучения, химических агентов и др. Это позволит значительно снизить риск заболевания.
Генетическое исследование позволяет выявлять семейные случаи рака. Связанные с мутациями генов BRCA формы рака яичников и молочной железы обладают высокой степенью злокачественности – склонны к быстрому росту и раннему метастазированию.
Обычно, при исследовании гена BRCA1 он проверяется на наличие сразу 7 мутаций, каждая из которых имеет свое название: 185delAG, 4153delA, 3819delGTAAA, 2080delA, 3875delGTCT, 5382insC. Принципиальных отличий в этих мутациях нет – все они приводят к нарушению кодируемого этим геном белка, что ведет к нарушению его работы и повышению вероятности злокачественного перерождения клеток.
Результат анализа выдается в виде таблицы, где перечислены все варианты мутации, и для каждой из них указано буквенное обозначение вида:
- N/N – мутация отсутствует;
- N/Del или N/INS – гетерозиготная мутация;
- Del/Del (Ins/Ins) – гомозиготная мутация.
Наличие мутации гена BRCA говорит о значительном повышении риска развития у человека рака молочной железы, а также некоторых других видов рака – рака яичников, опухолей мозга, злокачественных опухолей простаты и поджелудочной железы.
Мутация встречается только у 1% людей, но ее наличие повышает риск возникновения РМЖ – при наличии гомозиготной мутации риск рака составляет 80%, то есть из 100 пациентов с положительным результатом в течение жизни у 80 разовьется рак. С возрастом риск онкологии увеличивается.
Выявление мутантных генов у родителей говорит о возможной передаче их потомству, поэтому детям, рожденным у родителей с положительным результатом анализа, также рекомендуется пройти генетическое обследование.
Отсутствие мутаций в гене BRCA1 не гарантирует того, что у человека никогда не возникнет РМЖ или яичников, так как существуют и другие причины развития онкологии. В дополнение к этому анализу рекомендуется исследовать состояние гена BRCA2, расположенного совершенно в другой хромосоме.
Положительный результат на мутации, в свою очередь, не свидетельствует о 100% вероятности развития рака. Однако наличие мутаций должно явиться причиной повышенной онконастороженности пациента – рекомендуется увеличить частоту профилактических консультаций у врачей, более внимательно следить за состоянием молочных желез, нужно регулярно сдавать анализы на биохимические маркеры рака.
При самых незначительных симптомах, свидетельствующих о возможном развитии рака, пациентам с выявленными мутациями гена BRCA1 следует срочно пройти углубленное обследование на онкологию, включающее исследование биохимических онкомаркеров, маммографию, УЗИ молочных желез и УЗИ малого таза, мужчинам – УЗИ простаты.
- Литвинов С.С., Гарькавцева Р.Ф., Амосенко Ф.А. и др. Генетические маркеры оценки риска развития РМЖ. // Тезисы ХII Российского онкологического конгресса. Москва. 18-20 ноября 2008 г. С.159.
- J. Balmaña et al.,Клинические рекомендации ESMO по диагностике, лечению и наблюдению у больных раком молочной железы с наличием BRCAмутации, 2010.
источник
Высокая заболеваемость раком заставляет онкологов ежедневно трудиться над вопросами ранней диагностики и эффективного лечения. Генетический анализ на рак – это один из современных способов профилактики онкозаболеваний. Однако, так ли достоверно это исследование и всем ли оно должно назначаться? – вопрос, который беспокоит и ученых, и врачей, и пациентов.
Сегодня генетический анализ на рак позволяет выявить риск развития онкопатологий:
- молочной железы;
- яичников;
- шейки матки;
- простаты;
- легких;
- кишечника и толстой кишки в частности.
Также, существует генетическая диагностика на некоторые врожденные синдромы, существование которых повышает вероятность развития рака нескольких органов. Например, синдром Ли-Фраумени говорит о риске рака мозга, надпочечников, поджелудочной железы и крови, а синдром Пейтца-Егерса говорит о вероятности онкопатологий пищеварительной системы (пищевод, желудок, кишечник, печень, поджелудочная железа).
На сегодня ученые обнаружили ряд генов, изменения в которых в большинстве случаев приводят к развитию онкологии. Ежедневно в нашем организме развиваются десятки злокачественных клеток, но иммунная система, благодаря особым генам, способна с ними справиться. А при поломках в тех или иных структурах ДНК, эти гены работают неправильно, что дает шанс развитию онкологии.
Так, гены BRCA1 и BRCA2 защищают женщин от развития рака яичников и молочных желез, а мужчин – от рака предстательной железы. Поломки в этих генах напротив показывают, что имеется риск развития карциномы данной локализации. Анализ на генетическую предрасположенность к раку как раз дает информацию об изменениях в этих и других генах.
Поломки в этих генах передаются по наследству. Всем известен случай Анджелины Джоли. В ее семье был случай рака молочной железы, поэтому актриса решила пройти генетическую диагностику, которая и выявила мутации в генах BRCA1 и BRCA2. Правда, единственное, чем смогли помочь врачи в этом случае – провести операцию по удалению груди и яичников, чтобы не было точки приложения для мутировавших генов.
Противопоказаний к сдаче данного анализа не существует. Однако, не стоит его делать в качестве рутинного обследования и приравнивать к анализу крови. Ведь не известно, как результат диагностики повлияет на психологическое состояние пациента. Поэтому назначаться анализ должен только при наличии строгих к тому показаний, а именно зарегистрированных случаев рака у кровных родственников или при имеющемся у пациента предраковом состоянии (например, доброкачественное образование молочной железы).
Генетический анализ достаточно прост для пациента, так как проводится путем одного забора крови. После кровь подвергается молекулярно-генетическому исследованию, что позволяет определить мутации в генах.
В лаборатории имеется несколько реактивов, специфичных для той или иной структуры. За один забор крови может проводиться обследование на поломки в нескольких генах.
Специальной подготовки исследование не требует, однако следовать общепринятым правилам при сдаче крови не помешает. К таким требованиям относится:
- Исключение алкоголя за неделю до диагностики.
- Не курить в течение 3-5 дней перед сдачей крови.
- За 10 часов до обследования не есть.
- В течение 3-5 дней до сдачи крови придерживаться диеты с исключением жирных, острых и копченых продуктов.
Наиболее изученным является обнаружение поломок в генах BRCA1 и BRCA2. Однако, с течением времени врачи стали замечать, что годы генетического исследования значительно не повлияли на смертность женщин от рака молочной железы и яичников. Поэтому в качестве скринингового метода диагностики (проводимого каждому человеку) метод не годиться. А как обследование групп риска генетическая диагностика имеет место.
Основной акцент анализа на генетическую предрасположенность к раку состоит в том, что при поломке в определенном гене человек имеет риск развития рака или же риск передачи этого гена своим детям.
Доверять или нет полученным результатам – личное дело каждого пациента. Возможно, не следует при отрицательном результате проводить превентивное лечение (удаление органа). Однако, если поломки в генах обнаружены, то пристально следить за своим здоровьем и регулярно проводить профилактическую диагностику определенно стоит.
Чувствительность и специфичность – это понятия, которые показывают достоверность теста. Чувствительность говорит о том, сколько процентов пациентов с дефектным геном будет выявлено данным тестом. А показатель специфичности говорит о том, что с помощью данного теста будет обнаружена именно та поломка гена, которая кодирует предрасположенность к онкологии, а не к другим заболеваниям.
Определить процентные показатели для генетической диагностики рака достаточно сложно, так как исследовать нужно много случаев положительных и отрицательных результатов. Возможно, позже ученые смогут дать ответ на данный вопрос, но уже сегодня можно с точностью утверждать, что обследование имеет высокую чувствительность и специфичность, и на его результаты можно полагаться.
Полученный ответ не может на 100% уверить пациента в том, что он заболеет или не заболеет раком. Отрицательный результат генетического тестирования говорит о том, что риск развития рака не превышает средних цифр в популяции. Положительный ответ дает более точную информацию. Так, у женщин с мутациями в генах BRCA1 и BRCA2 риск карциномы груди составляет 60-90%, а карциномой яичников – 40-60%.
Данный анализ не имеет четких показаний к сдаче, будь то определенный возраст или состояние здоровья больного. Если у матери 20-ти летней девушки был обнаружен рак молочной железы, то ей не стоит ждать 10 или 20 лет чтобы обследоваться. Рекомендовано тут же пройти генетическое исследование на рак, чтобы подтвердить или исключить мутацию генов, кодирующих развитие онкопатологий.
Касательно опухолей предстательной железы, каждому мужчине после 50 лет с аденомой простаты или хроническим простатитом полезно будет провести генетическую диагностику, чтобы так же оценить риск. А вот выполнять диагностику лицам, в семье которых не было случаев злокачественной болезни, скорее всего неуместно.
Вы не уверены в правильности поставленного диагноза и назначенного Вам лечения? Ваши сомнения поможет развеять видеоконсультация специалиста мирового уровня. Это реальная возможность воспользоваться квалифицированной помощью лучших из лучших и при этом ни за что не переплачивать.
Показанием к проведению генетического анализа на рак являются случаи выявления злокачественных новообразований у кровных родственников. А назначаться обследование должно врачом-генетиком, который после и оценит результат. Возраст пациента для сдачи теста не имеет никакого значения, так как поломка в генах заложена с рождения, поэтому если в 20 лет гены BRCA1 и BRCA2 в норме, то выполнять то же исследование через 10 и более лет смысла нет.
При правильном проведении диагностики каких-либо экзогенных факторов, которые могут повлиять на результат нет. Однако, у небольшого количества пациентов в ходе обследования могут обнаруживаться генетические поломки, интерпретация которых невозможна по причине недостаточной изученности. И в сочетании неизвестных изменений с мутациями в раковых генах, могут повлиять на результат тестирования (т.е. снижается специфичность метода).
Генетический анализ на рак – это не исследование с четкими нормами, не стоит надеяться, что пациент получит на руки результат, где будет четко написано “низкий”, “средний” или “высокий” риск развития рака. Результаты обследования могут оцениваться только врачом-генетиком. На окончательный вывод влияет история семьи пациента:
- Развитие злокачественных патологий у родственников до 50 лет.
- Возникновение опухолей одной и той же локализации в нескольких поколениях.
- Повторные случаи рака у одного и того же человека.
Сегодня подобная диагностика не оплачивается страховыми компаниями и фондами, поэтому все расходы пациент вынужден брать на себя.
В Украине исследование одной мутации стоит около 250 грн. Однако, для достоверности данных должно быть исследовано несколько мутаций. Например, для рака молочной железы и яичников исследуется 7 мутаций (1750 грн.), для рака легких – 4 мутации (1000 грн.).
В России генетический анализ на рак молочной железы и яичников стоит порядка 4500 руб.
источник
Одним из самых частых видов семейных опухолей является наследственный рак молочной железы (РМЖ), он составляет 5-10% от всех случаев злокачественного поражения молочных желез. Часто наследственный РМЖ связан с высоким риском развития рака яичника (РЯ). Как правило, в научной и медицинской литературе используют единый термин «синдром РМЖ/РЯ» (breast-ovarian cancer syndrome). Причем, при опухолевых заболеваниях яичника доля наследственного рака даже выше, чем при РМЖ: 10-20% случаев РЯ обусловлены присутствием наследственного генетического дефекта.
С предрасположенностью к возникновению синдрома РМЖ/РЯ связано присутствие у таких пациентов мутаций в генах BRCA1 или BRCA2. Мутации являются наследственными – то есть, буквально в каждой клетке организма такого человека есть повреждение, которое передалось ему по наследству. Вероятность возникновения злокачественного новообразования у пациентов с мутациями BRCA1 или BRCA2 к 70 годам достигает 80%.
Гены BRCA1 и BRCA2 играют ключевую роль в поддержании целостности генома, в частности в процессах репарации (восстановления) ДНК. Мутации, затрагивающие эти гены, как правило приводят к синтезу укороченного, неправильного белка. Такой белок не может правильно выполнять свои функции – «следить» за стабильностью всего генетического материала клетки.
Однако, в каждой клетке присутствует две копии каждого гена — от мамы и от папы, поэтому вторая копия может компенсировать нарушение работы клеточных систем. Но вероятность выхода ее из строя также очень высока. При нарушении процессов восстановления ДНК в клетках начинают накапливаться и другие изменения, которые, в свою очередь, могут привести к злокачественной трансформации и росту опухоли.
На базе лаборатории молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова применяется проведение поэтапного анализа для пациентов:
- сначала исследуется присутствие самых частых мутаций (4 мутации)
- при отсутствии таковых и клинической необходимости возможно проведение расширенного анализа (8 мутаций) и/или анализа полной последовательности генов BRCA1 и BRCA2.
 |  |
На данный момент известно более 2 000 вариантов патогенных мутаций в генах BRCA1 и BRCA2. Кроме того, данные гены являются довольно большими – 24 и 27 экзонов соответственно. Поэтому полный анализ последовательностей генов BRCA1 и BRCA2 является трудоемким, дорогостоящим и длительным по времени процессом.
Однако для некоторых национальностей характерен ограниченный спектр значимых мутаций (т.н. «эффект основателя»). Так в популяции российских пациентов славянского происхождения до 90% обнаруживаемых патогенных вариантов BRCA1 представлены всего тремя мутациями: 5382insC, 4153delA, 185delAG. Этот факт позволяет значительно ускорить генетическое тестирование пациентов с признаками наследственного РМЖ/РЯ.
Анализ последовательности гена BRCA2, выявление мутации c.9096_9097delAA
Национальная онкологическая сеть – National Comprehensive Cancer Network (NCCN) рекомендует направлять на генетическое исследование следующих пациентов:
- Пациенты до 45 лет с диагнозом рак молочной железы
- Пациенты в возрасте до 50 лет с РМЖ, если в семье есть хотя бы один близкий кровный родственник с таким диагнозом
- Также в том случае, если у пациента до 50 лет с РМЖ семейная онкологическая история неизвестна
- Если в возрасте до 50 лет диагностировано множественное поражение молочных желез
- Пациенты с РМЖ в возрасте до 60 лет — если по результатам гистологического исследования опухоль является трижды-негативной (отсутствует экспрессия маркеров ER, PR, HER2).
- При наличии диагноза рак молочной железы в любом возрасте — если присутствует хотя бы один из следующих признаков:
- не менее 1 близкой родственницы с РМЖ в возрасте менее 50 лет;
- не менее 2 близких родственниц с РМЖ в любом возрасте;
- не менее 1 близкой родственницы с РЯ;
- наличие не менее 2 близких родственников с раком поджелудочной железы и/или раком предстательной железы;
- наличие родственника-мужчины с раком грудной железы;
- принадлежность к популяции с высокой частотой наследственных мутаций (например, евреи Ашкенази);
- Все пациенты с диагностированным раком яичников.
- Если диагностирован рак молочной железы у мужчины.
- Если диагностирован рак простаты (с индексом по шкале Глисона >7) при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если диагностирован рак поджелудочной железы при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если рак поджелудочной железы диагностирован у уиндивидуума, принадлежащего к этносу евреев Ашкенази.
- Если у родственника обнаружена мутация BRCA1 или BRCA2
Выполнение молекулярно-генетического анализа должно сопровождаться генетическим консультированием, в ходе которого обсуждаются содержание, смысл и последствия тестирования; значение позитивного, негативного и неинформативного результатов; технические ограничения предлагаемого теста; необходимость информировать родственников в случае обнаружения наследственной мутации; особенности скрининга и профилактики опухолей у носителей мутаций и др.
Материалом для анализа является кровь. Для генетических исследований используют пробирки с ЭДТА (фиолетовая крышка). Сдать кровь можно в лаборатории НМИЦ или привезти из любой другой лаборатории. Кровь хранится при комнатной температуре до 7 дней.
 |  |
Особая подготовка к исследованию не нужна, на результаты исследования не влияют приемы пищи, прием лекарств, введение контрастных веществ и пр.
Пересдавать анализ через некоторое время или после лечения не потребуется. Наследственная мутация не может исчезнуть или появиться в течение жизни или после полученного лечения.
Для носителей патогенных мутаций разработан комплекс мероприятий по ранней диагностике, профилактике и терапии новообразований молочной железы и рака яичников. Если среди здоровых женщин своевременно выявить тех, у кого имеется генный дефект, есть возможность диагностировать развитие заболевания на ранних стадиях.
Исследователями были выявлены особенности лекарственной чувствительности BRCA-ассоциированных опухолей. Они хорошо реагируют на некоторые цитостатические препараты, и лечение может быть весьма успешным.
Для здоровых носителей BRCA-мутаций рекомендовано:
- Ежемесячное самообследование с 18 лет
- Клиническое обследование молочных желез (маммография или магнитно-резонансная томография) с 25 лет.
- Мужчинам-носителям мутации в генах BRCA1/2 рекомендовано проведение ежегодного клинического обследования грудных желез начиная с 35-летнего возраста. С 40 лет целесообразно выполнение скринингового обследования предстательной железы.
- Проведение дерматологического и офтальмологического осмотров c целью ранней диагностики меланомы.
Часто у носителей мутаций BRCA1/BRCA2 возникает вопрос – всем ли детям она передалась и какие генетические причины появления наследственной формы РМЖ? Шансы передать повреждённый ген потомству составляют 50%.
Заболевание одинаково наследуется, как мальчиками, так и девочками. Ген, связанный с развитием рака молочной железы и рака яичников, расположен не на половых хромосомах, поэтому вероятность носительства мутации не зависит от пола ребенка.
Если мутация в нескольких поколениях передавалась через мужчин, очень сложно проводить анализ родословных, так как мужчины довольно редко болеют РМЖ даже при наличии генного дефекта.
Например: носителями были дедушка и отец пациентки, и у них заболевание не проявилось. На вопрос, были ли случаи онкологических заболеваний в семье, такая пациентка ответит отрицательно. При отсутствии других клинических признаков наследственных опухолей (ранний возраст/множественность опухолей), наследственная составляющая заболевания может быть не учтена.
При обнаружении мутации BRCA1 или BRCA2 всем кровным родственникам рекомендуется также пройти тестирование.
Для многих этнических групп характерен свой набор частых мутаций. Национальные корни обследуемого необходимо учитывать при выборе глубины исследования.
Учеными было доказано, что для некоторых национальностей характерен ограниченный спектр значимых мутаций (т.н. «эффект основателя»). Так в популяции российских пациентов славянского происхождения до 90% обнаруживаемых патогенных вариантов BRCA1 представлены всего тремя мутациями: 5382insC, 4153delA, 185delAG. Этот факт позволяет значительно ускорить генетическое тестирование пациентов с признаками наследственного РМЖ/РЯ.
И, в заключение, наглядная инфографика «Синдром наследственного рака молочной железы и яичников». Автор — Кулигина Екатерина Шотовна, к.б.н., старший научный сотрудник Научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
Авторская публикация:
АЛЕКСАХИНА СВЕТЛАНА НИКОЛАЕВНА,
лаборант-исследователь научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
источник
В филиале МКНЦ имени А.С. Логинова «Маммологическом центре «Клиника женского здоровья» у вас появилась возможность сдать генетический анализ на предрасположенность к раку молочной железы .
Что важно знать о гене BRCA-1 и BRCA-2
В большинстве случаев онкологические заболевания являются наследственными и связаны с носительством мутаций в определенных генах, полученных от одного из родителей.
Одним из эффективных подходов, способствующих раннему выявлению рака молочной железы и рака яичников, является молекулярно-генетическое определение их наследственных форм. Данное исследование позволяет подтвердить наличие наследственной предрасположенности к развитию рака и сформировать группы повышенного риска развития для патогенетически обоснованной профилактики и/или ранней диагностики заболевания на начальном этапе развития.
Известно, что 5-10% случаев рака молочной железы и 10-17 % рака яичников являются наследственными и их развитие связано с мутациями в генах BRCA-1 и BRCА-2. По данным многочисленных исследований, ими обусловлены 20-50% наследственных форм рака молочной железы, 90-95% случаев наследственного рака яичников у женщин, а также до 40% случаев рака грудных желез у мужчин.
Что такое гены BRCA1 и BRCA2?
Известно, что большинство наследственных форм рака молочной железы связаны с генами BRCA1 и BRCA2 (BREAST CANCER GENES 1 и 2). Данные гены отвечают за регуляцию процессов восстановления генетического материала (ДНК) и предупреждают возможную опухолевую трансформацию клеток. Однако при наличии дефектов и мутаций в этих генах значительно повышается риск развития рака молочной железы и яичников.
5 фактов о гене BRCA-1 и BRCA-2
человек уже рождается с мутацией гена BRCA1 или BRCA2, изменить данный факт невозможно
не все носители этого гена заболеют раком
измененный ген можно унаследовать как от матери, так и от отца
вероятность передачи детям измененного гена BRCA составляет 50%
ген передается из поколения в поколение
Зачем мне нужен анализ на мутации генов BRCA1 и BRCA2?
Данный анализ поможет Вам узнать, унаследовали ли Вы генетическую мутацию, в связи с которойриск заболеть раком молочной железы и/или яичников повышается.
Выявление генетического дефекта у клинически здоровых женщин позволяет провести своевременную диагностику и профилактику развития рака молочной железы и/или яичников. Для пациенток, у которых опухоль уже возникла, обнаружение мутаций генов BRCA1 и BRCA2 позволяет определить ее наследственную природу и правильно подобрать лечение.
Как можно заподозрить наследственную форму рака молочной железы?
Большая вероятность того, что у Вас имеется наследственная предрасположенность к раку молочной железы, возможна при:
- Выявлении рака молочной железы в молодом возрасте (до 40 лет);
- Наличии прямых родственников (мать, бабушка, сестра, тетя) с материнской или отцовской стороны, у которых был выявлен рак молочной железы в возрасте до 50 лет;
- Наличии в Вашей семье родственницы с раком молочной железы и яичников;
- Случаях в Вашей семье множественного или двустороннегорака одной или обеих молочных желез;
- Если в Вашей семье был случай рака грудной железы у мужчины;
- При сочетанном раке (например, рак яичников и поджелудочной железы).
Как проводится анализ на мутации генов BRCA1 и BRCA2?
Анализ заключается в заборе небольшого количества крови из вены или заборе щечного эпителия. Специальной подготовки для исследования не требуется.
Что делать если анализ на мутации генов BRCA1 и BRCA2 оказался положительным?
Положительный результат свидетельствует о том, что Вы унаследовали дефект генов BRCA1 и BRCA2 и имеете предрасположенность к развитию некоторых видов рака (рака молочной железы, яичников, предстательной железы (у мужчин), кишечника, гортани и др.). Анализ указывает лишь на вероятность возникновения рака и не означает, что генетический дефект будет у всех кровных родственников. При обнаружении мутаций в генах BRCA1 и BRCA2 у женщины риск развития рака молочной железы и/или яичников составляет от 50 до 90%.
Положительный результат анализа – важная информация, которая позволяет как можно раньше предпринять профилактические меры и снизить вероятность развития онкологических заболеваний.
А если анализ на мутации генов BRCA1 и BRCA2 отрицательный?
Отрицательный результат вовсе не означает, что рак у Вас не возникнет. Это значит, что для Вас риск рака среднестатистический и не требует столь повышенного внимания к его профилактике, как в случае наличия данных мутаций. Ну и конечно же, отрицательный результат не отменяет таких общеклинических профилактических обследований как осмотр маммолога и маммография.
источник
Рак яичников (РЯ) — 5-я по частоте причина смертности от онкологических заболеваний среди женщин в США. Заболевание представлено гетерогенной группой новообразований, включающих разнообразные гистотипы: эндометриоидный, серозный, муци-нозный, светлоклеточный и другие редко встречающиеся варианты рака. Каждый морфологический вариант, по всей видимости, характеризуется различными мутациями.
Некоторые опухоли с одинаковым гистологическим строением часто имеют разное клиническое течение, возможно, вследствие разных генетических нарушений, приведших к их развитию. Требуются исследования для установления связи между молекулярными маркерами, гистотипами опухолей и их клиническим течением. На протяжении нескольких десятилетий не было единого мнения о том, характерна ли для рака яичников (РЯ) многоочаговость происхождения. Мок и соавт. опубликовали описание 9 случаев широко распространенного канцероматоза брюшины.
У каждого из больных характер экспрессии гена ТР53 был идентичен в опухолевых клетках, полученных из разных очагов, что свидетельствует о происхождении их от одного предшественника. Tsao и соавт. использовали для аналогичного исследования инактивацию Х-хромосомы и получили аналогичные результаты.
Опубликовано множество сообщений об активации различных онкогенов при раке яичников (РЯ). Описана гиперэкспрессия erb-b2 (HER-2/neu) как в сочетании с амплификацией гена, так и сама по себе. Slamon и соавт., используя блоттинг по Саузерну, выявили амплификацию erb-b2 в 26 % из 120 первичных злокачественных новообразований яичников. В 12 % случаев показана экспрессия erb-b2 без амплификации. Гиперэкспрессия erb-b2 коррелирует с неблагоприятным прогнозом, благодаря чему этот маркер можно использовать для определения терапевтической стратегии.
Baker и соавт. выявили амплификацию гена c-myc в 29 % случаев рака яичников (РЯ); в другом исследовании она обнаружена в 50 % случаев. Амплификация c-myc не выявляется в нормальной ткани яичников, доброкачественных аденомах и опухолях с низким злокачественным потенциалом, что свидетельствует о важной роли генетических нарушений в развитии злокачественных новообразований. Также описаны аномалии других онкогенов, в т. ч. делеции, амплификации и точечные мутации гена ras и гиперэкспрессия гена fos.
В канцерогенезе рака яичников (РЯ), вероятно, инактивируются гены-супрессоры. Sato и соавт. сообщили результаты исследования 37 опухолей яичников с различными ДНК-пробами и выявили аллельную утрату на хромосомах 6q, 13q и 19q при серозном раке. При опухолях муцинозного типа утраты аллелей отмечались реже. Sasano и соавт. описали гомогенные делеции гена RB в 1 из 24 случаев рака яичников (РЯ). Mazars и соавт. обнаружили мутации гена ТР53 в 36 % из 34 случаев рака яичников (РЯ); большинство мутаций выявлены в экзонах 5 и 7.
Marks и соавт. исследовали экспрессию гена ТР53 более чем в 100 опухолях яичников и более чем в 50 % случаев обнаружили высокий уровень мутантного белка Тр53, хотя в некоторых гистологических образцах опухолевой ткани он не выявлялся. Гиперэкспрессия белка Тр53 четко коррелирует с наличием мутации гена ТР53 в опухоли. Эти исследования свидетельствуют, что мутации и делеции гена ТР53 играют важную роль в развитии и прогрессии некоторых форм рака яичников (РЯ).
Данные, изложенные выше, в первую очередь касаются генетических нарушений в соматических клетках во время развития и прогрессии опухолей. Первичные генетические факторы служат непосредственной причиной рака лишь примерно в 5 % случаев. В настоящее время прилагаются значительные усилия для выделения и клонирования наиболее важных генов. Ген BRCA1 имеется во всех клетках организма, и его мутации связаны с развитием заболевания в некоторых семьях с множественными случаями РЯ. В 1995 г. опубликованы объединенные результаты нескольких исследовательских центров по всему миру.
Мутации гена BRCA1 были выявлены в 9 (6 %) из 145 семей с повышенной частотой множественных случаев рака яичников (РЯ) и рака молочной железы (РМЖ).
Это свидетельствует, но не доказывает, что поврежденные или мутантные формы (на сегодня идентифицировано 50 мутаций) нормального гена BRCA1 могут передаваться в этих семьях из поколения в поколение, а повреждения BRCA1 могут вызывать у женщин предрасположенность к развитию РМЖ и РЯ. Результаты исследований также показывают, что в семьях, в которых заболевание не связано с нарушениями BRCA1, развитие рака яичников (РЯ) может быть обусловлено другими, пока что не идентифицированными генами. Ген BRCA1 был выделен в сентябре 1994 г., что позволило определить специфические изменения, связанные с развитием семейных случаев опухолей.
Также появилась возможность для выявления в таких семьях лиц с изменениями BRCA1, но без заболевания. Риск РЯ или РМЖ у этих женщин очень высок. В то же время о риске этих заболеваний у членов семей, не имеющих унаследованных нарушений гена BRCA1, ничего неизвестно. Таким образом, исследование гена BRCA1 в семьях с предрасположенностью к злокачественным новообразованиям поможет лучше оценить риск у отдельных членов семей. В 1995 г. идентифицирован второй ген, ассоциированный с РМЖ и РЯ, — BRCA2. Наличие мутаций этого гена повышает риск РЯ на протяжении жизни до 10 — 20 %. В настоящее время продолжается изучение этого гена.
Основная задача исследований в будущем — определить влияние, которое оказывают известные мутации генов на риск заболеваний, и их прогноз. Учитывая ограниченный опыт генетического тестирования на рак и неоднозначность результатов, American Society of Human Genetics рекомендует проводить генетические исследования только некоторым членам семей с высокой частотой развития РЯ и РМЖ. Эту работу должны выполнять специалисты, знакомые с генетическими, клиническими и психологическими особенностями тестирования и осознающие его пределы и возможности. Важно, чтобы обследуемые пациенты были подробно проинформированы, а результаты служили пониманию значимости выявленных нарушений.
источник
Академический редактор: Стефан Римбач
Более одной пятой опухолей яичников имеют наследственную восприимчивость, а в 65-85% случаев генетическая аномалия является мутацией зародышевой линии в генах BRCA. Тем не менее, несколько других генов-супрессоров и онкогенов были связаны с наследственными раковыми заболеваниями яичников, включая гены восстановления рассогласования (MMR) синдромом Линча, геном супрессора опухоли, TP53, синдромом Ли-Фраумени и несколькими другими генами, участвующими в двойном -strand разрывает систему ремонта, такую как CHEK2, RAD51, BRIP1 и PALB2. Изучение генетических дискриминаторов и дерегулированных путей, вовлеченных в наследственные синдромы яичников, актуально для будущего развития молекулярных диагностических стратегий и целенаправленных терапевтических подходов. Недавняя разработка и внедрение технологий секвенирования следующего поколения предоставили возможность одновременно анализировать множественные гены восприимчивости к раку, уменьшать задержку и затраты и оптимизировать молекулярную диагностику наследственных опухолей. В частности, идентификация мутаций в генах восприимчивости к овариальному раку у здоровых женщин может привести к более персонализированному управлению рисками рака с помощью специализированного клинического и радиологического надзора, химиопревентивных подходов и / или профилактических операций. С другой стороны, для пациентов с раком яичников идентификация мутаций может обеспечить потенциальные мишени для биологических агентов и принятие решения о лечении.
Рак яичников является ведущей причиной смертности от рака среди гинекологических злокачественных новообразований, во всем мире насчитывается около 225 000 новых случаев рака (3,7% всех случаев рака среди женщин) и около 140 000 смертей (4,2% от всех смертей у женщин) с каждым годом [1]. В Соединенных Штатах в 2014 году ожидалось 21 980 предполагаемых новых случаев и 14 270 предполагаемых смертей [2]. Отсутствие эффективных стратегий раннего выявления и неблагоприятная анатомия связаны с продвинутой стадией диагностики и плохим прогнозом, часто встречающимся у пациентов с раком яичников. Таким образом, общая выживаемость (ОС) является наихудшей среди всех гинекологических злокачественных новообразований с пятилетней относительной выживаемостью 44% для всех стадий во всех расах [2].
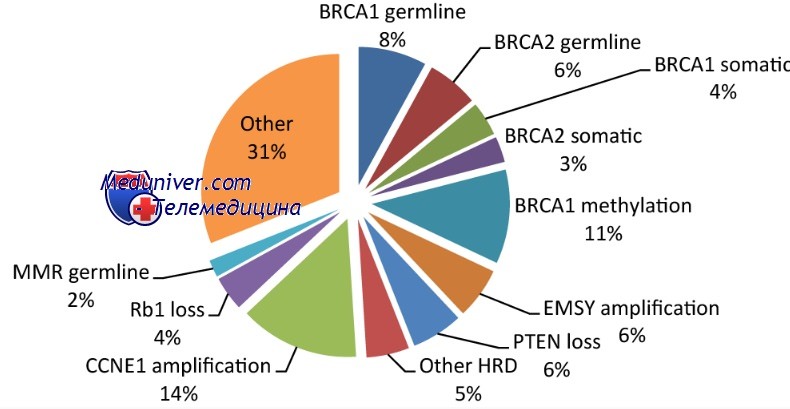
Более 1/5 (около 23%) карциномы яичников связаны с наследственными состояниями [3]. В частности, около 65-85% наследственных опухолей яичников генетическая аномалия представляет собой мутацию зародышевой линии в генах BRCA, которая вызывает дефекты восстановления ДНК. Мутанты BRCA1 и BRCA2 обладают повышенным риском развития рака молочной железы и яичников (до 85% для рака молочной железы и до 54% для рака яичников), а также рака поджелудочной железы и предстательной железы [4-8]. Тем не менее, несколько других генов-супрессоров и онкогенов были связаны с наследственным раком яичников (т. Е. TP53, BARD1, CHEK2, RAD51 и PALB2 [3, 9-11]). На сегодняшний день известно, что, по меньшей мере, 16 генов участвуют в механизме наследственного опухолеобразования яичников, а некоторые другие мутации остаются неизвестными и не могут быть обнаружены специальными тестами [12] (рисунок 1).
Идентификация мутации в генах восприимчивости к раку яичников представляет собой фундаментальный шаг в диагностике и лечении этих опухолей. Прежде всего, обнаружение специфического мутированного гена у здоровых женщин может оправдать более интенсивные и персонализированные программы эпиднадзора, химиопревентивные подходы и / или профилактическую операцию, которые в противном случае не были бы оправданы только семейной историей. Более того, идентификация мутации у уже затронутых пациентов может дать фундаментальные знания о патогенезе их опухолей. Поэтому эта генетическая оценка при диагностике может помочь определить потенциальные целевые показатели для конкретных лекарств, то есть ингибиторы PARP и алкилирующие агенты, а также для руководства принятием решений по стратегиям лечения. В этом контексте технологии секвенирования следующего поколения (NGS) недавно предоставили беспрецедентную возможность одновременно анализировать множественные гены восприимчивости к раку, уменьшать задержки и затраты и оптимизировать молекулярную диагностику наследственного рака яичников.
Мы рассмотрели доступные опубликованные данные о молекулярных путях, участвующих в патогенезе не-BRCA наследственного рака яичников, и о возможных применениях технологий NGS в этих наследственных синдромах рака.
Рак яичников является гетерогенным заболеванием, которое включает в себя различные биологические поведения на клиническом и молекулярном уровне. Более 90% случаев рака яичников являются эпителиальными, а около 10% рака яичников развиваются из зародышевых клеток или клеток гранулоза-тека. Эпителиальные опухоли могут возникать из эпителия яичника, но также могут возникать из фаллопиевой трубки, очагов эндометриоза или брюшины [13]. Четыре основных гистотипа характеризуют эпителиальный овариальный рак: серозную, эндометриоидную, муциновую и ясную клетку. Интересно, что каждый гистотип показывает закономерности экспрессии генов, которые коррелируют с их морфологическими аналогами в нормальных тканях. В частности, изменения в серозных опухолях коррелировали с изменениями в нормальной фаллопиевой трубке, муцинозным раком, коррелированным со слизистой оболочкой нормальной толстой кишки, и как эндометриоидные, так и ячеистые гистотипы коррелировали с изменениями нормального эндометрия [14].
Недавно были предложены две новые гипотезы для патогенеза серозного рака яичников. Согласно первому механизму, предшественники рака яичников развиваются в фимбрии из оккультной серозной трубчатой внутриэпителиальной карциномы (STIC), и только впоследствии они включают яичник. Вторая теория поддерживает имплантацию нормального эпителия из фимбрии на поверхность яичника во время овуляции, что приводит к появлению кисты коры головного мозга (CIC), где может возникнуть злокачественная трансформация [15, 16].
На молекулярном уровне спорадический рак яичников характеризуется широкой генетической нестабильностью, связанной с модуляцией нескольких генов. Согласно клиническому поведению и молекулярно-генетическим аномалиям, рак яичников можно разделить на два разных типа (таблица 1). Опухоли типа I включают низкосортные серозные карциномы, пограничные серозные опухоли, низкосортные эндометриоиды и муциновые и ячеистые карциномы [15, 17]. Эти виды опухолей относительно генетически устойчивы, и наиболее частые мутации включают KRAS, BRAF, ERBB2, PTEN, PIK3CA, b-catenin ген (CTNNB1), ARID1A и PPP2R1A. С другой стороны, рак яичников II типа включает высокосортные серозные карциномы, карциносаркомы и недифференцированные раковые заболевания. Опухоли II типа, которые составляют почти 70% всех эпителиальных опухолей, являются агрессивными и присутствуют на поздних стадиях. Во время презентации они проявляют высокую геномную нестабильность, и до 95% пациентов ген, мутированный, является TP53. Более того, этот тип опухоли характерен для носителей мутаций BRCA1 и BRCA2 и в основном возникает из STIC [15, 17].
В середине 1960-х годов Линч и его коллеги описали аутосомно-доминантный наследственный синдром, который предрасполагает молодых людей (средний возраст 45 лет), не затронутых аденоматозными полипами толстой кишки, для развития колоректального рака с пристрастием, близким к селезенному изгибу [18, 19]. Последующие публикации о синдроме сообщили, что члены этих семей также были склонны к излишествам внеколистных раков, включая карциному эндометрия, яичника, желудка, тонкой кишки, гепатобилиарного тракта, поджелудочной железы, почечного лоханки, мочеточника, молочной железы, предстательной железы и головного мозга ( особенно глиобластомы) [20-22].
Синтез Линча (LS), также известный как наследственный неопластический рак толстой кишки (HNPCC), составляет 10-15% всех наследственных раковых заболеваний яичников [23]. Совокупный риск жизни рака яичников оценивается в 6-10% у доказанных или вероятных носителей мутаций MSH2 и MLH1 со средним возрастом наступления 51 года в семьях, связанных с мутациями MLH1, и 45 лет в семьях, связанных с мутациями MSH2 [ 24-26]. С клинической точки зрения, раковые заболевания яичников в ЛС являются в основном эндометриоидными или прозрачными клетками [27-31], а опухоли менее развиты на момент постановки диагноза, демонстрируя поразительно высокие показатели выживаемости по этапам [24, 32, 33] , В частности, Vierkoetter и coinvestigators обнаружили, что пациенты в возрасте до 53 лет с язвенной или эндометриоидной карциномой яичников подвергаются клинически значимому риску потери экспрессии мРНК и НС, что предполагает, что рутинное скрининг с иммуногистохимическим окрашиванием у этих пациентов должно следует рассмотреть [34].
LS определяется мутациями зародышевой линии в генах MMR (MLH1, MSH2, MSH6, MLH3 и PMS2), которые приводят к потере экспрессии одного из белков MMR. В LS один мутированный аллель гена MMR наследуется, а потеря второй аллели происходит соматически из-за мутации, метилирования или комбинации обоих. Редкий случай, когда оба унаследованных аллеля мутируются, называется «конституционным синдромом дефицита MMR» и приводит к раку в детстве [35]. Система восстановления рассогласования (MMR) вместе с базовым иссечением (BER) и системой восстановления иссечения нуклеиновой кислоты (NER) является механизмом восстановления ДНК, используемым для удаления однонитевых разрывов. С другой стороны, двунитевые разрывы корректируются с помощью гомологичной рекомбинации (HR) и негомологичного концевого соединения (NHEJ) (рис. 2) [8]. Неудача системы MMR, которая возникает в семьях с LS, приводит к накоплению повторяющихся нуклеотидных последовательностей, фенотипически выраженных как микросателлитная нестабильность (MSI). Микросателлиты представляют собой короткие тандемные (1-6 пар оснований) повторяющиеся последовательности ДНК с высокой восприимчивостью к ошибкам репликации. Несколько онкогенов и генов-супрессоров опухолей содержат микросателлиты, включая гены восстановления TGFβR2, IGFIIR, BAX и ДНК с двойной цепью (DSB), такие как Mre11 и RAD50. Следовательно, нарушение MMR может вызвать мутации во многих генах, вовлеченных в опухолегенез [36-40].
Тем не менее, канцерогенез при раковых заболеваниях яичников, связанных с LS, не был полностью объяснен за пределами описания дефектов MMR. Недавно Нискакоски и его коллеги [41] исследовали 107 опухолей яичников (20 из LS и 87 спорадических), чтобы получить информацию о опухолевом генезе яичников и проанализировать молекулярные изменения, которые различаются между LS и спорадическим раком яичников. Как описано выше, LS-ассоциированные раковые заболевания яичников были более вероятными при диагнозе быть низкосортными, ранними стадиями, ранним началом и обычно имели более общий прогноз. Все 20 LS-ассоциированных карциномы яичников не проявляли мутаций на TP53, KRAS (экзон 2) или BRAF (V600E), тогда как при спорадических карциномах яичников TP53 часто был аномальным (сверхэкспрессированным или полностью отсутствующим) и мутациями KRAS (экзона 2) произошло с частотой 8%. На самом деле, сверхэкспрессия TP53 при раке яичников связана с плохим прогнозом, гистологией высокого класса и продвинутыми стадиями диагностики [42]. Интересно, что частоты мутаций PIK3CA были сходными в эндометриоидных и явных карциномах клеток у пациентов с ЛС (32%) по сравнению с их спорадическими аналогами (36%). Частота мутаций PIK3CA в LS-ассоциированных карциномах яичников соответствует зарегистрированной высокой выживаемости, поскольку недавние данные свидетельствуют о том, что мутации PIK3CA и активация пути PI3K / AKT связаны с благоприятным прогнозом при раке яичников [43]. Эти данные показали, что рак яичников, по-видимому, напоминает колоректальные раковые заболевания от носителей LS, которые связаны с более высокой стадией выживаемости [44] и меньшими аномалиями ТР53 и BRAF по сравнению с спорадическими опухолями [45] и мутациями PIK3CA примерно в 20% случаев [ 46]. Кроме того, Нискакоски и его коллеги [41] обнаружили различия в анализе ингибитора циклинзависимой киназы 2B (CDKN2B) и длинного вкрапленного нуклеотидного элемента 1 (LINE1). Гипометилирование CDKN2B и LINE1 было значительно увеличено при спорадическом раке яичников по сравнению с случаями LS. Поскольку LINE1 играет важную роль на продвинутых стадиях рака яичников, этот результат согласуется с лучшим прогнозом, показанным LS-ассоциированным раком яичников [47].
Совсем недавно Джонссон и его коллеги [48] провели глобальный анализ экспрессии генов на 24 LS-ассоциированных и 24 спорадических опухолях яичников с целью идентификации профилей экспрессии генов и генетических дискриминаторов, связанных с LS. Наиболее часто вырабатываемые гены в LS включали PTPRH, BIRC3, SHH и TNFRSF6B. Гены, участвующие в основном, были связаны с ростом клеток, пролиферацией и передачей сигналов от клетки к клетке. С другой стороны, иммуногистохимическое окрашивание показало положительность для p-mTOR в 60% опухолей LS, EGFR в 30% опухолей LS и потеря PTEN у 74% опухолей LS. Более того, мутации в KRAS и BRAF, которые могут активировать путь mTOR / PI3K / AKT, распространены в низкосортных раковых заболеваниях яичников (60%) [49, 50].
Изучение генетических дискриминаторов и дерегулированных путей, связанных с LS-ассоциированным опухолевым генезом яичников, может быть актуальным для будущего развития молекулярной диагностики и целенаправленной терапии. К сожалению, с учетом относительной редкости LS-ассоциированного наследственного рака яичников размеры выборки в этих исследованиях были небольшими и необходимо подтверждение в более крупной серии. Более того, другие общие ограничения этих исследований могут быть связаны с методами, используемыми для анализа, включая иммуногистохимию и генетическое тестирование на ткани, связанные с парафином.
Синдром Li-Fraumeni (LFS) представляет собой аутосомно-доминантный раковый синдром, определяемый гетерозиготными мутациями зародышевой линии в генах супрессора опухоли TP53 (хромосома 17p13). TP53 кодирует фактор транскрипции, активированный в ответ на различные сигналы напряжения, и участвует в клеточной пролиферации, апоптозе и геномной стабильности. Он представляет собой наиболее часто мутированный ген в раке человека с наибольшей распространенностью приобретенных мутаций в эпителиальном яичнике (47%), колоректальном (43%), голова / шея (42%) и раке пищевода (41%) [51, 52]. Из-за своей всеобъемлющей роли гена-супрессора рака TP53 также определяется как «хранитель генома» [53]. Наиболее распространенной мутацией, наблюдаемой в зародышевой линии и спорадических случаях, является миссенс-мутация (около 75%), что приводит к дефектной транскрипционной активности. Опухоли, полученные из приобретенных мутаций TP53, характеризуются худшими показателями выживаемости, повышенной резистентностью к химиотерапии и радиации и повышенной частотой рецидивов [54-56].
Ли и Фраумени-младший впервые предложили в 1969 году теорию наследственного ракового синдрома, характеризующуюся ранним развитием множественных опухолей [57]. В частности, около 50% пациентов с ОРС развивают первую опухоль в возрасте 30 лет [58, 59], и почти у одной трети (15-35%) из них будут развиваться множественные первичные виды рака в течение их жизни [60, 61]. Рак молочной железы, саркома и мозг и адренокортикальная карцинома представляют собой около 77-80% опухолей, связанных с LFS. Менее частые злокачественные новообразования, связанные с ЛС, включают лейкемию и легкие, колоректальный, кожный, желудочный и яичниковый рак, и на них приходится 15% опухолей [62]. Тем не менее, эти менее частые опухоли присутствуют в общей популяции; таким образом, их присутствие в семьях LFS может быть из-за случайности. С другой стороны, в контексте мутации ТР53 зародышевой линии эти опухоли встречаются в раннем, чем ожидалось, медианном возрасте при постановке диагноза. В частности, для рака яичников средний возраст составляет 39,5, по сравнению с 64,3 года для спорадических случаев [63]. Отсутствие всесторонних исследований в отношении генетических путей, связанных с опухолевым генезисом, связанным с LFS, главным образом обусловлено крайней редкостью этого синдрома у населения в целом.
Как описано выше, двухнитевые разрывы (DSB) восстанавливаются путем гомологичной рекомбинации (HR) и негомологичного концевого соединения (NHEJ) (фиг. 2). HR обеспечивает точную рекомбинацию с использованием сестринской хроматиды в качестве матрицы, которая поддерживает геномную стабильность. Несколько белков широко участвуют в кадровой системе, включая белки BRCA1 / 2, ATM, CHEK2, RAD51 и Fanconi (BRIP1 [64] и PALB2 [65]) (рисунок 3) [66]. В частности, DSB активируют киназы ATM, ATR и CHEK2, которые, в свою очередь, фосфорилируют BRCA1, модулируя его функцию. Роль BRCA1 в репарации ДНК и в регуляции клеточного цикла заключается в том, чтобы остановить остановку фазы G1-S, S или G2-M в зависимости от фосфорилированных остатков. BRCA1 образует комплекс с BARD1, белком со структурным сходством, что важно для стабильности BRCA1. Недавно было обнаружено, что комплекс BRCA1-BARD1 играет роль в ubiquitination и деградации РНК-полимеразы II, ингибируя транскрипцию и обработку РНК, чтобы исключить преждевременно прекращенные транскрипты и очистить поврежденную область ДНК для вмешательства репарационных ферментов ДНК , Параллельно BRCA2 участвует в ремонте DSB, модулирующих рекомбиназную функцию RAD51. BRCA2 необходим для транспортировки RAD51 в ядро и в место повреждения ДНК, где RAD51 высвобождается с образованием нуклеопротеиновой нити, необходимой для рекомбинации [67-69].
С другой стороны, хотя и менее точный, NHEJ играет решающую роль в минимизации повреждения ДНК как в фазах G0, так и в G1 клеточного цикла, когда HR не может быть поставлен. Однако, когда дефект встречается у одного из ферментов, участвующих в HR, DSB восстанавливаются механизмами, подверженными ошибкам, в основном NHEJ, что приводит к увеличению риска возникновения новых хромосомных дефектов и, следовательно, развитию рака [70]. На первом этапе NHEJ гетеродимер Ku70 / Ku80 разрушает концы ДНК и улучшает стабильность ферментов, связанных с NHEJ, на концах ДНК. Два гетеродимера Ku70 / Ku80 рекрутируют ДНК-зависимые протеинкиназы (ДНК-PKcs) до конца ДНК. Полученный комплекс ДНК-PKcs и его субстрата Artemis показал активность эндонуклеазы; поэтому он обрабатывает ДНК-терминалы, чтобы подготовить их к вмешательству XRCC4-лигазы IV. Функции нуклеазы Артемиды, по-видимому, выполняются комплексом RAD50, Mre11 и NBS1, где модели in vitro показали, что они взаимодействуют также с гомологами Ligase IV и Ku (рис. 4) [71].
Как упоминалось выше, несколько белков взаимодействуют и взаимодействуют с белками BRCA1 и BRCA2 в процессе восстановления ДНК и, следовательно, в поддержании геномной стабильности. Было высказано предположение, что гены, кодирующие эти белки, будут альтернативными кандидатами на восприимчивость к овариальному раку. В частности, опухоли с дефектом в системе HR, отличные от BRCA, выражают профиль BRCAness. Эти опухоли представляют специфический фенотип с особенностями и поведением, сходными с раковыми заболеваниями, связанными с BRCA [8], включая чувствительность к агентам, разрушающим ДНК (например, платину), улучшенные безрецидивные интервалы и выживаемость и высокосортную серозную гистологию [ 72, 73]. Интересно, что эти пациенты BRCAness подвергаются повышенному риску как для рака яичников, так и для молочных желез, как и для носителей BRCA. Ниже перечислены основные гены, связанные с синдромом BRCAness при раке яичников.
Loveday и его коллеги [74] определили усечение мутаций RAD51D у 8 из 911 семейных родословных рака молочной железы яичника, демонстрируя, что мутации RAD51D дают шестикратный повышенный риск развития рака яичников, но вызывают лишь небольшое увеличение рака молочной железы. Аналогично, Meindl and associates [75] проанализировали 1100 немецких семей с гинекологическими злокачественными новообразованиями и определили 6 моноаллельных патогенных мутаций в RAD51C, которые придают повышенный риск как рака груди, так и яичников. Наконец, Бланко и его коллеги [76] недавно провели скрининг большой серии из 516 пациентов с BRCA1 / BRCA2-отрицательными из семейств рака молочной железы и / или яичников для мутаций RAD51C и определили 3 патологические мутации зародышевой линии. Эти результаты подтвердили, что RAD51C способствует восприимчивости к овариальному раку в семьях с заболеваниями молочной железы и яичников.
Мутации PALB2 были обнаружены в 1-4% семейств, отрицательных для мутаций BRCA [77]. Известно, что унаследованные мутации в BRCA2-взаимодействующем белке PALB2 связаны с повышенным риском рака молочной железы, поджелудочной железы и, вероятно, рака яичников. Недавно Casadei и его коллеги секвенировали кодирующие последовательности и фланкирующие регуляторные области PALB2 из конституционной геномной ДНК из 1444 семейных пациентов с раком молочной железы BRCA1 / BRCA2. Гетерозиготы PALB2 в четыре раза чаще имели родственников мужского пола с раком молочной железы (P = 0,0003), в шесть раз чаще имели родственника с раком поджелудочной железы (P = 0,002) и в 1,3 раза чаще имели родственника с яичником рак (P = 0,18) [10]. В целом, значительно меньше овариального рака наблюдается в семьях PALB2 по сравнению с семьями BRCA1 и BRCA2; поэтому остается неизвестным, действительно ли повышается риск развития рака яичников у лиц, которые являются носителями мутаций PALB2 или нет [77].
Кроме того, несколько групп ранее проанализировали роль мутаций CHEK2 в канцерогенезе рака яичников. В частности, missense вариант CHEK2 I157T был значительно связан с цистаденом яичников, пограничными опухолями яичников и низкосортными инвазивными раковыми опухолями, но не с высоким уровнем рака яичников [78]. В другом исследовании Baysal и его коллеги [79] определили варианты del1100C и A252G CHEK2, но поскольку различия в частоте варианта не были статистически значимыми по сравнению с контролем, было сделано заключение, что вариации CHEK2 не связаны с патогенезом рака яичников. Несколько лет спустя Крылова и его коллеги [80] также не смогли продемонстрировать связь между CHEK2 1100delC и патогенезом рака яичников. Тем не менее, эти анализы были в основном сосредоточены на некоторых конкретных вариантах CHEK2 (del1100C, A252G и I157T); поэтому мутации других областей ЧЕК2 и их связь с патогенезом рака яичников все еще необходимо детально изучить [81].
Комплекс Mre11 состоит из белков Mre11, NBS1 и RAD50 и представляет собой важнейший компонент в процессе восстановления ДНК. Хейккинен и его коллеги [82] провели обследование 151 семьи с признаками наследственной рака груди и / или яичников для мутаций зародышевой линии в генах комплекса Mre11. В этом исследовании сообщалось о трех возможных мутациях, связанных с болезнью: Mre11 913C> T (Arg305Trp), NBS1 448C> T (Leu150Phe) и RAD50 687delT (стоп-кодон при 234). Эти три мутации в генах комплекса Mre11 также могут быть связаны с наследственной восприимчивостью к раку молочной железы и яичников.
Ратайска и его коллеги [83] провели скрининг 109 пациентов BRKA1 / 2 с высоким риском развития рака молочной железы и / или яичников из северо-восточной Польши для мутаций зародышевой линии BARD1 и определили три различных варианта BARD1, предположительно патогенных (c.1690C> T, p. Gln564X, c.1315- 2A> G; c.1977A> G). Это исследование показало, что вредные мутации в BARD1 могут отвечать за определенную долю семейного рака молочной железы и / или яичников.
Примерно 23% карциномы яичников связаны с наследственными состояниями и более 15% наследственных раковых заболеваний яичников происходят из генетического состояния, не связанного с генами BRCA [3]. В частности, было идентифицировано несколько генов, вовлеченных в механизм наследственного опухолевого генеза яичников, но некоторые мутации все еще остаются неизвестными и не могут быть обнаружены с помощью конкретных тестов.
Идентификация мутаций в генах восприимчивости к раку яичников имеет фундаментальную роль как в профилактических условиях, так и после диагностики рака яичников при выборе методов лечения. В здоровых мутационных носителях наличие одной из этих мутаций может служить оправданием более интенсивного эпиднадзора, химиопревентивных подходов [84, 85] и / или профилактических операций [86], которые в противном случае не были бы обоснованы только семейной историей. В этой конкретной ситуации кандидаты на генетическое тестирование должны быть идентифицированы в соответствии с их личной и семейной историей рака яичников.
источник