Определение жесткости воды в современном мире – это обязательное условие для обеспечения работоспособности всей техники, работающей с ней. Тем не менее нельзя сказать, что такая жидкость действительно вредна для человека. Всего должно быть в меру, ведь излишне мягкая вода наносит не меньше ущерба здоровью, чем жесткая.
Начинать всегда следует с самых азов, чтобы было полное понимание проблемы. В нашем случае, прежде чем приступать к определению жесткости воды, сначала нужно понять, что она собой представляет. По результатам экспертизы, проведенной в 2011 на кафедре химии и экологии Новгородского университета им. Ярослава Мудрого, для природной натуральной воды жесткость является абсолютно нормальным явлением. Вплоть до момента появления современной техники этот вопрос вообще мало кого интересовал, тысячелетиями люди спокойно употребляли ее в том виде, в котором она есть. Придают воде жесткость растворенные в ней соли магния и кальция. Само понятие жесткости возникло по результатам ощущения людей, так как когда насыщенная этими солями и другими элементами вода вступает во взаимодействие с мылом, пена практически не образуется, затрудняя стирку или мытье.
Прежде чем понять, какую воду пить, следует учитывать тот факт, что жесткость не является однородной величиной. Есть как минимум две основные разновидности:
Зависят эти виды от типа растворенных солей, которые в любой жесткой воде присутствуют всегда вместе, составляя общую жесткость. Тем не менее разделять их можно и нужно. Временная жесткость напрямую зависит от наличия бикарбонатных и гидрокарбонатных анионов. Главная их особенность – разложение во время кипячения. В результате распада получается непосредственно сама вода, углекислый газ и карбонат кальция, который уже практически не растворяется. Получается, что от временной жесткости можно без особых проблем избавиться при помощи простого поднятия температуры воды до +100 градусов. В качестве примера можно привести любой чайник. После продолжительного использования можно обнаружить внутри осадок, который и является результатом описанного выше процесса распада. Все же, что не разлагается подобным образом, относится к постоянной жесткости, избавиться от которой без специальной обработки практически невозможно.
Это необходимо для того, чтобы понимать, какую воду пить можно без опаски, а также для того, чтобы любая техника, взаимодействующая с водой, не вышла из строя. Для человека излишне жесткая вода вредна. Но даже если этот параметр будет находиться на приемлемом для нашего организма уровне, все равно оборудование это не устроит. Аквариумы, кофейные, стиральные и посудомоечные машины, чайники, мультиварки и множество других вариантов техники требует воду строго определенной жесткости. Обычно справиться с этим помогают фильтры типа «Гейзер-3», однако зачастую такая мера может даже считаться излишней. Прежде чем тратить на них деньги, рекомендуется сначала провести тест на жесткость воды, ведь вполне возможно, что этот показатель и так на нормальном уровне.
Как уже было сказано выше, в первую очередь ущерб человеку наносит не какой-то определенный тип воды, а полное отсутствие баланса в организме.
- Плохое растворение пищевых продуктов (связано с катионами Ca 2 + и Mg 2 +).
- Кофе, чай и любые другие подобные напитки завариваются очень плохо.
- При длительном употреблении возможно расслабление желудка.
- Жесткая вода может стать причиной образования камней в почках.
- Насыщает организм требуемыми ему элементами.
- Улучшает состояние зубов, уменьшает вероятность возникновения кариеса.
- Жесткая вода является причиной поломки большинства видов техники.
- Выводит шлаки, но попутно вымывает полезные элементы (калий, магний и кальций). В результате кости становятся более хрупкими. Также не лучшим образом воздействует на сердечно-сосудистую систему.
- Негативно воздействует на гипофиз-адреналиновую систему.
- Оказывает плохое влияние на водно-солевой баланс организма.
Таким образом, определение жесткости воды должно производится не с целью избавиться от нее, а для того, чтобы свести негативное воздействие к минимуму и привести употребление такой жидкости к требуемому организмом балансу.
Согласно ГОСТу, питьевая вода должна проверяться на жесткость строго в лаборатории, посредством титриметрического анализа. Для этого сначала необходимо взять пробы, объем которых должен быть не менее 400 кубических сантиметров (0,4 литра). В качестве емкости, в которой будет производиться хранение, может использоваться любая тара, если она изготовлена из стекла или полимерного материала. Очень важно провести анализ не позднее чем через 24 часа после отбора пробы. В особых случаях, когда необходимо увеличить этот срок, производится подкисление жидкости посредством добавления соляной кислоты. В таком состоянии она может храниться уже около 1 месяца.
Среди всех методов определения жесткости воды данный вариант заслуженно считается самым достоверным и комплексным. В его основе лежит процесс образования соединений трилона вместе со щелочноземельными элементами ионов. Минимальный показатель жесткости, который поддается определению при помощи этого способа, – 0,1 о Ж (нормой считается 7-10 о Ж). В качестве пробы может быть использована обычная вода из-под крана. Лучшим выходом в ситуации с подозрением на повышенную жесткость является сразу же посетить соответствующую лабораторию, так как никакие домашние методы не смогут выдать точные данные. Но о них — ниже.
Полностью описывать весь процесс нет никакого смысла, так как воспроизвести его самостоятельно, без нужных навыков и химических элементов и оборудования невозможно. Тем не менее можно выделить несколько основных принципов реакции, которые сохраняются в любой ситуации и присущи абсолютно всем вариантам:
- Всегда должен быть способ, позволяющий зафиксировать эквивалентность реакции, которая и является основой для определения жесткости.
- Анализ проводится очень быстро.
- Должно выполняться требование стехиометричности процесса. Проще говоря, это значит, что в процессе проведения реакции не должны образовываться никакие побочные продукты.
- С момента начала реакции ее невозможно повернуть вспять или остановить.
Для определения жесткости воды в домашних условиях можно использовать специальные приспособления, купить которые не составит особого труда (они не запрещены и общедоступны). Выглядят они как стандартные тестовые полоски. Для использования достаточно погрузить одну из них в воду, требующую проверки, на указанный в инструкции период времени. В результате изделие изменит свой цвет. При использовании таких полосок для определения жесткости воды главной проблемой является определить, каков именно показатель жесткости. Чтобы это сделать, нужно сравнивать цвет на полосе и примеры с описанием на упаковке. К сожалению, далеко не всегда можно сразу же понять, что именно показывает приспособление, и даже в более четкой ситуации точность данных оставляет желать лучшего. В целом такие тест-полоски подходят только для общего понимания того, насколько жесткая или мягкая вода.
Проверить воду из-под крана на жесткость также можно при помощи подручных средств. Правда, это скорее занимательный опыт для детей, чем действительно вариант тестирования показаний жидкости.
- Банку емкостью 1 литр (или любую другую подобную емкость).
- Стакан в форме цилиндра.
- Любые весы (удобнее всего использовать электронные).
- Линейку.
- Мыло хозяйственное (72% или 60%).
- Дистиллированную воду.
Для проверки необходимо взять 1 грамм мыла, измельчить его и поместить в стакан. После этого следует подогреть дистиллированную воду, но не доводить до кипения. Ее следует налить в тот стакан, в котором уже лежит мыло. В итоге оно обязано растворится в воде. Следующий шаг – налить еще больше воды. После этого следует налить в банку обычной воды из-под крана и медленно вылить мыльную жидкость из стакана и перемешать (медленно). Если образуется пена, то это — показатель жесткости. К сожалению, более или менее четко сказать, каков именно ее уровень, при помощи такого метода практически невозможно.
Еще один вариант определения жесткости питьевой воды – воспользоваться специальным прибором – TDS-метром. В принципе, он предназначен для определения электропроводимости воды, на что влияют как непосредственно соли (создающие жесткость), так и множество других элементов, что не дает нужного уровня точности. Более того, показания прибора обычный человек, не умеющий их считывать, не поймет и скорее всего запутается. Попробуем упростить задачу. Подавляющее большинство таких устройств в качестве единиц измерения используется некие ppm. У нас же применяются другие варианты, основанные на эквиваленте миллиграмма на литр жидкости. В среднем, 1 наша единица (мг-экв/л) равняется 50,05 зарубежным ppm. По правилам, концентрация солей (т.е. жесткости) должна быть не более 350 ppm или же 7 мг-экв/л. На эти цифры и стоит ориентироваться. Если же прибор будет отечественным, все значительно облегчается. Хуже всего, когда подобное приспособление произведено где-то в Китае или другой подобной стране, где используются собственные единицы измерения. Тогда придется самостоятельно искать их эквивалент и переводить в привычные нам показания.
Из других приборов, способных определять жесткость воды, отдельно следует отметить уникальное устройство АКМС-1. Это достаточно большой стационарный агрегат, сходный по размерам с фильтрами «Гейзер-3». Просто так в домашних условиях с его помощью проверять жидкость не представляется возможным. Именно поэтому такие приспособления используются в первую очередь на производстве, где жесткость воды может повлиять на работу дорогостоящей техники или нанести другой подобный вред. В отличие от всех остальных аналогов, АКМС-1 действительно быстро и точно показывает текущий уровень жесткости, позволяя оператору своевременно реагировать. При помощи этого приспособления можно как пускать воду к рабочим агрегатам напрямую, если она не представляет для них угрозы, так и предварительно ее фильтровать. Это, конечно же, выльется в дополнительные затраты, но зато поможет сэкономить на ремонте техники, который обойдется значительно дороже.
Учитывая все указанное выше и требования ГОСТ, вода питьевая должна регулярно проверяться на уровень жесткости. Тем не менее принимать радикальные меры по ее умягчению не стоит, так как вредны оба состояния – слишком жесткая и слишком мягкая. Только в той ситуации, когда показатели действительно выше или ниже, стоит предпринимать какие-то действия. К слову, если с жесткостью регулярно борются, то про слишком мягкую воду практически не слышно, а ведь на это также нужно обращать не меньше внимания.
источник
Метод определения общей жесткости воды основан на том, что ионы кальция и магния связываются трилоном Б в комплексные соединения. О конце реакции судят по изменению цвета индикатора хромогена черного от розово-малинового до синевато-серого. Появление синевато-серого окрашивания свидетельствует об отсутствии ионов Са 2+ и Mg 2+ в растворе, т. е. о полном связывании их с трилоном Б.
В коническую колбу вместимостью 250 мл отмеривают 100 мл исследуемой воды, добавляют 5 мл аммиачного буферного раствора, индикатор хромоген (сухую смесь) и медленно титруют 0,1 н раствором трилона Б до перехода окраски в серовато-синюю.
Общую жесткость воды Жо, ммоль экв/л, вычисляют по формуле
где V1 – объем 0,1 н раствора трилона Б, израсходованный на титрование пробы, мл; К – коэффициент нормальности раствора трилона Б (К = Nфакт / 0,1); N1 – нормальность раствора трилона Б; V2 – объем исследуемой пробы воды, мл.
Определение карбонатной жесткости воды
Оттитровывают 100 мл воды 0,1 н раствором HCl в присутствии метилового оранжевого до перехода окраски от желтой к розовой. Карбонатную жесткость Жк, ммоль экв/л, вычисляют по формуле
где V3 – объем HCl, который пошел на титрование, мл; N2 – нормальность HCl, моль/л; V2 – объем воды, который взят для анализа, мл.
Некарбонатная жесткость определяется как разница между общей и карбонатной жесткостью
Определение количества диоксида углерода
В колбу поместите 200 мл исследуемой воды, добавьте 2 капли раствора фенолфталеина и взболтайте. Если вода окрасилась в интенсивный розовый цвет, это значит, что в ней нет растворенного диоксида углерода. Отсутствие окраски или очень слабая окраска свидетельствуют о присутствии растворенного диоксида углерода. В этом случае пробу титруют 0,1 н раствором NaOH до появления интенсивной окраски. Концентрацию диоксида углерода определяют по формуле
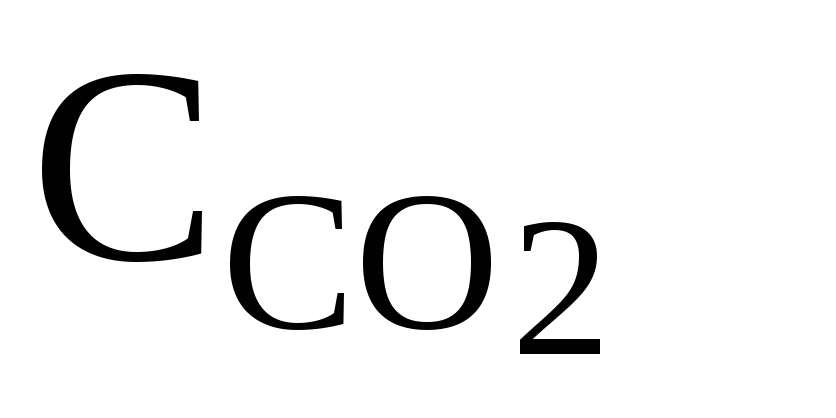
где N – нормальность NаОН, моль/л; V4 – его объем, мл.
Определение концентрации кальция и магния
К 100 мл воды добавляют 3 мл 10%-ного КОН до рН = 10–12, вносят примерно 0,2 г сухого индикатора мурексида, смешанного с сульфатом калия, и титруют трилоном Б до перехода окраски из розовой в фиолетовую.
Концентрацию кальция СК, ммоль экв/л, рассчитывают по формуле
где V5 – объем трилона Б, пошедший на титрование, мл.
Концентрацию магния См, ммоль экв/л, рассчитывают по формуле
После проведения полного обессоливания воды необходимо убедится в отсутствии в ней как катионов (Mg 2+ , Ca 2+ ), так и анионов (SO4 2– , NO3 – , Cl – ). Анализ на содержание указанных анионов в воде до ее обессоливания и после проводится качественно.
SO4 2– – раствор хлорида бария дает белый осадок сульфата бария;
Cl – – при добавлении раствора нитрата серебра образуется белый осадок хлорида серебра;
NO3 – – при добавлении раствора дифениламина в серной кислоте появляется характерное для ионов NO3 – синее окрашивание.
Определение содержания взвешенных частиц (мутность воды)
Мутность воды определяется фотоколориметрическим методом при длине волны 440 нм. Оптическую плотность измеряют в кюветах с толщиной поглощающего слоя 3 мм. Количество взвешенных частиц в воде находят по калибровочной кривой.
Регистрирующим прибором в фотоколориметре служит микроамперметр типа М907, оцифрованный в микроамперах и имеющий шкалу 0–100 делений, соответствующих шкале коэффициентов пропускания – и оптической плотности – D. При измерении со светофильтром 440 нм, отмеченным на лицевой панели колориметра черным цветом, ручку «Чувствительность» устанавливают в одно из положений 1, 2 или 3. Рабочие поверхности кювет перед каждым измерением необходимо тщательно протирать спирто-эфирной смесью, жидкость в кюветы наливать до метки на боковой поверхности кюветы. При установке кювет в кюветодержатель нельзя касаться пальцами участков поверхности кювет ниже уровня жидкости в них.
Колориметр включают в сеть за 15 мин до начала измерений. Во время прогрева кюветное отделение должно быть открыто (при этом шторка перед фотоприемником перекрывает световой пучок). В световой пучок помещают кювету со стандартным раствором, по отношению к которому производят измерения, и крышку кюветного отделения закрывают. Ручками «Чувствительность» и «Установка 100» устанавливают отсчет 100 по шкале колориметра. Затем поворотом ручки кювету со стандартным раствором заменяют кюветой с исследуемым раствором. После этого производят отсчет по шкале колориметра, соответствующий коэффициенту пропускания исследуемого раствора в процентах, или по шкале D в единицах оптической плотности. Измерения проводят 3–5 раз и окончательное значение измеряемой величины определяют как среднее арифметическое полученных значений.
источник
Считается, что жесткая вода неприятна на вкус и легко узнаваема по плотному слою накипи на внутренней поверхности чайника и других нагревательных приборов. Между тем, в лабораторных условиях концентрацию солей магния и кальция определяют при помощи целого набора измерительных инструментов и вспомогательных реактивов.
Определение жесткости воды – одна из основных стадий водоподготовки. Для того чтобы измерить концентрацию солей кальция и магния, химики–лаборанты используют только разрешенные требованиями ГОСТ приборы и индикаторы. Для начала: что такое жесткость воды и как её обнаружить в домашних условиях.
На сегодняшний день самыми надежными считаются следующие методы определения жесткости:
— комплексонометрический метод выявления общей и временной жесткости,
— метод атомной спектрометрии
По карте кислотности и жесткости воды России можете оценить примерные показатели для вашего региона.
Для определения общей жесткости воды в лабораторных условиях используют комплексонометрический метод, основанный на образовании сложных соединений анализируемых ионов с органическими реагентами (комплексонами) (1). Перед началом работы пробу разбавляют спиртовым раствором индикатора эриохрома черного Т или сухой смесью хлорида натрия и кальция. К окрашенному в вино-красный цвет раствору добавляется по каплям Трилон Б. Величину общей жесткости вычисляют по формуле:
Жо=Nx*Vx*1000/V1
(N-нормальность раствора Трилона Б, V-объем раствора Трилона Б, V1-объем пробы).
Для справки: Титрование (титриметирческий анализ) – метод количественного расчета содержания вещества, реагирующего с реактивом известной концентрации.
При помощи титрования и колориметрического метода можно узнать не только величину общей, но и временной жесткости. Для этого исследуемые пробы соединяют с индикатором (метилоранж), после чего эталонный образец переставляют на белый фон, а вторую пробирку титруют раствором соляной кислоты до появления оранжево-красного оттенка. Рассчитывая необходимое количество «солянки», определяют временную жесткость воды.
Нвр = NHCl * VHCL* 1000/ V1
(N-нормальность раствора соляной кислоты, V-объем раствора соляной кислоты, V1-объем пробы)
Уравнение реакции:
Титрование – один из самых распространенных и простых методов определения концентрации ионов кальция и магния. К минусам традиционных методик следует отнести невысокую точность.
О том, как проверить жесткость воды с минимальными погрешностями, знает обслуживающий персонал высокоточных приборов. Ярким примером одного из самых надежных инструментов определения концентрации ионов кальция и магния является АКМС-1. По результатам сравнения разности электродных потенциалов с эталонными значениями, прибор автоматически выводит результаты анализа на дисплей.
Метод атомной спектрометрии основывается на резонансном поглощении света атомами исследуемых химических элементов. К преимуществам подобного метода относится высокая точность. Недостатком атомной спектрометрии считают высокую стоимость требуемых приборов.
Для определения жесткости воды можно воспользоваться приборами и инструментами, используемыми в аквариумистике. С точностью до 2% снимают показания TDS-метры.
Принцип действия подобного прибора основан на прямой зависимости электропроводности и количества растворенных солей кальция и магния.
На заводах и предприятиях, а также в лабораторных условиях очистных сооружений наиболее точными считаются результаты нескольких опытов, различающихся методикой вычисления концентрации «целевых» компонентов или частиц загрязнителя.
источник
Данный урок — лабораторная работа разработан по предмету «Аналитическая химия» для обучающихся по профессии «Технология продукции общественного питания». В ходе лабораторной работы в основе определения общей жесткости воды используется один из методов титриметрического анализа — комплексонометрический.
Вода является универсальным растворителем на планете Земля. Как в загородных домах, так и в городе в квартирах с централизованным водопроводом существует проблема жесткой воды. Жесткость воды зависит от наличия в ней солей кальция и магния. Жесткость воды является характеристикой конкретного источника водоснабжения и не изменяется в процессе подготовки питьевой воды к централизованному водоснабжению. Как определить степень жесткости воды?
Цель: повторить основные понятия, используемые в титриметрическом анализе; научить определять общую жесткость воды комплексонометрическим методом; закрепить навыки работы с лабораторным оборудованием; развивать вычислительные навыки; воспитывать чувство ответственности и дисциплинированности при выполнении практической работы.
Оборудование: конические колбы, мерные круглодонные колбы, бюретки для титрования, реактивы: трилон Б, индикатор эриохром черный Т, водопроводная вода, аммиачно-буферная смесь; таблицы, инструкционные карты.
II. Актуализация знаний учащихся
Сегодня на уроке мы с Вами будем говорить о самом замечательном веществе на планете Земля — воде.
Вы, как будущие технологи общественного питания, будете использовать питьевую воду не только в быту, но и в своей профессиональной деятельности.
В Старом Осколе питьевая вода поступает в город из 14 водозаборов, расположенных в разных частях города и района.
1. Одинакова ли питьевая вода по своим свойствам? (нет)
2.Чем она отличается? (содержанием различных веществ — жесткостью)
Абсолютно чистой воды в природе не существует. Она всегда содержит различные примеси как в растворенном, так и во взвешенном состоянии. От концентрации и природы этих примесей зависит пригодность воды для бытовых и промышленных нужд.
3.Что такое жесткость воды?
Жесткость воды определяется содержанием в ней растворимых солей магния, кальция, гидрокарбонатов, сульфатов, хлоридов.
4. Какие виды жесткости воды Вы знаете?
Жесткость временная (карбонатная) обусловлена содержанием гидрокарбонатов кальция и магния.
Жесткость постоянной (некарбонатной) обусловленна присутствием в воде хлоридов, сульфатов и других солей магния и кальция.
Общая жесткость воды представляет сумму жесткости карбонатной и некарбонатной.
5. Почему нежелательно использовать жесткую воду в быту?
Жесткая вода образует плотные слои накипи на внутренних стенках паровых котлов и кипятильников, в ней плохо развариваются пищевые продукты, при стирке белья в жесткой воде расходуется больше мыла.
III. Изучение нового материала
Тема нашего урока «Определение общей жесткости воды комплексонометрическим методом». Запишем ее в тетради.
В ходе урока мы должны научиться практическим путем определять общую жесткость воды, используя титриметрический анализ, в частности комплексонометрический метод.
Вспомним основы комплексонометрического метода анализа.
1. В чем состоит сущность комплексонометрического метода?
Сущность комплексонометрического метода состоит в образовании комплексных соединений анализируемых катионов с органическими реагентами — комплексонами.
Титрование — постепенное добавление раствора известной концентрации до достижения точки эквивалентности.
3. Что такое точка эквивалентности?
Точка эквивалентности — момент окончания реакции, т.к. вещества реагируют между собой в эквивалентных количествах.
4. С помощью чего устанавливают точку эквивалентности? (индикатора)
Индикаторы — вещества, при помощи которых устанавливают момент эквивалентности между взаимодействующими растворами.
6. Что такое стандартный (рабочий) раствор?
Стандартный раствор — раствор с точно установленной концентрацией, используемый для титриметрических измерений.
7. Какие правила техники безопасности необходимо соблюдать при выполнении практической работы?
Правила техники безопасности при работе со стеклянной посудой; жидкостями и сыпучими, а также ядовитыми веществами.
Работу выполняем по парам. На столах имеются инструкционные карты.
IV. Выполнение практической работы
Работу выполняем по парам. На столах имеются инструкционные карты.
Цель работы: определить общую жесткость воды методом комплексонометрии.
Оборудование: бюретки, мерный цилиндр, мерные круглодонные колбы, конические колбы, цилиндры, воронки, шпатель; реактивы: раствор Трилона Б, эриохром черный Т (сухой), аммиачно-буферная смесь, водопроводная вода.
1. Мерной колбой отмерить 100 мл исследуемой Н2О и перелить ее в коническую колбу.
2. Добавить к воде 5 мл аммиачно-буферной смеси, затем 7-8 капель спиртового раствора индикатора эриохром черного Т или щепотку его смеси с NaCl или KCl (сухую).
3. Тщательно перемешать, раствор окрасится в винно-красный цвет.
4. Смесь оттитровать 0,05 Н раствором Трилона Б. К концу титрования раствор Трилона Б добавлять по каплям, встряхивая смесь в колбе после добавления каждой капли.
5.Титрование можно считать законченным если после добавления очередной капли окраска раствора приобретает синий цвет с зеленоватым оттенком и с добавлением лишней капли раствора комплексона не изменяется.
6. Определить объем трилона Б, израсходованного на титрование.
7.Титрование повторить 2-3 раза и для расчета взять среднее значение.
8. Произвести расчет общей жесткости воды.
Величину общей жесткости воды (Ж) в мг*экв/л вычисляют по формуле:
где N — нормальность раствора трилона Б, г-экв/л;
V — объем раствора трилона Б, мл;
9. Сделайте вывод о типе воды, пользуясь данными значениями жесткости воды.
Типы воды (по жесткости):
- Очень мягкие — 0-1,5 мг-экв/л;
- Мягкие — 1,5- 3,0 мг-экв/л;
- Среднежесткие — 3,0- 4,5 мг-экв/л;
- Довольно жесткие — 4,5 — 6,5 мг-экв/л;
- Жесткие — 6,5 — 11,0 мг-экв/л;
- Очень жесткие — свыше 11,0 мг-экв/л.
V. Подведение итогов работы
Сегодня на уроке мы практическим путем определили общую жесткость воды. Водопроводная вода, которую мы используем, является среднежесткой.
Какие способы устранения жесткости Вы знаете?
Способы устранения жесткости воды:
- Карбонатная (временная) жесткость — кипячение; добавление известкового молока или соды.
- Некарбонатная (постоянная) жесткость — добавление соды.
источник
Чтобы выразить жесткость воды в цифрах, указывают концентрацию в ней ионов кальция и магния. Международная система единиц рекомендует измерять жесткость в молях на кубический метр, но на практике применяют более удобные единицы.
В России для измерения жесткости используются градусы жесткости и миллиграмм-эквиваленты на литр (мг-экв/л).
Чтобы выразить жесткость воды в цифрах, указывают концентрацию в ней ионов кальция и магния. Международная система единиц рекомендует измерять жесткость в молях на кубический метр, но на практике применяют более удобные единицы.
В России для измерения жесткости используются градусы жесткости и миллиграмм-эквиваленты на литр (мг-экв/л).
По действующему ГОСТу 31865-2012 единицей измерения жесткости воды является градус — °Ж. 1°Ж = 1 мг-экв/л. Для сравнения 1°Ж (Россия) = 2,8 dH (Германия).
По величине данного показателя вода делится на 3 категории:
По действующему ГОСТу 31865-2012 единицей измерения жесткости воды является градус — °Ж. 1°Ж = 1 мг-экв/л. Для сравнения 1°Ж (Россия) = 2,8 dH (Германия).
По величине данного показателя вода делится на 3 категории:
По санитарным правилам и нормам ( СанПиН 2.1.4.1074–01 ) жесткость питьевой воды из централизованного источника водоснабжения не должна превышать 7 мг-экв/л (в отдельных случаях 10 мг-экв/л).
На практике даже «средняя» жесткость вызывает заметный дискомфорт. Уже 4–5 °Ж дадут о себе знать: оставят накипь в чайнике и плёнку на самом чае, известковый налет на мойке и белые разводы на посуде, «забьют» аэратор водопроводного крана и лейку душа.
По санитарным правилам и нормам ( СанПиН 2.1.4.1074–01 ) жесткость питьевой воды из централизованного источника водоснабжения не должна превышать 7 мг-экв/л (в отдельных случаях 10 мг-экв/л).
На практике даже «средняя» жесткость вызывает заметный дискомфорт. Уже 4–5 °Ж дадут о себе знать: оставят накипь в чайнике и плёнку на самом чае, известковый налет на мойке и белые разводы на посуде, «забьют» аэратор водопроводного крана и лейку душа.
Вариант «Точно»:
Самый точный метод определить жесткость воды — сдать ее на анализ в лабораторию. Например, в Санэпидемстанцию. СЭС проверит не только концентрацию солей жесткости, но и зафиксирует нитраты, пестициды, уровень содержания железа, сероводород, органические примеси и другие вещества, которые часто встречаются в грунтовых водах. Если вы подбираете систему водоочистки для коттеджа, вам обязательно нужно сделать анализ воды.
Вариант «Точно»:
Самый точный метод определить жесткость воды — сдать ее на анализ в лабораторию. Например, в Санэпидемстанцию. СЭС проверит не только концентрацию солей жесткости, но и зафиксирует нитраты, пестициды, уровень содержания железа, сероводород, органические примеси и другие вещества, которые часто встречаются в грунтовых водах. Если вы подбираете систему водоочистки для коттеджа, вам обязательно нужно сделать анализ воды.
Вариант «Быстро»:
Использовать тест-полоски для определения жесткости воды. Они продаются в зоомагазине или в магазине с кофе-машинами, иногда — в фирменных магазинах бытовой техники. Такой тест покажет примерную жесткость. На бумагу нанесен реагент, который при контакте с водой меняет окрас. Полоска опускается на время в воду, и интенсивность ее окраса будет меняться в зависимости от концентрации вещества в воде.
Основные недостатки такого метода: низкая точность и то, что интерпретировать результат теста бывает сложно. Придется сначала на глаз определить интенсивность окраса, сравнив с «палитрой» возможных результатов. А затем указанные на палитре численные значения жесткости переводить из европейских градусов в российские. Качественные тест-полоски обычно зарубежного производства.
источник
Как выполняется контроль жёсткости воды. Понятие жёсткости, от чего она зависит. Анализ воды на жёсткость дома. Лабораторные методы контроля общей и временной жёсткости жидкости. Приборы для выполнения анализа. Методы борьбы с повышенной жёсткостью в быту. Контроль жёсткость воды или анализ воды на жёсткость нужен для определения концентрации солей в жидкости. Этот анализ можно проводить в лабораторных условиях и дома.
Жёсткость воды – термин, говорящий о процентном соотношении солевых частиц магния и калия в жидкости. Она подразделяется на две разновидности:
- Временная (такая жидкость называется карбонатная);
- Общая жёсткость (данная вода относится к некарбонатной).
Первый тип жёсткости характеризуется присутствием гидрокарбонатных солевых частиц магния и калия. Если такую воду закипятить, то элементы распадутся на карбонаты и гидроксиды и выпадут в осадок. Именно этот белый налёт часто покрывает наши чайники изнутри и собирается на других нагревательных элементах.
Для жидкости с общей жёсткостью характерно наличие других химических элементов (различных нитратов, хлоридов и тп.п). Обычно жёсткость питьевой воды связана с особенностями вашего региона, составом грунтов. Чем больше известковых пород находится в почве, тем выше жёсткость воды. Но важно не только понимать суть понятия, но и знать, как проверить жёсткость воды. Выполнить это легко как в быту, так и на заводе.
Для проверки жёсткости водопроводной воды дома можно использовать следующие способы:
- Постарайтесь обильно вспенить мыльный брусок или порошок для стирки. Если у вас образуется мало пены, то ваша вода имеет повышенную жёсткость. Это возникает по той причине, что солевые частицы калия и магния не позволяют мылу пениться. При обильной пышной пене от любого моющего средства можно утверждать, что вода нежёсткая. Но этот метод не позволят точно определить степень жёсткости.
- На вкус также можно отличить жёсткую воду от мягкой. Она более горькая. Но не все могут точно уловить горьковатый привкус солей магния и калия.
- Белый осадок в чайниках, накипь на нагревательных элементах других бытовых приборов – признак жёсткой воды. Осадок возникает из-за распада солей и выпадения их на дно. Данная особенность жёсткой воды очень вредит бытовым приборам и отопительному трубопроводу.
- От жёсткости воды зависит скорость заваривания чайного напитка. При мягкой воде на эту процедуру уйдёт от 3 до 6 мин., в жёсткой воде чай будет завариваться от 8 до 12 мин. Кстати, на вкус оба напитка будут существенно отличаться.
- Благодаря нехитрому компактному измерительному прибору можно очень легко определить жёсткость любой жидкости. Он называется TDS-метр. Агрегат измерят электропроводность жидкости. Чем выше показатель, тем больше уровень солесодержания жидкости. Обычно его ещё называют солемер. Чаще такой анализ воды на жёсткость делают владельцы аквариумов и цветоводы.
- Проверить жёсткость воды в быту можно, используя тест-полоски, продающейся в аптеках медтехники.
Для этого анализа можно использовать колориметрическую методику и принцип титрования. Процедура анализа выполняется так: порция воды смешивается с метилоранжем (индикатором), ёмкость устанавливается на светлом фоне. Во вторую тару с водой добавляют соляную кислоту, пока не получится красно-оранжевый цвет воды.
Временную жёсткость жидкости находят в процессе расчёта требуемого количества соляной кислоты по формуле: Нвр = NHCl * VHCL* 1000/ V1, где N-насыщенность раствора, V-его количество, V1-количество пробы.
Этот анализ проводят в лаборатории. Для него используют комплексонометрическую методику. Она базируется на принципе возникновения соединений ионов, подвергающихся анализу, с природными реагентами. Сначала воду в пробирке разводят раствором индикатора на спирту (чёрного этиохрома «Т»). Также для этих целей может использоваться сухая смесь кальциевых и натриевых хлоридов. В итоге полученная смесь окрашивается в насыщенный рубиновый цвет. Затем в пробирку капается вещество, называемое Трилон.
Расчёт общей жёсткости производится по уравнению: Жо=Nx*Vx*1000/V1, где N-насыщенность вещества Трилон, V-его количество, V1-количество пробы.
Как мы уже говорили выше, прибор контроля жёсткости воды называется солемер или TDS-метр. Точность проверки составляет 2%. Основной принцип работы данного агрегата построен на зависимости электропроводности жидкости от общего числа примесей солей магния и калия. То есть чем больше данных солей в воде, тем больше будут показания прибора, а следовательно, тем выше жёсткость воды.
На некоторых предприятиях и заводах наблюдается прямая зависимость между жёсткостью используемой воды и исправностью работы оборудования. Поэтому для обеспечения бесперебойной работы технологического оборудования требуется осуществлять постоянный автоматический контроль жёсткости воды.
Для этих целей используется специальное оборудование, например, анализатор «АКМС-1». Этот прибор непрерывно контролирует содержание солевых частиц кальция и магния в жидкости, поступающей в технологическое оборудование. То есть он подсчитывает общую жёсткость в пределах 0,005-25,0 мг-экв/л.
Как понять, что ваша водопроводная вода жёсткая, мы писали выше. Теперь перечислим ряд мер, позволяющих снизить жёсткость воды в домашних условиях:
- Самый простой способ – кипячение воды.
- Фильтрация воды через системы обратного осмоса (специальные мембраны).
- Использование смягчающих солей.
- Применение фильтрующих картриджей.
- Магнитное фильтрующее устройство.
- Использование ионообменной смолы в комплексе с солевым раствором.
Хотите провести контроль жёсткости воды? Заказать такую услугу вы можете у наших специалистов, для этого вам достаточно связаться с нами по указанным телефонам.
источник
Цель работы: овладение методом количественного анализа питьевой воды по показателям постоянной и временной жесткости.
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ — это массовое количество химического элемента, которое присоединяет или замещает 1,008 массовых частей (м.ч.) водорода или 8 м.ч. кислорода. В ходе реакций элементы соединяются в количествах, соответствующих их химическим эквивалентам.
Численно химический эквивалент выражается в любых массовых единицах, соответствующих массовости данной реакции. Например, массовость лабораторных опытов — граммы и миллиграммы, а количества реагирующих веществ запишем как г .э кв или мг.экв . В океанах, атмосфере, в Земном ядре происходят реакции с массовостью т .э кв и Мт.экв .
ПРОИЗВЕДЕНИЕ ХИМИЧЕСКОГО ЭКВИВАЛЕНТА НА ВАЛЕНТНОСТЬ ВЕЩЕСТВА РАВНО АТОМНОЙ МАССЕ ЭЛЕМЕНТА .
Исходя из этого правила производятся все расчеты химических реакций с помощью Периодической системы элементов Менделеева.
НОРМАЛЬНЫЙ РАСТВОР содержит в 1 кубическом дециметре (литре) один г .э кв растворенного вещества. Для наглядности сравнения нормальной и процентной концентраций рассмотрим подсчет процентности децинормального раствора соляной кислоты. ( 0,1N НCl ), который используется при титровании в данной работе.
Для подсчетов возьмем массовые числа Н(1,008) и С l (35,45), сложим их (36,458), округлим (36), вычислим 0,1 (3,6). Значит, один литр 0,1N раствора H С l содержит 3,6 г кислоты, а в 100 г этого раствора — 0,36г HCl . Округленно процентность такого раствора — 0,4 %.
ТИТР — в объемном химическом анализе — концентрация раствора реактива, число граммов вещества в 1 мл раствора.
ТИТРОВАНИЕ — это метод объемного химического анализа, состоящий в постепенном струйно-капельном приливании реактива известной концентрации к известному объему другого реактива, концентрацию которого нужно установить в ходе опыта.
ИНДИКАТОР МЕТИЛОВЫЙ ОРАНЖЕВЫЙ , цветовой определитель рН среды.
рН = 5,5 нормальная — оранжевый
рН > 7 щелочная — желтый (светло-желтый)
Титрование происходит в присутствии индикатора рН среды, по изменению цвета которого и прекращают титрование. Установка для титрования приведена на рисунке 1. Она состоит из металлического штатива, на котором закреплена стеклянная бюретка с кислотой и колбы с анализируемой жидкостью.
Существует пропорция для вычисления неизвестной концентрации примесей в анализируемой жидкости. Выведем ее из уравнения:
где известна нормальность (0,1) и количество кислоты, пошедшей на титрование. Количество анализируемой жидкости задано условием опыта, но может быть любое. Зная эквивалент Са (20,04), эквивалент соляной кислоты HCl (36,5) и считая, что 1 литр нормального раствора НСl прореагирует с 20,04 г Са 2 + , принимаем, что 1 мл 0,1N HCl соответствует 2,004 мг Са 2+ . Установив опытным путем объем кислоты V HCl , пошедший на титрование 50 мл жесткой воды, можно определить количество мг Са 2+ , содержащегося в этом объеме исследуемой воды, а затем и в литре такой воды, умножив полученную величину на 1000:50=20
Рисунок 2 иллюстрирует как правильно проводить отсчет объема жидкости в бюретки: а – правильный отсчет; б – завышенный отсчет; в – заниженный отсчет.
Рис. 2. Способ отсчета по мениску жидкости
Меры предостороженности при проведении работ с химическими реактивами:
1. Работайте всегда на одном и том же месте.
2. Не загромождайте рабочий стол свертками, папками, книгами.
3. Запрещается приносить в лабораторию съестное, напитки, использовать жевательную резинку во время работы.
4. Соблюдать в лаборатории тишину и чистоту.
5. Перед каждой лабораторной работой внимательно изучить теоретический материал по указанной теме.
6. Приступить к опыту только после того, как уяснена его цель и порядок выполнения.
7. Особая осторожность требуется при работе со стеклянной посудой и приборами.
8. При нагревании стеклянных колб на плитке подложите асбестовую ткань.
9. Децинормальные растворы солей, кислот и щелочей имеют низкую процентную концентрацию, но при работе с ними не следует забывать общие правила предосторожности при работе с химическими веществами.
10. Особого внимания требует фильтрация горячего раствора. При переливании его из колбы в воронку с фильтром следует сложить салфетку углом и сделать защитный выступ под рукой из ткани.
Соли кальция и магния, растворенные в воде, вызывают ее жесткость. Показатель жесткости выражается в мг .э кв /литр. Один мг .э кв жесткости соответствует содержанию в литре воды 20,04 мг Са 2+ или 12,16 мг Мg 2+ .
Различают жесткость постоянную и временную.
Временная жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния С а ( НСО3)2 и Мg (НСО3)2, она устраняется длительным кипячением
Эта реакция обратима (равновесна), так как при контакте СО 2 с раствором можно снова получить кислую соль. Только при кипячении СО 2 улетучивается и равновесие смещается в сторону нерастворимой соли.
Постоянная жесткость — это жесткость кипяченой воды, вызывается присутствием в воде хлоридов и сульфатов кальция и магния двухвалентных. Большие значения жесткости опасны отложениями внутри водопроводных и особенно водонагревательных систем нерастворимого осадка, выводящего из строя оборудование. Борьба с этим явлением сводится к связыван ию ио нов кальция и магния в нерастворимые соли до подачи такой воды в системы водоснабжения
Общая жесткость воды — это сумма постоянной и временной жесткости. Обычно показатели временной жесткости в несколько раз превышают индексы постоянной.
Фактор жесткости питьевой воды определяет региональные особенности состояния здоровья населения наряду с характерными для данного пункта, местности вредными примесями в воздухе, воде и почвах.
Принято считать воду с общей жесткостью:
до 3,5 мг .э кв /литр — мягкой;
от 3,5 до 7 мг .э кв /литр — средней;
от 7 до 10 мг .э кв /литр — жесткой;
свыше 10 мг .э кв /литр — очень жесткой.
Большие значения жесткости, характерные для артезианских вод солонцовых почв, придают воде неприятный вкус и небезопасны при ежедневном применении в пищу, так как провоцируют отложения солей в суставах (полиартриты, остеохондрозы), общее нарушение обменных процессов в организме. Ионы кальция и магния омыляют жиры, нарушая процессы всасывания питательных веществ в кишечнике, вызывая дерматиты. Повышенное содержание кальция в питьевой воде на фоне йодной недостаточности вызывает заболевания щитовидной железы. Повышенное содержание магния снижает моторику кишечника, препятствуя пищеварительному процессу.
Пониженное содержание солей жесткости (ВОЗ ограничивает нижний допустимый предел 1,5 мг .э кв /л) также опасно и вызывает у населения кариес и ослабление костей скелета, так как организм в этом случае восполняет недостаток кальция засчет внутренних ресурсов.
Таким образом, жесткость питьевой воды нормируется, исходя из ее гигиенического значения на уровне 7 мг .э кв /литр.(ГОСТ 2874-82).
Допустимая жесткость промышленных вод различна для разных производств. Например, для банно-прачечного хозяйства предпочтительна мягкая вода, так как сульфаты кальция и магния дают реакцию с моющими средствами с образованием нерастворимого трудноудаляемого осадка. Для пищевой промышленности опасны как повышенные, так и пониженные значения жесткости, поэтому здесь предпочитается интервал от 5 до 7 единиц.
Жесткость воды может быть устранена следующими способами.
Гидрокарбонаты кальция и магния могут находиться в растворе только при наличии в нем свободного углекислого газа. Такой раствор можно рассматривать как равновесную систему.
Растворимость газов падает при повышении температуры, при кипячении воды из нее устраняется углекислый газ. Поэтому понижение концентрации углекислого газа смещает равновесие в сторону нерастворимых карбонатов.
На практике карбонатная жесткость устраняется не кипячением, а добавкой такого химреагента , который переведет ион кальция или магния в труднорастворимые соединения. Например,
Катионным способом — пропустить через слой природного минерала цеолита или его синтетического аналога — пермутита (алюмосиликата Na2Al2Si2O6 × H2O.) При этом происходит обменная реакция
CaCl2 + Na2 П . = 2NaCl + Ca П ,
где П — пермутитовая группа без натрия, замещаемого кальцием жесткой воды. На этом принципе действуют фильтры доочистки воды , в т.ч. бытовые.
Жесткость можно устранить с помощью ионообменных смол, представляющих собой высокомолекулярные органические вещества, содержащие кислотные или основные функциональные группы. Смолы — катиониты содержат карбоксильную группу СООН или сульфогруппу ОS3H, смолы- аниониты аминогруппу NH2-. Если остаток смолы обозначить R, то катионит запишется как R-COOH, анионит как R-NH2.
Реакция деминерализации пойдет так:
2RCOOH + CaCl2 = (RCOO )2Ca + 2HCl
Рассмотренные процессы снижения содержания солей жесткости называются умягчением воды. Чаще всего эти процессы применяются для воды, идущей на питание котлоагрегатов с целью предотвращения образования накипи. В быту устранение жесткости предпочтительно сочетать с другими способами очистки. Такой компле кс вкл ючают в себя всем известные бытовые фильтры промышленного производства. Обычно в них использованы сорбенты (поглотители) двух-трех типов, расположенные каскадно один за другим: против взвешенных частиц, против химически активных и микробиологических примесей.
Представьте ситуацию, когда повышенное содержание частиц почвы, нередкое для российских условий, выводит из строя первый каскад. Тогда два остальных механизма очистки, не рассчитанные на поглощение механических примесей, также не сработают и, более того, вскоре сами станут источником дополнительного загрязнения.
По мнению многих ученых-экологов, разработка бытовых фильтров для условий России должна учитывать прежде всего состояние исходного продукта очистки, даже формулировка которого — сложная научная проблема.
– цилиндр мерный емкостью 100-1000 мл, ГОСТ 1770
– цилиндр мерный емкостью 10-20 мл, ГОСТ 1770
– колбы конические плоскодонные емкостью 150-250 мл, ГОСТ 25336
– бюретка стеклянная мерная с краном 5-25 мл, ГОСТ 1770
– воронка стеклянная фильтровальная, ГОСТ 23932
– фильтры бумажные диаметром 7 см
– кислота соляная децинормальной концентрации;
– натрий едкий, децинормальный раствор;
– натрия карбонат, децинормальный раствор;
– индикатор метиловый оранжевый.
ОПЫТ 1. Определение временной жесткости
Замечание. Подготовить 6 конических колб емкостью 250 мл и отмерить во все по 50 мл исследуемой водопроводной воды для опытов 1 и 2.
Способ основан на реакции между соляной кислотой и гидрокарбонатами.
Аналогично уравнение для магния.
Титрование контролируется индикатором метиловым оранжевым.
Методика проведения эксперимента следующая.
1. Поместить в три конические колбы по 50 мл исследуемой воды.
2. Добавить в каждую колбу по две-три капли индикатора метилового оранжевого.
3. Заполнить бюретку 0,1N раствором соляной кислоты до верхней нулевой отметки.
По каплям добавлять в колбу децинормальный раствор соляной кислоты из бюретки, осторожно размешивая реагенты покачиванием колбы. Титрование прекратить, как только окраска жидкости в колбе перейдет в розовую .
4. Оценить изменение цвета раствора.
5. Подсчитать по шкале бюретки и записать расход кислоты на титрование в табл. 1 Vk1 в мл.
6. Слить в сток оттитрованную пробу и трижды ополоснуть колбу водопроводной водой.
7. Снова c помощью мерного цилиндра отмерить в колбу 50 мл испытуемой воды и добавить 2-3 капли индикатора метилового оранжевого.
8. Повторить пункты 3-7, определив Vk2 и Vk3. Результаты занести в таблицу расхода кислоты в соответствующие графы.
9. Вычислить из полученных данных Vk среднее. Использовать это среднее значение для расчетов временной жесткости по формуле:
(1)
где Жвр — временная жесткость воды , ;
V к — объем кислоты, использованной на титрование одной пробы исследуемой водопроводной воды, средний из трехпроб , мл;
Ск — нормальная концентрация раствора кислоты (0,1 N );
Результаты вычисления временной жесткости занести в табл. 2.
ОПЫТ 2. Определение общей жесткости воды
Способ основан на осажден ии ио нов двухвалентного кальция и магния растворами щелочной смеси, состоящей из децинормальных растворов едкого натрия и карбоната натрия.
Для магния уравнения аналогичны.
Взяв щелочную смесь в избытке, определим не прореагировавшую часть титрованием децинормальным раствором соляной кислоты.
Подсчитав расход кислоты на титрование, вычислим общую жесткость.
1. С помощью мерного цилиндра отмерить в коническую колбу 50 мл испытуемой на содержание солей жесткости воды.
2. Мерным цилиндром емкостью 10 мл отмерить и добавить в колбу с исследуемой водой по 10 мл децинормальных растворов NaOH и Na2CO3 (итого 20 мл), что достаточно для создания избытка щелочи в пробе.
3. Прокипятить колбу с раствором, состоящим из смеси исследуемой воды со щелочью, в течение 3-5 минут, чтобы добиться необратимого разложения солей жесткости.
4. Остудить колбу и профильтровать раствор, учитывая требования раздела «Меры предосторожности».
5. В отфильтрованную воду добавить 2-3 капли индикатора метилового оранжевого до создания светло-желтой окраски раствора.
6. Выполнить титрование децинормальным раствором соляной кислоты, как указано в пункте 3 и 4 опыта 1 настоящей работы.
7. Расход децинормального раствора соляной кислоты отсчитать по шкале бюретки и записать в табл.1 в соответствующей графе.
8. Опыт проделать трижды и вычислить среднее значение Vк в табл. 1.
9. Вычислить общую жесткость Жо испытуемой воды по формуле
(2)
где — объем растворов щелочной смеси, мл;
— нормальность концентрации щелочи;
— объем раствора кислоты, использованной на титрование подщелоченной воды (из пункта 8 опыта 2 настоящей работы);
— нормальность концентрации раствора кислоты;
— объем пробы воды (в нашем опыте 50 мл).
Результаты вычисления занести в табл. 2.
Вычислив опытным путем величины временной и общей жесткости, можно определить и постоянную жесткость по известной формуле
, (3)
источник
Определение общей жесткости воды проводят несколькими методами: комплексометрический, как наиболее быстрый и удобный, спирто-мыльный, олеатный или пальмитатный методы.
Комплексометрический метод определения общей жесткости воды
Определение общей жесткости воды комплексометрическим методом проводят путем титрования пробы исследуемой воды раствором трилона Б — двунатриевой соли этилендиаминотетрауксусной кислоты, связывающей в слабощелочной среде катионы кальция и магния в комплексные соединения:
При этом в комплекс сначала связываются катионы кальция, а затем уже катионы магния.
Титрование проводят в присутствии хромовых красителей как индикаторов, из которых обычно применяют хромовый черный специальный (кислотный хром черный специальный, хромоген черный ЕТ-00) или хромовый темно-синий (кислотный хром темно-синий). Эти индикаторы образуют с катионами кальция и магния комплексные соли, придающие раствору окраску, резко отличающуюся (особенно у комплексов магния) от окраски в присутствии обычных солей этих индикаторов. Устойчивость комплексов катионов жесткости с индикаторами меньше, чем с трилоном Б. Эти индикаторы обладают также свойствами кислотно-основных индикаторов, изменяя окраску растворов в зависимости от pH среды, а поэтому титрование трилоном Б ведут при значении pH = 9-10, обеспечивая это введением аммиачного или боратного буферных растворов.
Индикаторы хром черный или хром темно-синий, введенные в исследуемую воду перед титрованием, образуют с катионами жесткости комплексные соединения, окрашивающие соответственно раствор в винно-красный или в розовато-красный цвет. Трилон Б в конце титрования извлекает катионы жесткости из их соединений с индикаторами, и раствор приобретает голубой или синевато-сиреневый цвет.
Концентрация катионов жесткости в исследуемой пробе должна быть до 5 мг-экв/л, что обеспечит хорошо заметный переход окраски. Воду, имеющую более высокую жесткость, разбавляют дистиллированной водой.
Для титрования воды с жесткостью больше 20 мг-экв/л можно применять 0,1 н. растворы трилона Б: для воды с жесткостью 0,5—20 мг-экв/л применяют 0,05 н. растворы, а для воды с жесткостью меньше 0,5 мг-экв/л — 0,01 н. растворы трилона Б. При анализе воды с жесткостью до 0,5 г-экв/л в качестве индикатора используют хром темно-синий, переход окраски у которого в этих условиях более заметен, чем у хром черного.
Комплексометрический метод применяют для анализа воды с жесткостью более 0,015 мг-экв/л, ошибка в анализе по этому методу обычно не превышает 1%. Определению жесткости комплексометрическим методом может мешать присутствие в воде катионов железа, алюминия, марганца, меди, цинка, а также высокое содержание гидрокарбонат- и карбонат-ионов.
Ионы железа, которые чаще других ионов, мешающих определению катионов жесткости, могут присутствовать в воде, при концентрациях выше 1 мг/л придают индикатору грязно-серый цвет и снижают четкость перехода его окраски. Для устранения влияния ионов железа и алюминия следует разбавлять испытуемую пробу дистиллированной водой, что снижает концентрацию этих ионов.
Подобное влияние небольших количеств катионов марганца может быть устранено добавлением к пробе раствора гидроксиламина. При большом содержании железа и марганца их выделяют из воды окислением и осаждением в щелочной среде.
Влияние катионов меди и цинка можно исключить, вводя в исследуемую пробу воды перед титрованием небольшое количество раствора сульфида натрия, вызывающего осаждение меди и цинка в виде сульфидов.
Чтобы устранить влияние карбонат- и гидрокарбонат-ионов, которые в щелочной среде вызывают образование малорастворимых карбонатов кальция и магния, медленно реагирующих с трилоном Б, пробу воды предварительно нейтрализуют соляной кислотой для разложения карбонатов, а затем кипятят 5 минут для удаления углекислого газа.
При анализе применяют следующие реактивы:
трилон Б, 0,05 н. или 0,01 н. раствор;
аммиачный буферный раствор, приготовляемый смешиванием 100 мл 20%-ного раствора хлорида аммония со 100 мл 20%-ного раствора аммиака и доведением объема смеси до 1 л, или борат-ный буферный раствор, приготовляемый смешиванием 800 мл 5%-ного раствора буры со 100 мл 10%-ного раствора едкого натра с доведением объема смеси до 1 л дистиллированной водой;
кислотный хром темно-синий или кислотный хром черный специальный, 0,5%-ные аммиачно-спиртовые растворы или 0,5%-ные сухие смеси с хлоридом натрия или нитратом калия;
При отсутствии ионов, мешающих анализу, объем воды, взятый для этого определения, должен быть не менее 500 мл. Если анализ на определение общей жесткости будет проведен позднее чем через 2 ч, то воду следует подкислить 0,1 н. раствором соляной кислоты до слабокислой реакции по лакмусовой бумажке. Мутную воду предварительно отстаивают в течение 2 ч, переливают в чистую склянку, а затем подкисляют.
В коническую колбу емкостью 250 мл пипеткой отбирают при температуре не ниже 15°С определенный объем исследуемой воды, в котором суммарное содержание катионов кальция и магния не превышает 0,5 мг-экв.
Рекомендуемые объемы пробы воды
Затем, если нужно, добавляют дистиллированную воду до общего объема 100 мл, вносят 5 мл аммиачного буферного раствора (при жесткости воды ниже 0,5 мг-экв/л можно вместо аммиачного внести 1 мл боратного буферного раствора), вводят 5—6 капель раствора индикатора или 0,1 г сухой смеси индикатора с солью и медленно титруют 0,05 н. раствором трилона Б при интенсивном перемешивании до перехода винно-красной окраски раствора в голубовато-синюю.
источник
дорогие аквариумисты! с 1.12.2011 сайт aquaria2.ru превращен в памятник. на нем закрыта регистрация, создание новых материалов и комментариев.
активная версия аквариумного сайта теперь доступна по адресу http://aquaria.ru. все материалы и регистрации пользователей aquaria2, созданные до 29.11.2011, блоги, темы форума, комментарии перенесены на новый сайт.
Принцип определения. По количеству трилона Б — натриевой соли этилендиаминотетрауксусной кислоты (порошок белого цвета), пошедшего на титрование пробы воды с индикатором эриохромом черным Т, рассчитывают содержание растворенных в ней солей кальция и магния. Так как индикатор меняет свою окраску не только от изменения концентрации ионов кальция и магния, но и в зависимости от рН раствора, в титруемый раствор добавляют буферную смесь (NH 4 OH + NH 4 Cl), поддерживающую рН около 10.
Раствор трилона Б, 0,05н. раствор: растворяют 9,3 г трилона Б в дистиллированной воде с последующим доведением объема до 1 л.
Буферный раствор: 20г химически чистой NH 4 Cl растворяют в дистиллированной воде, добавляют 100 мл 20%-ного раствора NH 4 OH и доводят объем дистиллированной водой до 1 л.
Раствор индикатора: 0,5г эриохрома черного Т растворяют в 10 мл буферного раствора и доводят объем 96%-ным этиловым спиртом до 100 мл.
Ход анализа. В коническую колбу емкостью 200-250 мл наливают 50 мл исследуемой воды, добавляют 5 мл буферной смеси и 10-15 капель индикатора эриохрома черного Т (до появления интенсивного вишнево-красного цвета). При непрерывном покачивании колбы пробу титруют раствором трилона Б. По мере прибавления трилона Б вишнево-красный цвет переходит в лиловый. С этого момента титрование следует проводить медленнее. Окончание титрования устанавливают по появлению синего цвета с зеленоватым оттенком.
Расчет. Содержание растворимых в воде солей кальция и магния вычисляют но формуле:
v * 0.05 * 1000
x = ——————————
v 1
где х — количество растворимых в воде солей кальция и магния, мг-экв/л;
v — количество трилона Б, пошедшее на титрование, мл;
0,05 — нормальность трилона;
1000 — пересчет на 1 л воды;
v 1 — объем исследуемой воды, мл.
Для перевода в градусы жесткости полученную цифру умножают на 2,8.
Определение общей жесткости лучше проводить по таблице 2, составленной В.П.Дацкевичем. В таблице нужно найти цифру, равную количеству трилона Б, пошедшему на титрование. В левой (вертикальной) графе указаны градусы жесткости, в верхней (горизонтальной) — десятые доли градуса. Таблица составлена для анализа, проведенного в 100 мл воды 0,1 н. раствором трилона Б или 0,05 н. раствором, но при исследовании 50 мл воды.
Чтобы приготовить воду нужной жесткости для общего, а в особенности для нерестового аквариумов, сначала следует определить жесткость водопроводной и дистиллированной воды, из которых будет составляться вода для аквариума. Химически обессоленная вода имеет нулевую жесткость. Пользуясь данными таблицы 3, водопроводную воду смешивают с химически обессоленной и получают воду нужной жесткости. Предварительно водопроводную воду подогревают до 90° в течение 30 минут и охлаждают.
Пример. Для аквариума, где будут нереститься неоновые рыбы, требуется вода жесткостью 3°, а мы располагаем водопроводной водой, жесткость которой 8°. В левой вертикальной графе указана требуемая жесткость воды, в горизонтальной графе — жесткость водопроводной воды. В-горизонтальной графе под цифрой 8 находим цифру, соответствующую 3° жесткости вертикальной графы,- 1666. Значит, для получения воды жесткостью 3° к 1 л водопроводной воды нужно добавить 1666 мл дистиллированной. Далее делаем пересчет на все количество воды нерестового аквариума.
источник