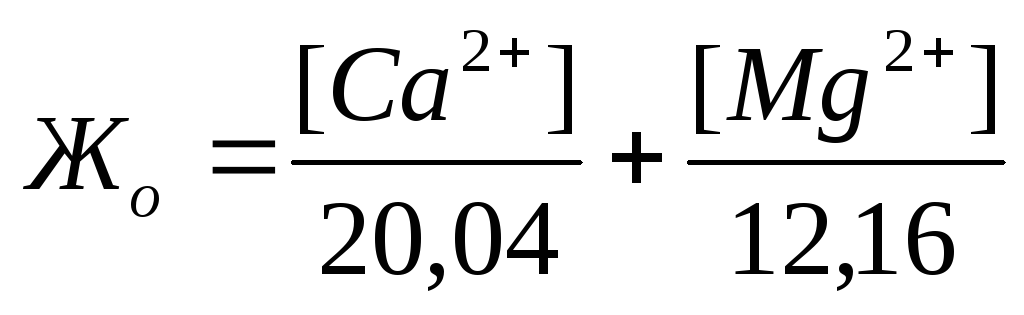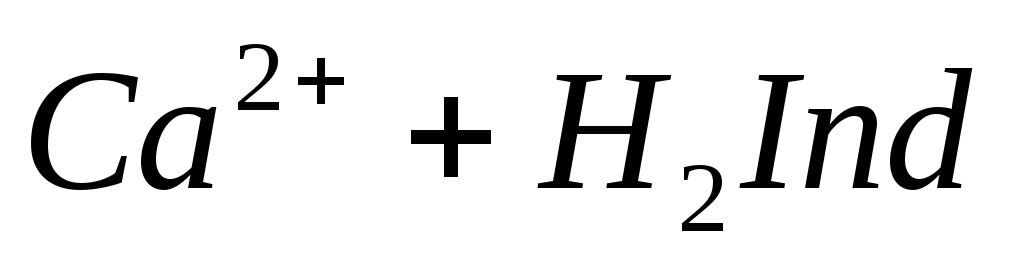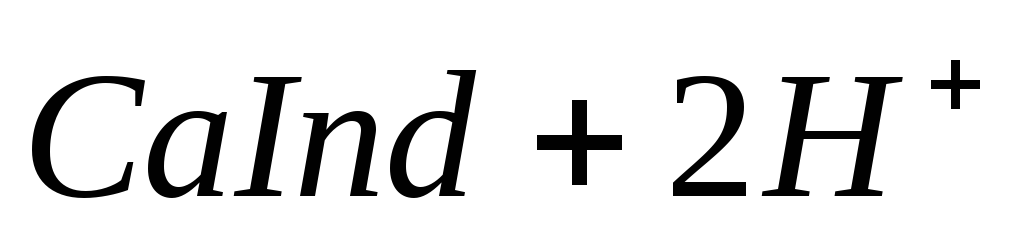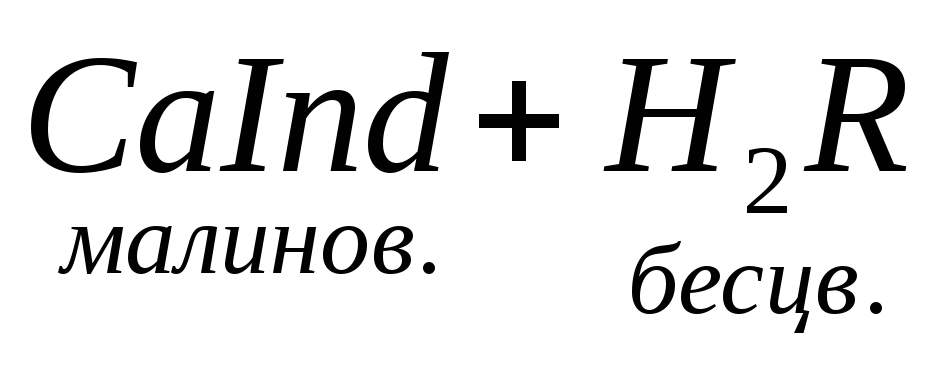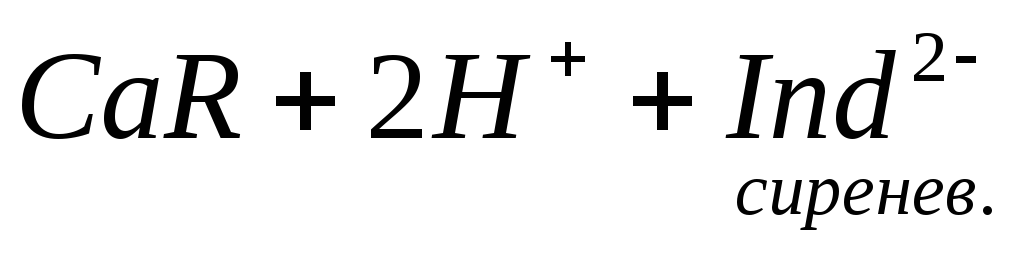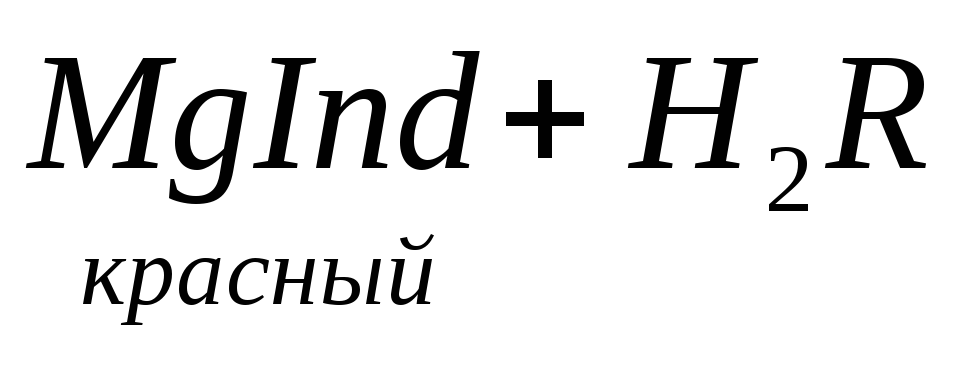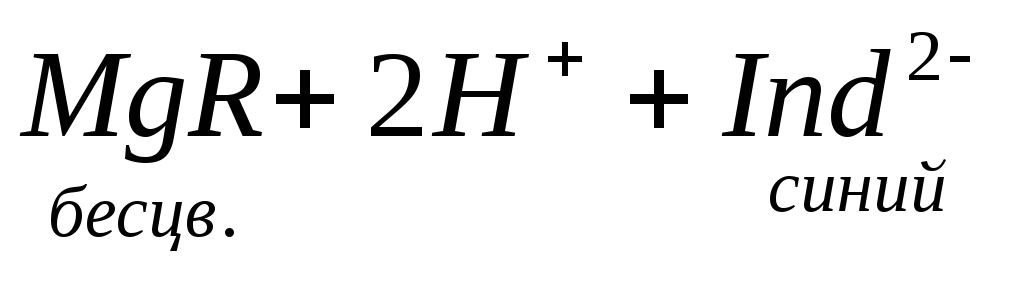Прилили в колбу 50мл. пробу минеральной воды, добавили 0,5мл. 5%-ный гидроксиламина при непрерывном перемешивании, 2мл. NaОH, несколько кристаллов диэтилдитиокарбоната натрия. Эту соль добавляем для устранения вредного влияния ионов меди. Так ионы меди осаждают в нерастворимую соль в CuS сульфид меди(II). Далее капнем 2 капли хромогена черного (темно-синего цвета). В колбе образуется вишнево-розовый раствор. Полученный раствор титруем раствором трилона-Б 0.05н. до перехода розового раствора в сиреневый «синеватый цвет».
Определение кальция, Концентрацию Са 2+ рассчитываем. Приложение 1.
После титрования кальция, оттитрованный раствор подкисляем соляной кислотой HСl (1:4), до перехода к исходной розовой окраске, стараясь, чтобы избыток кислоты не превышал 1-2 капли. Далее прибавляем 5мл. хлоридно-аммиячного-сульфатного раствора (аммиачный буферный раствор). Полученный раствор титруем раствором трилона — Б, 0,05н (нормальный), до перехода окраски от розовой до синей.
Определение магния. Концентрацию Мg 2+ рассчитываем. Приложение1.
Определение сульфатов. Прилили пробы воды объемом 5мл. в мерную пробирку, прибавили 1-2кап. соляной кислоты HCl (1:1) и 5 мл. гликолевого реагента. После 30 минут измеряем оптическую плотность раствора фотоэлектроколлориметром в кюветах 1=20мм. и светофильтром длиной волны 364 н.м. Число сульфатов находим по калибровочной кривой. Приложение № 2.
Определение хлоридов. Пипеткой набрали 10мл. испытуемой минеральной воды и 90мл. дистилл. воды, добавили 1мл. хромовокислого калия K2CrO4 и титровали азотнокислым серебром AgNO3 до перехода лимонно-кислой окраски в оранжево-желтую (бурую). Расчеты делали по формуле. Приложение №2
Определение нитратов NО3 — К анализируемой пробе минеральной воды, объемом 50мл. добавляем 5мл. 10%-ного раствора алюмокалиевых квасцов (9:1). В полученном растворе измеряют концентрацию ионов NО3 — нитратов на иономере. Полученные, данные переводят в мг/кг. С помощью коэффицента перевода 4,43.
Определение кислотности. Активная реакция воды обуславливается концентрацией водородных ионов и обозначается (pH). Иначе, рН — это водородный показатель. Для количественного определения щелочности или кислотности воды имеются разные методы: применяют универсальные индикаторы в форме порошка, используют бумажные лакмусовые индикаторы или определяют методом титрования.
Реакцию среды мы определяли прибором «pH-метр». Отобрали по 45мл. испытуемой воды, пробы налили в химические стаканы и измерили на pH-метре. Показания прибора зафиксировали. В воде пробу, которой брали в июле месяце pH=4,2, а в осенней испытуемой воде pH=4,0.
Вывод: вода источника имеет, кислую среду. Водородный показатель меньше-7, pH 2+ и Mg 2+ — концентрация ионов Ca и Mg в (мг/л).
Например: Жесткость воды (Ир-Сайлыг ) — 36мг экв/л (лето). Ж(общ) воды «Ир-Сайлыг» -57мг экв/л (осень). Расчеты показаны в Приложение №1.
Определение сухого остатка. Сухой остаток — это общее содержание, в исследуемой воде, растворенных, нелетучих, минеральных соединений. Частично, содержатся и органические соединения. Профильтруем 300см 3 минеральной воды. Добавляем, пипеткой, 25см 3 1% безводной соды. Раствор хорошо перемешиваем стеклянной палочкой и выпариваем в фарфоровой чашке. Фарфоровую чашку, предварительно сушим, до постоянной массы при 150 0 С.
источник
ПНД Ф 14.1;2.95-97 Количественный химический анализ вод. Методика выполнения измерений массовой концентрации кальция в пробах природных и очищенных сточных вод
ГОСУДАРСТВЕННЫЙ КОМИТЕТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПО ОХРАНЕ ОКРУЖАЮЩЕЙ СРЕДЫ
Заместитель Председателя Государственного комитета РФ по охране окружающей среды
_______________ А.А. Соловьянов
КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ ВОД
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
МАССОВОЙ КОНЦЕНТРАЦИИ КАЛЬЦИЯ
В ПРОБАХ ПРИРОДНЫХ И ОЧИЩЕННЫХ СТОЧНЫХ
ВОД ТИТРИМЕТРИЧЕСКИМ МЕТОДОМ
Методика допущена для целей государственного экологического контроля
Настоящий документ устанавливает методику количественного химического анализа проб природных и очищенных сточных вод для определения в них массовой концентрации кальция в диапазоне от 1,0 до 100 мг/дм 3 титриметрическим методом без разбавления и концентрирования пробы.
Если массовая концентрация кальция в анализируемой пробе превышает верхнюю границу, допускается разбавление пробы дистиллированной водой таким образом, чтобы концентрация кальция соответствовала регламентированному диапазону.
Определению мешают мутность, цветность, а также ионы металлов: алюминия (> 10 мг/дм 3 ), железа (> 10 мг/дм 3 ), меди (> 0,05 мг/дм 3 ), кобальта и никеля (> 0,1 мг/дм 3 ), вызывая нечеткое изменение окраски в точке эквивалентности. Другие катионы (свинец, кадмий, марганец (ІІ), цинк, стронций, барий) могут частично титроваться вместе с кальцием и повышать расход трилона Б.
Магний в условиях анализа осаждается в виде гидроксида и не мешает определению.
Устранение мешающих влияний осуществляется в соответствии с п. 10.
Титриметрический метод определения массовой концентрации кальция основан на его способности образовывать с трилоном Б малодиссоциированное, устойчивое в щелочной среде соединение. Конечная точка титрования определяется по изменению окраски индикатора (мурексида) из розовой в красно-фиолетовую. Для увеличения четкости перехода окраски предпочтительнее использовать смешанный индикатор (мурексид + нафтоловый зелёный Б). При этом в конечной точке титрования окраска изменяется от грязно-зеленой до синей.
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведённых в таблице 1.
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
Диапазон измерений, значения показателей точности, повторяемости, воспроизводимости, правильности
Диапазон измерений массовой концентрации кальция, мг/дм
Показатель точности (границы относительной погрешности при вероятности
Р = 0,95), ±?, %
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости),
sr, %
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости),
sR, %
Показатель правильности (границы относительной систематической погрешности при вероятности
Р = 0,95), ±?с, %
Весы лабораторные общего назначения с наибольшим пределом взвешивания 200 г и ценой наименьшего деления 0,1 мг любого типа
Весы лабораторные общего назначения с наибольшим пределом взвешивания 200 г и ценой наименьшего деления 10 мг любого типа
СО с аттестованным содержанием кальция с погрешностью не более 1 % при Р = 0,95
Цилиндры мерные или мензурки
4.2. Вспомогательные устройства
Плитки электрические с закрытой спиралью и регулируемой мощностью нагрева
Шкаф сушильный лабораторный с температурой нагрева до 130 °С
Стаканчики для взвешивания (бюксы)
Колбы конические или плоскодонные
Ступка фарфоровая с пестиком № 2 (3)
Колонка хроматографическая диаметром 1,5 — 2,0 см
Стекло часовое диаметром 5 — 7 см
Прибор вакуумного фильтрования ПВФ-35 или ПВФ-47
Средства измерений должны быть поверены в установленные сроки.
Допускается использование других, в том числе импортных, средств измерений и вспомогательных устройств с характеристиками не хуже, чем у приведенных в п.п. 4.1 и 4.2.
Динатриевая соль этилендиамин-N, N, N’, N-тетрауксусной кислоты, дигидрат (трилон Б, комплексон III)
Аммиак водный, концентрированный
или диэтилдитиокарбамат натрия
Мурексид (пурпурат аммония)
Эриохром черный Т (хромоген черный)
Бумага индикаторная универсальная
Фильтры мембранные Владипор типа МФАС-МА
или фильтры бумажные обеззоленные
Все реактивы, используемые для анализа, должны быть квалификации ч.д.а. или х.ч.
Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных, с квалификацией не ниже ч.д.а.
5.1. При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007.
5.2. Электробезопасность при работе с электроустановками обеспечивается по ГОСТ 12.1.019.
5.3. Организация обучения работающих безопасности труда проводится по ГОСТ 12.0.004.
5.4. Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
Выполнение измерений может производить химик-аналитик, владеющий техникой титриметрического метода анализа.
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
температура окружающего воздуха
не более 80 % при температуре 25 °С;
8.1. Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб».
8.2. Посуду, предназначенную для отбора и хранения проб, промывают раствором соляной кислоты 1:1, а затем дистиллированной водой.
8.3. Пробы воды отбирают в стеклянные бутыли. При фильтровании через любой фильтр первые порции фильтрата отбрасывают.
Объем отбираемой пробы должен быть не менее 300 см 3 .
8.4. Пробы не консервируют, хранят при комнатной температуре не более 6 месяцев.
Если в период хранения в пробе выпал осадок карбоната кальция, непосредственно перед анализом его растворяют прибавлением 0,5 — 1 см 3 концентрированной соляной кислоты, предварительно перелив с помощью сифона прозрачный слой над осадком в чистую сухую склянку. Затем перелитый раствор и жидкость с растворенным осадком соединяют вместе и нейтрализуют 20 % раствором гидроксида натрия, добавляя его по каплям и контролируя рН по индикаторной бумаге.
8.5. При отборе проб составляется сопроводительный документ по утвержденной форме, в котором указывается:
— цель анализа, предполагаемые загрязнители;
— должность, фамилия отбирающего пробу, дата.
9.1. Приготовление растворов и реактивов
9.1.1. Раствор трилона Б с концентрацией 0,02 моль/дм 3 эквивалента.
3,72 г трилона Б растворяют в 1 дм 3 дистиллированной воды. Точную концентрацию раствора устанавливают по стандартному раствору хлорида цинка, как описано в п. 9.2.
Раствор хранят в полиэтиленовой посуде не более 6 месяцев, проверяют его концентрацию не реже 1 раза в месяц.
9.1.2. Раствор хлорида цинка с концентрацией 0,02 моль/дм 3 эквивалента.
0,35 г металлического цинка смачивают небольшим количеством концентрированной соляной кислоты и сейчас же промывают дистиллированной водой. Цинк сушат в сушильном шкафу при 105 °С в течение 1 ч, затем охлаждают и взвешивают на лабораторных весах с точностью до 0,1 мг.
Навеску цинка помещают в мерную колбу вместимостью 500 см 3 , в которую предварительно вносят 10 — 15 см 3 дистиллированной воды и 1,5 см 3 концентрированной соляной кислоты. Цинк растворяют, после чего объем раствора доводят до метки на колбе дистиллированной водой.
Рассчитывают молярную концентрацию эквивалента раствора хлорида цинка Czn (1/2 ZnCl2), моль /дм 3 , по формуле:
где а — навеска металлического цинка, г;
32,69 — молярная масса эквивалента Zn 2+ , г/моль;
V — объём мерной колбы, см 3 .
Раствор хлорида цинка хранят в плотно закрытой стеклянной или полиэтиленовой посуде не более 2 месяцев.
7,0 г хлорида аммония растворяют в мерной колбе вместимостью 500 см 3 в 100 см 3 дистиллированной воды и добавляют 75 см 3 концентрированного раствора аммиака. Объем раствора доводят до метки на колбе дистиллированной водой и тщательно перемешивают.
Буферный раствор хранят в стеклянной или полиэтиленовой посуде не более 2 месяцев.
9.1.4. Индикатор эриохром черный Т.
0,5 г эриохрома черного Т тщательно растирают в ступке с 50 г хлорида натрия. Используют при определении точной концентрации раствора трилона Б.
0,2 г мурексида и 0,5 г нафтолового зеленого Б (или 0,2 г только мурексида) тщательно растирают в ступке со 100 г хлорида натрия.
Индикаторы устойчивы в течение 1 года при хранении в темной склянке.
9.1.6. Раствор гидроксида натрия, 20 %.
20 г NaOH растворяют в 80 см 3 дистиллированной воды.
9.1.7. Раствор гидроксида натрия, 8 %.
40 г NaOH растворяют в 460 см 3 дистиллированной воды.
9.1.8. Раствор гидроксида натрия, 0,4 %.
2 г NaOH растворяют в 500 см 3 дистиллированной воды. Растворы гидроксида натрия устойчивы при хранении в плотно закрытой полиэтиленовой посуде в течение 2 месяцев.
9.1.9. Раствор сульфида натрия.
2 г сульфида натрия растворяют в 50 см 3 дистиллированной воды. Хранят в плотно закрытой полиэтиленовой посуде не более 7 дней.
9.1.10. Раствор диэтилдитокарбамата натрия.
5 г диэтилдитиокарбамата натрия растворяют в 50 см 3 дистиллированной воды. Хранят не более 14 дней.
9.1.11. Раствор гидрохлорида гидроксиламина.
5 г гидрохлорида гидроксиламина растворяют в 100 см 3 дистиллированной воды. Хранят не более 2 месяцев.
9.1.12. Раствор соляной кислоты, 1:3.
200 см 3 концентрированной соляной кислоты смешивают с 600 см 3 дистиллированной воды. Хранят в плотно закрытой посуде не более 1 года.
9.1.13. Активированный уголь.
Подготовку активированного угля осуществляют в соответствии с Приложением А.
9.2. Установление точной концентрации раствора трилона Б
В коническую колбу вместимостью 250 см 3 вносят 10 см 3 раствора хлорида цинка (п. 9.1.2), добавляют дистиллированной воды приблизительно до 100 см 3 , 5 см 3 буферного раствора и 10 — 15 мг индикатора эриохрома черного Т. Содержимое конической колбы тщательно перемешивают и титруют из бюретки раствором трилона Б до перехода окраски из красной в голубую.
Титрование повторяют 2 — 3 раза и при отсутствии расхождения в объемах раствора трилона Б более 0,05 см 3 за результат принимают среднюю величину.
Концентрацию раствора трилона Б рассчитывают по формуле:
где Стр — концентрация раствора трилона Б, моль/дм 3 эквивалента;
Czn — концентрация раствора хлорида цинка, моль/дм 3 эквивалента;
Vтр — объем раствора трилона Б, пошедшего на титрование, см 3 ;
VZn — объем раствора хлорида цинка, см 3 .
Для устранения мешающего влияния катионов металлов к пробе перед титрованием прибавляют маскирующие реагенты: 0,5 см 3 раствора сульфида или диэтилдитиокарбамата натрия и 0,5 см 3 раствора гидрохлорида гидроксиламина.
Результаты определения могут также быть искажены в присутствии значительных количеств анионов (НСО3 — , СО3 2- , PО4 3- , SiО3 2- ). Для уменьшения их влияния пробу следует титровать сразу после добавления щёлочи.
Мешающее влияние взвешенных и коллоидных веществ устраняют фильтрованием пробы.
Если проба воды заметно окрашена за счёт присутствия веществ природного или антропогенного происхождения, затрудняется фиксация конечной точки титрования. В этом случае пробу перед выполнением анализа следует пропустить со скоростью 4 — 6 см 3 /мин через хроматографическую колонку, заполненную активированным углем (высота слоя 12 — 15 см). Первые 25 — 30 см 3 пробы, прошедшей через колонку, отбрасывают.
Как правило, окрашенные соединения антропогенного происхождения сорбируются активированным углем практически полностью, в то время как природного (гумусовые вещества) — лишь частично. При высокой и не устраняемой цветности пробы, обусловленной гумусовыми веществами, определение конечной точки титрования значительно облегчается использованием для сравнения перетитрованной пробы этой же воды (пробы-свидетеля).
11.1. Выбор условий титрования
Объём пробы воды для определения кальция выбирают исходя из известной величины общей жёсткости или по результатам оценочного титрования.
Если величина жёсткости составляет менее 4 ммоль/дм 3 , то для анализа берут 100 см 3 , 4 — 8 ммоль/дм 3 — 50 см 3 и более 8 ммоль/дм 3 — 25 см 3 пробы воды.
Для оценочного титрования берут 10 см 3 воды, добавляют 0,2 см 3 8 % раствора гидроксида натрия, 10 — 15 мг индикатора мурексида и титруют раствором трилона Б до перехода окраски со смешанным индикатором из грязно-зелёной в синюю, а при использовании только мурексида — из розовой в красно-фиолетовую. По величине израсходованного на титрование объема раствора трилона Б выбирают из таблицы 2 соответствующий объем пробы воды.
Объем пробы воды, рекомендуемый для определения кальция по результатам оценочного титрования
Объем израсходованного раствора трилона Б, см 3
источник
Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
состав растворенных газов.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей.
Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или
12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO32 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO32 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общаяжесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам:
Общая жесткость
Карбонатная жесткость равна концентрации (мг/л) [HCO3– ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:
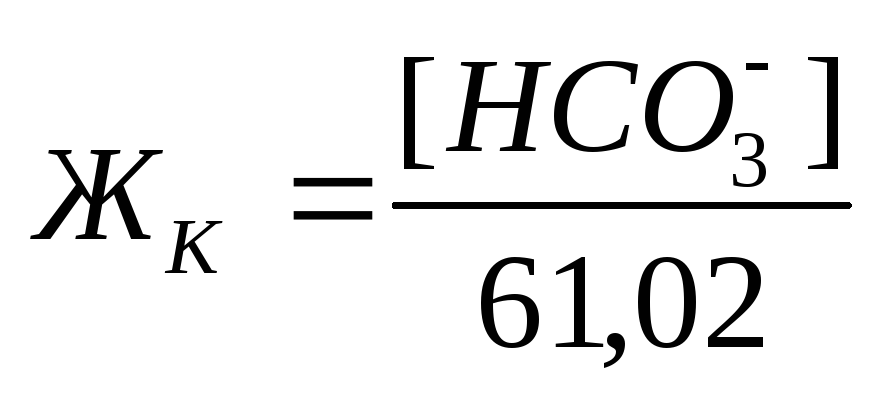
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК= ЖО– ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Окисляемость характеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества.
Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме
требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л.
При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Определение иона Cl – . В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO42– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO42– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO42– .
Определение ионов CO32– и HCO3– . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии.
Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO32 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО32– и НСО3– , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния:
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)
N
образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет.
Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:
Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна:
С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка.
Растворенные в воде газы определяют химическими методами или газовой хроматографией.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
Определение растворенного кислорода производится йодометрическим методом.
Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом:
Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе:
Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия:
I2+ 2Na2S2O3
Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II):
Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску.
В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания.
Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом.
В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом:
К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе.
источник
Химический анализ природной и питьевой воды. Метод ионообменной хроматографии и титриметрический метод определения ионов кальция и магния. Особенности приготовления растворов. Устранение мешающего влияния катионов железа, марганца, цинка, меди и олова.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Методика определения ионов кальция и магния в природных водах (определение общей жесткости воды)
2. Приготовление растворов
3.1 Титриметрический метод
3.2 Метод ионообменной хроматографии
Химический анализ природной и питьевой воды показывает, что любая вода представляет собой не чистое вещество с формулой Н2О, а смесь большого количества веществ.
Многочисленные анализы природных вод показали, что среди большого числа компонентов, растворенных в них, 90 % солесодержания составляют карбонаты, гидрокарбонаты, хлориды и сульфаты кальция, магния и натрия. О.А. Алекиным предложена классификация природных вод по результатам их химического анализа. По преобладающему аниону воды делятся на три класса: карбонатные (гидрокарбонатные), хлоридные и сульфатные. По преобладающему катиону воды делятся на три группы: кальциевые, магниевые и натриевые.
В природных водах постоянно находятся ионы кальция и магния, обеспечивающие жесткость воды. Источник их поступления в воду — растворение гипса, известняков и доломитов, входящих в состав горных пород. В санитарно-гигиеническом отношении ионы кальция и магния не представляют большой опасности, но чрезмерная жесткость воды делает ее непригодной для бытовых целей, т.к. образующаяся накипь выводит из строя нагревательные элементы электрических систем нагрева воды. Оптимальная жесткость воды — до 7 мг-экв/л.
Для определения ионов кальция и магния используются два метода:
2. метод ионообменной хроматографии
1. Наиболее точный и распространенный метод определения общей жесткости — комплексометрический, основанный на образовании ионами Са 2+ и Mg 2+ прочных внутрикомплексных соединений с трилоном Б. В качестве индикатора при определении общей жесткости используется эриохром черный. В зависимости от общей жесткости концентрация рабочего раствора трилона Б и объем пробы воды могут быть различными.
Для определения кальция в природных водах преимущественно используются трилонометрический метод с индикатором мурексидом.
Содержание магния проводят расчетным методом, зная общую жесткость и содержание кальция.
2. Приготовление растворов
Раствор трилона Б с концентрацией 0,02 моль/дм 3 эквивалента.
Навеску 3,72г. трилона Б растворяют в 1 дм 3 дистиллированной воды. Точную концентрацию устанавливают по стандартному раствору хлорида цинка. Раствор хранят в полиэтиленовой посуде, проверяют его концентрацию не реже 1 раза в месяц.
Раствор хлорида цинка с концентрацией 0,02 моль/ дм 3 эквивалента.
Отвешивают на технических весах около 0,35 г металлического цинка, смачивают его небольшим количеством концентрированной соляной кислоты и сейчас же промывают дистиллированной водой. Цинк сушат в сушильном шкафу при 105 течение 1ч, затем охлаждают и взвешивают на аналитических весах.
Навеску цинка помещают в мерную колбу вместимостью 500 см 3 , в которую предварительно вносят 10-15 см 3 дистиллированной воды и 1,5 см 3 концентрированной соляной кислоты. Цинк растворяют. После растворения цинка объём раствора доводят до метки на колбе дистиллированной водой. Рассчитывают молярную концентрацию эквивалента раствора хлорида цинка CZn(1/2 ZnCl2), моль/дм 3 , по формуле:
где m — навеска металлического цинка, г; 32,69 — молярная масса эквивалента Zn 2+ , г/моль; V — объём мерной колбы, см 3 .
Буферный раствор NH4Cl +NH4OH.
7,0 г хлорида аммония растворяют в мерной колбе вместимостью 500 см 3 в 100 см 3 дистиллированной воды и добавляют 75 см 3 концентрированного раствора аммиака. Объем раствора доводят до метки дистиллированной водой и тщательно перемешивают. Буферный раствор хранят в стеклянной или полиэтиленовой посуде не более 2 месяцев. Гидроксид натрия, 2 моль/дм 3 .
40 г гидроксида натрия растворяют в мерной колбе вместимостью 500 см 3 и раствор доводят до метки дистиллированной водой.
Индикатор эриохром черный Т.
Растереть в ступке 0,25 г эриохрома черного Т с 50 г хлорида натрия.
0,5 г мурексида растереть с 100 г хлорида натрия. Водный раствор лучше не готовить, т.к. мурексид нестоек в растворе.
Раствор сульфида натрия, 4%.
2 г сульфида натрия растворяют в 50 см 3 дистиллированной воды. Хранят в плотной закрытой полиэтиленовой посуде не более недели.
Раствор гидрохлорида гидроксиламина.
5 г гидрохлорида гидроксиламина растворяют в 100 см 3 дистиллированной воды. Хранят не более 2 месяцев.
Установление точной концентрации раствора трилона Б.
В коническую колбу вместимостью 250 см 3 вносят 10 см 3 раствора хлорида цинка, добавляют дистиллированной воды приблизительно до 100 см 3 , 5 см 3 буферного раствора и 10-15 мг индикатора эриохрома чёрного Т. Содержимое конической колбы тщательно перемешивают и титруют из бюретки раствором трилона Б до перехода окраски красной в голубую. Концентрацию раствора трилона Б рассчитывают по формуле:
3.1 Титриметрический метод
Определение ионов кальция и магния
Устранение мешающих ионов
Для устранения мешающего влияния катионов железа, цинка, меди и олова в пробу добавляют 0,5 мл раствора сульфида натрия.
Для устранения мешающего влияния марганца в пробу добавляют 0,5 мл солянокислого раствора гидроксиламина.
Перед выполнением анализа пробы воды с неизвестной величиной жёсткости проводят оценочное титрование. Для этого берут 10 см 3 воды, добавляют 0,5 см 3 буферного раствора, индикатор (эриохром чёрный Т) и титруют до перехода окраски из красной в голубую. По величине израсходованного трилона Б выбирают из таблицы 1 соответствующий объём пробы воды.
ионообменный хроматография вода магний
Таблица 1. Объём пробы воды, рекомендуемый для определения жёсткости по результатам оценочного титрования
Объём израсходованного раствора трилона Б, см 3
Рекомендуемый объём пробы, см 3
v Определение суммы кальция и магния
К пробе необходимого объёма (см. Оценочное титрование) 100 см 3 добавляют 5 см 3 буфера, индикатор (эриохром чёрный Т) на шпателе. Сразу же титруют при перемешивании до перехода окраски от винно-красной к синей.
К пробе необходимого объёма (см. Оценочное титрование) 100 см 3 добавляют 2 см 3 NaOH (2н) и индикатора (мурексид) на шпателе. Титруют до перехода окраски от красной в фиолетовую. Окраску раствора следует сравнивать с цветом перетитрованного раствора.
Содержание кальция высчитывают по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; V’ тр — объем трилона Б, пошедший на титрование с мурексидом, см 3 (см. Определение кальция); 20,04 — масса эквивалента Ca 2+ ; Vпробы — объем пробы, взятый для анализа, см 3 .
Содержание магния высчитывают по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; V тр — объем трилона Б, пошедший на титрование с эриохромом черным Т, см 3 (см. Определение суммы кальция и магния); V’тр — объем трилона Б, пошедший на титрование с мурексидом, см 3 (см. Определение кальция); 12,15- масса эквивалента Mg 2+ ; Vпробы- объем пробы, взятый для анализа, см 3 .
v Определение общей жесткости воды
Общую жесткость находят по формуле:
где Стр — молярная концентрация эквивалента трилона Б, моль/дм 3 ; Vтр — объем раствора трилона Б, пошедшего на титрование пробы, см 3 ; Vпробы — объем пробы, взятый для анализа, см 3 .
Метод добавок. Для определения данным методом в пробу вводят добавку, равную 50-150% (желательно 100%) жёсткости воды (см. Определение общей жёсткости воды) ГСО 8206-2002.
Затем высчитывают общую жесткость воды с добавкой.
a. Результаты измерений, полученных в условиях воспроизводимости для пробы 1.
Проба 1: оз. Среднее, с. Озёрное, 85 км от берега, дата: 1.10.13, время: 16.55, t = +3.
Установлена точная концентрация трилона Б: Стрилона = 0,002226 (моль/дм 3 ). При выполнении оценочного титрования объем необходимой пробы соответствует 100 (мл).
источник
Аналитический центр более 20 лет занимается химическим анализом и разработкой новых методов анализа и диагностики веществ и материалов
В нашем распряжении самый современный приборный парк благодаря научно-техническому взаимодействию с крупнейшими мировыми разработчиками аналитического оборудования
Наши сотудники — это лучшие специалисты страны в области химического анализа, кандидаты и доктора наук
Аккредитация позволяет исследовать питьевую, природную, морскую, технологическую, талую воду и воду бассейнов
Обратившись к нам, Вы получите не только точные данные о присутствующих в воде загрязнителях, но и подробные рекомендации о способах очистки воды.
На основании анализа воды БЕСПЛАТНО подберем несколько вариантов систем водоочистки!
В нашей лаборатории Вы можете проверить качество воды из любого источника: колодца, скважины, водопровода, бассейна, родника, водоема. Для каждого источника есть оптимальный набор показателей, характеризующий возможность использования воды для тех или иных нужд. Чтобы правильно подобрать набор показателей, свяжитесь с нами по номеру +7 (495)149-23-57 или напишите на почту info@ion-lab.ru
Мы рекомендуем выбирать набор параметров в зависимости от того, какой у Вас источник водоснабжения, а также для каких целей планируете использовать воду. Для воды из городского водопровода, а также для воды, используемой в технических целях, подойдут наборы «Минимальный» или «Начальный». Для воды природных источников (скважины, колодцы, родники и т.д.) мы рекомендуем проверить воду на химический состав (наборы «Расширенный» или «Максимальный»), а также сделать анализ на микробиологию.
Да, Вы можете самостоятельно отобрать воду для анализа, следуя инструкции. Или же заказать выезд специалиста, который приедет в назначенное время со всей необходимой тарой, отберет воду и доставит ее в лабораторию.
Да, конечно! Пункт приема проб расположен по адресу: Москва, ул. Добролюбова, 21А, корпус А, пом. 14 (в пешей доступности от метро Фонвизинская, Бутырская, Тимирязевская)
Стоимость выезда специалиста зависит от выбранного Вами набора показателей и удаленности. Более точная информация размещена в разделе Доставка и оплата
© 1997-2019 — Лаборатория ИОН. Все права защищены.
Для химического анализа необходимо заполнить водой чистую пластиковую тару (оптимально 1,5 л). Использовать бутылки из-под сладких, газированных или ароматизированных напитков, а также солёной или минеральной воды недопустимо.
Если выбранный Вами анализ включает определение содержания нефтепродуктов, необходимо заполнить дополнительную стеклянную тару объемом 0,2 л.
Если выбранный Вами анализ включает определение содержания сероводорода, необходимо заполнить дополнительную стеклянную тару объемом 0,5 л (необходимо использовать консервант).
При отборе воды из проточного источника, непосредственно перед отбором необходимо пролить воду сильной струёй в течение 3-5 минут. Перед отбором проб ёмкости и крышки необходимо 3 раза промыть изнутри водой, подлежащей анализу. Использование моющих средств недопустимо. Наполнять тару необходимо тонкой струёй по стенке сосуда «под горлышко». Это снижает насыщение воды кислородом и предотвращает протекание реакций.
Для микробиологического анализа необходимо использовать стерильный контейнер для биоматериалов объемом 150-200 мл.
Перед взятием пробы необходимо протереть водопроводный кран спиртовой салфеткой, уделив особое внимание месту выхода воды.
При отборе воды из водопровода, скважины или колонки необходимо пролить воду сильной струёй в течение 3–5 минут.
При отборе воды из колодца с помощью ведра необходимо обдать ведро кипятком для дезинфекции. Отбор пробы через поливочные шланги и предметы, контактирующие с почвой, не допускается.
Для отбора пробы необходимо надеть перчатки и вскрыть упаковку стерильного контейнера. Не касаясь внутренней поверхности ёмкости, отобрать образец воды (2/3 объема контейнера) и закрыть крышкой.
Рекомендуем доставлять пробу сразу после отбора.
Если сразу после отбора нет возможности доставить пробу в лабораторию, допускается хранение образцов при температуре 2–10 °C в течение 1 суток.
Съезд на ул. Руставели, на первом светофоре поворот налево на ул. Яблочкова.
Через 300 м поворот направо на ул. Гончарова, через 500 м поворот налево (напротив дома №6), через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Поворот на ул. Руставели, на светофоре поворот направо на ул. Добролюбова, через 300м на светофоре поворот налево на ул. Гончарова, напротив дома №6 поворот направо, через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Двигаясь по ул. Милошенкова, поворачиваем на ул. Добролюбова
Через 150 метров поворот направо, за домом 21АкБ поворот налево, через 100-120 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Ближайшее станция метро – Фонвизинская (600 м)
Последний вагон из центра. Выход в сторону улицы Фонвизина. Из стеклянный дверей направо. Перейти через пешеходный переход и идти через дворы в соответствии со схемой. Пункт назначения — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Анализ «Минимальный» содержит минимальный и обязательный перечень загрязнителей, часто встречающихся в питьевой воде, и включает 16 показателей:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний;
- анионы: нитраты, карбонат, гидрокарбонат.
Данный набор рекомендуется для исследования воды хозяйственно-бытового назначения. Анализ «Минимальный» не обладает достаточной информативностью для подбора системы водоочистки, так как не позволяет получить полную картину о безопасности воды. Если Вы планируете использовать воду в питьевых целях, рекомендуем обратить внимание на наборы, содержащие большее число параметров.
- Точность определения
- Подходит для воды, применяемой в хоз-бытовом назначении
- Срок выполнения — 3-4 рабочих дня
- Не подходит для воды, применяемой в питьевых целях
- Не подходит для корректного подбора фильтров
- Не содержит определения опасных загрязнителей
Анализ «Начальный» предназначен для выявления наиболее часто встречающихся вредных веществ в питьевой воде и включает 23 параметра: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность свободная, щелочность общая, железо, марганец, калий, магний, кальций, фториды, хлориды, нитраты, сульфаты, карбонат, гидрокарбонат, аммоний Данный анализ рекомендуется для оценки качества воды из колодцев, скважин, родников. По протоколу анализа «Начальный» возможен подбор системы водоочистки и типа фильтрующей загрузки. В перечень определяемых параметров входят органолептические показатели, общие химические показатели, а также содержание катионов и анионов
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
- Не содержит перечень тяжелых металлов
- Не содержит перечень всех опасных загрязнений
- Срок выполнения исследований 5-6 рабочих дней
Анализ «Расширенный» содержит перечень наиболее часто встречающихся загрязнителей воды, вне зависимости от источника, и включает 31 показатель: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, алюминий, железо общее, магний, кальций, калий, натрий, марганец, медь, мышьяк, свинец, кадмий, цинк, стронций, фториды, хлориды, нитраты, сульфаты, гидрокарбонат, карбонат. Данный набор рекомендуется, в первую очередь, владельцам колодцев и скважин. Содержит перечень основных тяжелых металлов. Перед покупкой системы водоподготовки рекомендуем провести исследование воды с данным перечнем загрязнителей. Ориентируясь на полученную информацию, Вы сможете подобрать оборудование водоочистки с эффективностью до 98%, а так же корректно его настроить.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Содержит перечень тяжелых металлов
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
Анализ «Максимальный» содержит полный перечень опасных для здоровья человека веществ, встречающихся в воде, поступающих из скважин или колодцев, включая ионы тяжелых металлов и органические вещества, а именно: мутность, цветность, запах, привкус, рН, жесткость, окисляемость, минерализация, электропроводность, щелочность общая, щелочность свободная, аммоний, натрий, калий, магний, кальций, алюминий, железо, марганец, литий, барий, бериллий, бор, ванадий, молибден, кобальт, цинк, никель, хром, стронций, кадмий, мышьяк, медь, свинец, кремний, серебро, титан, ртуть, гиброкарбонат, карбонат, нитрат, хлорид, сульфат, фосфат, фторид, нитрит, сероводород, сульфид, гидросульфид, хлор общий, хлор остаточный, хлор остаточный свободный, АПАВ, нефтепродукты, фенол, формальдегид, бензол, толуол, о-ксилол, п-ксилол, м-ксилол, стирол Данное исследование рекомендуется для клиентов, которые серьезно относятся к выбору питьевой воды. Протокол анализа «Максимальный» позволяет со 100% уверенностью сделать вывод о пригодности воды для питья и приготовления пищи. Результаты исследования позволяют выбрать схему водоочиски, а также оценить эффективность уже установленного оборудования.
Воды, применяемой в хозяйственно-бытовом назначении; оценки работы системы водоочистки.
пластиковая бутылка 1,5 — 2 л.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для любых источников воды
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Включает полный перечень тяжелых металлов
- Позволяет корректно и экономично настроить водоочистное оборудование
- Содержит полный перечень опасных органических веществ
Помимо хичиеского анализа воды мы настоятельно рекомендуем провести микробиологическое исследование Вашей воды. Микробиологический анализ воды включает определение общего микробного числа (ОМЧ), количества общих колиформных и колиформных термотолерантных бактерий.
источник
Из всех элементов, кальций, один из самых известных и обсуждаемых. И это неудивительно, ведь его роль в организме трудно переоценить. Известно, что дефицит кальция, а также его переизбыток приводят к разного рода проблемам и заболеваниям.
К альций выполняет в организме человека очень много важных функций: регулирует свертываемость крови, участвует в процессах роста и деятельности клеток всех видов тканей в организме, участвует в процессах ощелачивания организма, обеспечивает прохождение электрических импульсов по нервным волокнам.
Кальций самый распространенный макроэлемент в организме человека, большая его часть содержится в скелете и зубах в виде фосфатов. В организме человека содержится 1,4-2 % Са3(РО4)2 и 13 % СаСО3.
В соответствии с общепринятыми рекомендациями, норма кальция в организме человека для взрослых составляет от 800 до 1200 миллиграмм. Для детей эта норма от 600 до 900 миллиграмм. Кальций вместе с фосфором составляет основу костной ткани, активизирует деятельность ряда важнейших ферментов, участвует в поддержании ионного равновесия в организме, влияет на процессы, происходящие в нервно-мышечной и сердечно-сосудистой системах, влияет на свертываемость крови.
Кальций также является важным элементом для поддержания рН на необходимом для всех систем и среды организма уровне. Например, рН крови — одна из самых жестких постоянных величин человеческого организма. В норме этот показатель составляет в пределах 7,4 (±0,02). Изменение этого показателя на 0,3 приводит к гибели человека.
Наибольшее количество кальция содержится в молоке, молочных продуктах (твороге, твердых сырах), яйцах, рыбе, в зеленых овощах, орехах. Один из источников кальция — это питьевая вода. С водой мы получаем от 10 до 30% суточной нормы кальция (в зависимости от жесткости и химического состава воды).
Одним из общеизвестных показателей качества и свойств воды является её жесткость, которая зависит от содержания в ней растворенных солей кальция и магния. Суммарное содержание этих солей определяет общую жесткость. Общая жесткость воды разделяется на карбонатную, обусловленную концентрацией гидрокарбонатов кальция и магния, и некарбонатную, определяемую концентрацией в воде кальциевых и магниевых солей сильных кислот. Жесткость воды формируется в результате растворения пород, содержащих кальций и магний. Обычно преобладает кальциевая жесткость, обусловленная растворением известняка и мела, однако в местах, где больше доломита, чем известняка, может преобладать и магниевая жесткость. В результате некоторых районах содержание кальция в воде может доходить до 300 мг/литр. Есть питьевые воды, которые продаются в магазинах, с содержанием кальция до 100 мг/литр. И здесь важно отметить, что 80% растворимого кальция мы получаем именно с водой. Таким образом, постоянное употребление воды с высоким содержанием кальция может привести к возникновению мочекаменной болезни и другим проблемам со здоровьем.
Выдержка из «Руководства по контролю качества питьевой воды». Всемирная Организация Здравоохранения (ВОЗ). Женева 1987 год
кальция в воде
с водой(%)
общее кальция поступление с пищей и водой: 1000 мг кальция в сутки
Типичный вклад воды в общее поступление кальция в организм составляет около 10-20 %.
Продолжительный дефицит кальция в ежедневном рационе приводит к судорогам, болям в суставах, остеопорозу, проблемам с ЖКТ, сердечно-сосудистой системой. Симптомами недостатка кальция является повышенная сонливость, раздражительность, ломкость ногтей, проблемы с кожей и зубами.
Как уже было отмечено, 80% растворенного кальция человек получает с питьевой водой. При этом, практически все жидкости в системе человеческого организма являются либо нейтральными, либо слабощелочными, за исключением желудочного сока: рН желудочного сока составляет — 1,0; здоровой крови — 7,43; здоровой лимфы — 7,5; слюны — 7,4. Повышение кислотности водной среды организма является одной из причин многих заболеваний. Появляются нарушения иммунной системы, плохо усваиваются витамины и микроэлементы, возникают заболевания сосудов, сердца, суставов, крови и многие другие патологические состояния организма. При этом организм постоянно ищет резерв щелочи для нейтрализации лишних кислот, т.к. кальций, помещенный в любую жидкость, нейтрализует избыточную кислотность. И резерв этот – костная ткань, зубы, суставы. В результате происходит «вымывание» кальция из костей, развивается остеопороз, появляются наросты, т.к. организм начинает строить кости из стронция.
По оценке специалистов Института Питания РАМН к 40 годам дефицит кальция наблюдается у 50% населения, к 60 годам у 90 %. Следует отметить, что при напряженной физической работе, усиленных тренировках, ограничении движений, чрезмерном употреблении кофе, энергетических напитков и алкоголя, также происходит интенсивное выведение солей кальция из организма.
Дефицит кальция может стать причиной более 100 заболеваний. Но избыток кальция в организме может вызвать гиперкальцемию (избыточное содержание кальция в крови) и вызвать нарушения в функционировании мышечных и нервных тканей, свертываемости крови, усвояемости цинка клетками костной ткани, вызывать появление камней в почках и другие проблемы.
Как говорится в руководстве по качеству питьевой воды ВОЗ «высокие концентрации минеральных веществ в воде увеличивают жидкостную нагрузку на почки, особенно сильно это проявляется у маленьких детей. Комитет по проблемам питания Немецкого Общества Педиатров настаивает, что потребители питьевой воды должны иметь ясное представление о концентрациях кальция и магния в питьевой воде, и ссылок на жесткость воды для этого недостаточно. Дети в конце периода грудного вскармливания, которые получают в основном детское питание на растительной основе и дети раннего возраста, употребляющие вегетарианскую пищу, могут получать значительное количество кальция и/или магния из питьевой воды».
Основными симптомами избытка кальция в организме являются снижение или потеря аппетита, появление тошноты, рвоты, жажды. Человек ощущает слабость, могут появиться ночные судороги. Появляются запоры, боли в низу живота. Если не устранить избыток кальция вовремя, возможны также нарушения функций головного мозга, приводящие к галлюцинациям, спутанности сознания и нарушениям сна.

Известный ученый, академик Одесской региональной академии наук, автор книг «Как родить здорового малыша», «Вода здоровья и долголетия», Н.Г. Друзьяк, долгое время занимался изучением факторов, определяющих долгожительство в определенных районах Евразии. В результате 20-летней работы он определил, что одной из главных причин долгожительства в Якутии, Абхазии, Дагестане, Нагорном Карабахе, а также в некоторых районах Северного Кавказа, в Нахичеване и в Лерикском районе Азербайджана, является местная природная вода с содержанием ионов кальция в пределах от 8 до 20 мг/л. Там, где содержание кальция в воде было меньше или больше указанного интервала, число долгожителей резко снижалось. О полезных свойствах воды с невысоким уровнем содержания кальция пишет также в своей книге «Вода – наместник Бога на Земле» Юрий Андреев. Об этом же говорит д.м.н., профессор и академик РАЕН Иван Павлович Неумывакин в книге «Вода − жизнь и здоровье. Мифы и реальность» и многие другие ученые и исследователи.
Таким образом, излишки, как и недостаток минералов, микро-макроэлементов, в том числе кальция, в воде могут привести к серьезным проблемам со здоровьем. Именно поэтому лучшим выбором является вода, обладающая сбалансированным минерально-солевым составом в пределах 150-350 мг/л с содержанием кальция 8-25 мг/л.
Физиологически полноценная питьевая вода
Физиологически полноценная питьевая вода — это вода, содержащая минеральные вещества, необходимые организму человека в строго определенных количествах. Санитарными нормами и правилами (СанПиН) определены жизненно важные элементы, содержание которых регламентировано (йод, фтор, кальций, магний, калий и др., всего более 100 показателей).
Аквалайн — физиологически полноценная питьевая вода ФППВ (47;78) для жителей Санкт-Петербурга и Ленинградской области – региональный эталон питьевой воды.
Физиологически полноценная питьевая вода «Аквалайн Природная Премиум» добывается в экологически безупречных местах Карельского перешейка на расстоянии 70 км от Санкт-Петербурга из артезианской скважины с глубины 170 метров. На такой глубине отсутствует патогенная бакофлора, вода проходит естественную минерализацию и фильтрацию и не требует дополнительной обработки. При производстве не нарушаются исходный баланс микроэлементов, структура и свойства воды. Розлив воды осуществляется непосредственно на источнике в автоматическом режиме по методу «непрерывной струи». Общий уровень минерализации воды «Аквалайн» — 150-350 мг/литр является оптимальным, в том числе по минерально-солевому составу и органолептическим свойствам для жителей Санкт-Петербурга и Ленинградской области. Такая вода несет пользу на молекулярном уровне, сохраняя естественный водный баланс организма и обеспечивая поступление необходимых ему минеральных веществ, микро и макронутриентов.
- В.А. Тутельян «Научные основы здорового питания»
- И.П. Неумывакин «Вода − жизнь и здоровье. Мифы и реальность»
- Ю. Андреев «Вода – наместник Бога на Земле»
- М. Ахманов «Вода, которую мы пьем»
- Рекомендации ВОЗ
источник