Определение жесткости воды в современном мире – это обязательное условие для обеспечения работоспособности всей техники, работающей с ней. Тем не менее нельзя сказать, что такая жидкость действительно вредна для человека. Всего должно быть в меру, ведь излишне мягкая вода наносит не меньше ущерба здоровью, чем жесткая.
Начинать всегда следует с самых азов, чтобы было полное понимание проблемы. В нашем случае, прежде чем приступать к определению жесткости воды, сначала нужно понять, что она собой представляет. По результатам экспертизы, проведенной в 2011 на кафедре химии и экологии Новгородского университета им. Ярослава Мудрого, для природной натуральной воды жесткость является абсолютно нормальным явлением. Вплоть до момента появления современной техники этот вопрос вообще мало кого интересовал, тысячелетиями люди спокойно употребляли ее в том виде, в котором она есть. Придают воде жесткость растворенные в ней соли магния и кальция. Само понятие жесткости возникло по результатам ощущения людей, так как когда насыщенная этими солями и другими элементами вода вступает во взаимодействие с мылом, пена практически не образуется, затрудняя стирку или мытье.
Прежде чем понять, какую воду пить, следует учитывать тот факт, что жесткость не является однородной величиной. Есть как минимум две основные разновидности:
Зависят эти виды от типа растворенных солей, которые в любой жесткой воде присутствуют всегда вместе, составляя общую жесткость. Тем не менее разделять их можно и нужно. Временная жесткость напрямую зависит от наличия бикарбонатных и гидрокарбонатных анионов. Главная их особенность – разложение во время кипячения. В результате распада получается непосредственно сама вода, углекислый газ и карбонат кальция, который уже практически не растворяется. Получается, что от временной жесткости можно без особых проблем избавиться при помощи простого поднятия температуры воды до +100 градусов. В качестве примера можно привести любой чайник. После продолжительного использования можно обнаружить внутри осадок, который и является результатом описанного выше процесса распада. Все же, что не разлагается подобным образом, относится к постоянной жесткости, избавиться от которой без специальной обработки практически невозможно.
Это необходимо для того, чтобы понимать, какую воду пить можно без опаски, а также для того, чтобы любая техника, взаимодействующая с водой, не вышла из строя. Для человека излишне жесткая вода вредна. Но даже если этот параметр будет находиться на приемлемом для нашего организма уровне, все равно оборудование это не устроит. Аквариумы, кофейные, стиральные и посудомоечные машины, чайники, мультиварки и множество других вариантов техники требует воду строго определенной жесткости. Обычно справиться с этим помогают фильтры типа «Гейзер-3», однако зачастую такая мера может даже считаться излишней. Прежде чем тратить на них деньги, рекомендуется сначала провести тест на жесткость воды, ведь вполне возможно, что этот показатель и так на нормальном уровне.
Как уже было сказано выше, в первую очередь ущерб человеку наносит не какой-то определенный тип воды, а полное отсутствие баланса в организме.
- Плохое растворение пищевых продуктов (связано с катионами Ca 2 + и Mg 2 +).
- Кофе, чай и любые другие подобные напитки завариваются очень плохо.
- При длительном употреблении возможно расслабление желудка.
- Жесткая вода может стать причиной образования камней в почках.
- Насыщает организм требуемыми ему элементами.
- Улучшает состояние зубов, уменьшает вероятность возникновения кариеса.
- Жесткая вода является причиной поломки большинства видов техники.
- Выводит шлаки, но попутно вымывает полезные элементы (калий, магний и кальций). В результате кости становятся более хрупкими. Также не лучшим образом воздействует на сердечно-сосудистую систему.
- Негативно воздействует на гипофиз-адреналиновую систему.
- Оказывает плохое влияние на водно-солевой баланс организма.
Таким образом, определение жесткости воды должно производится не с целью избавиться от нее, а для того, чтобы свести негативное воздействие к минимуму и привести употребление такой жидкости к требуемому организмом балансу.
Согласно ГОСТу, питьевая вода должна проверяться на жесткость строго в лаборатории, посредством титриметрического анализа. Для этого сначала необходимо взять пробы, объем которых должен быть не менее 400 кубических сантиметров (0,4 литра). В качестве емкости, в которой будет производиться хранение, может использоваться любая тара, если она изготовлена из стекла или полимерного материала. Очень важно провести анализ не позднее чем через 24 часа после отбора пробы. В особых случаях, когда необходимо увеличить этот срок, производится подкисление жидкости посредством добавления соляной кислоты. В таком состоянии она может храниться уже около 1 месяца.
Среди всех методов определения жесткости воды данный вариант заслуженно считается самым достоверным и комплексным. В его основе лежит процесс образования соединений трилона вместе со щелочноземельными элементами ионов. Минимальный показатель жесткости, который поддается определению при помощи этого способа, – 0,1 о Ж (нормой считается 7-10 о Ж). В качестве пробы может быть использована обычная вода из-под крана. Лучшим выходом в ситуации с подозрением на повышенную жесткость является сразу же посетить соответствующую лабораторию, так как никакие домашние методы не смогут выдать точные данные. Но о них — ниже.
Полностью описывать весь процесс нет никакого смысла, так как воспроизвести его самостоятельно, без нужных навыков и химических элементов и оборудования невозможно. Тем не менее можно выделить несколько основных принципов реакции, которые сохраняются в любой ситуации и присущи абсолютно всем вариантам:
- Всегда должен быть способ, позволяющий зафиксировать эквивалентность реакции, которая и является основой для определения жесткости.
- Анализ проводится очень быстро.
- Должно выполняться требование стехиометричности процесса. Проще говоря, это значит, что в процессе проведения реакции не должны образовываться никакие побочные продукты.
- С момента начала реакции ее невозможно повернуть вспять или остановить.
Для определения жесткости воды в домашних условиях можно использовать специальные приспособления, купить которые не составит особого труда (они не запрещены и общедоступны). Выглядят они как стандартные тестовые полоски. Для использования достаточно погрузить одну из них в воду, требующую проверки, на указанный в инструкции период времени. В результате изделие изменит свой цвет. При использовании таких полосок для определения жесткости воды главной проблемой является определить, каков именно показатель жесткости. Чтобы это сделать, нужно сравнивать цвет на полосе и примеры с описанием на упаковке. К сожалению, далеко не всегда можно сразу же понять, что именно показывает приспособление, и даже в более четкой ситуации точность данных оставляет желать лучшего. В целом такие тест-полоски подходят только для общего понимания того, насколько жесткая или мягкая вода.
Проверить воду из-под крана на жесткость также можно при помощи подручных средств. Правда, это скорее занимательный опыт для детей, чем действительно вариант тестирования показаний жидкости.
- Банку емкостью 1 литр (или любую другую подобную емкость).
- Стакан в форме цилиндра.
- Любые весы (удобнее всего использовать электронные).
- Линейку.
- Мыло хозяйственное (72% или 60%).
- Дистиллированную воду.
Для проверки необходимо взять 1 грамм мыла, измельчить его и поместить в стакан. После этого следует подогреть дистиллированную воду, но не доводить до кипения. Ее следует налить в тот стакан, в котором уже лежит мыло. В итоге оно обязано растворится в воде. Следующий шаг – налить еще больше воды. После этого следует налить в банку обычной воды из-под крана и медленно вылить мыльную жидкость из стакана и перемешать (медленно). Если образуется пена, то это — показатель жесткости. К сожалению, более или менее четко сказать, каков именно ее уровень, при помощи такого метода практически невозможно.
Еще один вариант определения жесткости питьевой воды – воспользоваться специальным прибором – TDS-метром. В принципе, он предназначен для определения электропроводимости воды, на что влияют как непосредственно соли (создающие жесткость), так и множество других элементов, что не дает нужного уровня точности. Более того, показания прибора обычный человек, не умеющий их считывать, не поймет и скорее всего запутается. Попробуем упростить задачу. Подавляющее большинство таких устройств в качестве единиц измерения используется некие ppm. У нас же применяются другие варианты, основанные на эквиваленте миллиграмма на литр жидкости. В среднем, 1 наша единица (мг-экв/л) равняется 50,05 зарубежным ppm. По правилам, концентрация солей (т.е. жесткости) должна быть не более 350 ppm или же 7 мг-экв/л. На эти цифры и стоит ориентироваться. Если же прибор будет отечественным, все значительно облегчается. Хуже всего, когда подобное приспособление произведено где-то в Китае или другой подобной стране, где используются собственные единицы измерения. Тогда придется самостоятельно искать их эквивалент и переводить в привычные нам показания.
Из других приборов, способных определять жесткость воды, отдельно следует отметить уникальное устройство АКМС-1. Это достаточно большой стационарный агрегат, сходный по размерам с фильтрами «Гейзер-3». Просто так в домашних условиях с его помощью проверять жидкость не представляется возможным. Именно поэтому такие приспособления используются в первую очередь на производстве, где жесткость воды может повлиять на работу дорогостоящей техники или нанести другой подобный вред. В отличие от всех остальных аналогов, АКМС-1 действительно быстро и точно показывает текущий уровень жесткости, позволяя оператору своевременно реагировать. При помощи этого приспособления можно как пускать воду к рабочим агрегатам напрямую, если она не представляет для них угрозы, так и предварительно ее фильтровать. Это, конечно же, выльется в дополнительные затраты, но зато поможет сэкономить на ремонте техники, который обойдется значительно дороже.
Учитывая все указанное выше и требования ГОСТ, вода питьевая должна регулярно проверяться на уровень жесткости. Тем не менее принимать радикальные меры по ее умягчению не стоит, так как вредны оба состояния – слишком жесткая и слишком мягкая. Только в той ситуации, когда показатели действительно выше или ниже, стоит предпринимать какие-то действия. К слову, если с жесткостью регулярно борются, то про слишком мягкую воду практически не слышно, а ведь на это также нужно обращать не меньше внимания.
источник
Данный урок — лабораторная работа разработан по предмету «Аналитическая химия» для обучающихся по профессии «Технология продукции общественного питания». В ходе лабораторной работы в основе определения общей жесткости воды используется один из методов титриметрического анализа — комплексонометрический.
Вода является универсальным растворителем на планете Земля. Как в загородных домах, так и в городе в квартирах с централизованным водопроводом существует проблема жесткой воды. Жесткость воды зависит от наличия в ней солей кальция и магния. Жесткость воды является характеристикой конкретного источника водоснабжения и не изменяется в процессе подготовки питьевой воды к централизованному водоснабжению. Как определить степень жесткости воды?
Цель: повторить основные понятия, используемые в титриметрическом анализе; научить определять общую жесткость воды комплексонометрическим методом; закрепить навыки работы с лабораторным оборудованием; развивать вычислительные навыки; воспитывать чувство ответственности и дисциплинированности при выполнении практической работы.
Оборудование: конические колбы, мерные круглодонные колбы, бюретки для титрования, реактивы: трилон Б, индикатор эриохром черный Т, водопроводная вода, аммиачно-буферная смесь; таблицы, инструкционные карты.
II. Актуализация знаний учащихся
Сегодня на уроке мы с Вами будем говорить о самом замечательном веществе на планете Земля — воде.
Вы, как будущие технологи общественного питания, будете использовать питьевую воду не только в быту, но и в своей профессиональной деятельности.
В Старом Осколе питьевая вода поступает в город из 14 водозаборов, расположенных в разных частях города и района.
1. Одинакова ли питьевая вода по своим свойствам? (нет)
2.Чем она отличается? (содержанием различных веществ — жесткостью)
Абсолютно чистой воды в природе не существует. Она всегда содержит различные примеси как в растворенном, так и во взвешенном состоянии. От концентрации и природы этих примесей зависит пригодность воды для бытовых и промышленных нужд.
3.Что такое жесткость воды?
Жесткость воды определяется содержанием в ней растворимых солей магния, кальция, гидрокарбонатов, сульфатов, хлоридов.
4. Какие виды жесткости воды Вы знаете?
Жесткость временная (карбонатная) обусловлена содержанием гидрокарбонатов кальция и магния.
Жесткость постоянной (некарбонатной) обусловленна присутствием в воде хлоридов, сульфатов и других солей магния и кальция.
Общая жесткость воды представляет сумму жесткости карбонатной и некарбонатной.
5. Почему нежелательно использовать жесткую воду в быту?
Жесткая вода образует плотные слои накипи на внутренних стенках паровых котлов и кипятильников, в ней плохо развариваются пищевые продукты, при стирке белья в жесткой воде расходуется больше мыла.
III. Изучение нового материала
Тема нашего урока «Определение общей жесткости воды комплексонометрическим методом». Запишем ее в тетради.
В ходе урока мы должны научиться практическим путем определять общую жесткость воды, используя титриметрический анализ, в частности комплексонометрический метод.
Вспомним основы комплексонометрического метода анализа.
1. В чем состоит сущность комплексонометрического метода?
Сущность комплексонометрического метода состоит в образовании комплексных соединений анализируемых катионов с органическими реагентами — комплексонами.
Титрование — постепенное добавление раствора известной концентрации до достижения точки эквивалентности.
3. Что такое точка эквивалентности?
Точка эквивалентности — момент окончания реакции, т.к. вещества реагируют между собой в эквивалентных количествах.
4. С помощью чего устанавливают точку эквивалентности? (индикатора)
Индикаторы — вещества, при помощи которых устанавливают момент эквивалентности между взаимодействующими растворами.
6. Что такое стандартный (рабочий) раствор?
Стандартный раствор — раствор с точно установленной концентрацией, используемый для титриметрических измерений.
7. Какие правила техники безопасности необходимо соблюдать при выполнении практической работы?
Правила техники безопасности при работе со стеклянной посудой; жидкостями и сыпучими, а также ядовитыми веществами.
Работу выполняем по парам. На столах имеются инструкционные карты.
IV. Выполнение практической работы
Работу выполняем по парам. На столах имеются инструкционные карты.
Цель работы: определить общую жесткость воды методом комплексонометрии.
Оборудование: бюретки, мерный цилиндр, мерные круглодонные колбы, конические колбы, цилиндры, воронки, шпатель; реактивы: раствор Трилона Б, эриохром черный Т (сухой), аммиачно-буферная смесь, водопроводная вода.
1. Мерной колбой отмерить 100 мл исследуемой Н2О и перелить ее в коническую колбу.
2. Добавить к воде 5 мл аммиачно-буферной смеси, затем 7-8 капель спиртового раствора индикатора эриохром черного Т или щепотку его смеси с NaCl или KCl (сухую).
3. Тщательно перемешать, раствор окрасится в винно-красный цвет.
4. Смесь оттитровать 0,05 Н раствором Трилона Б. К концу титрования раствор Трилона Б добавлять по каплям, встряхивая смесь в колбе после добавления каждой капли.
5.Титрование можно считать законченным если после добавления очередной капли окраска раствора приобретает синий цвет с зеленоватым оттенком и с добавлением лишней капли раствора комплексона не изменяется.
6. Определить объем трилона Б, израсходованного на титрование.
7.Титрование повторить 2-3 раза и для расчета взять среднее значение.
8. Произвести расчет общей жесткости воды.
Величину общей жесткости воды (Ж) в мг*экв/л вычисляют по формуле:
где N — нормальность раствора трилона Б, г-экв/л;
V — объем раствора трилона Б, мл;
9. Сделайте вывод о типе воды, пользуясь данными значениями жесткости воды.
Типы воды (по жесткости):
- Очень мягкие — 0-1,5 мг-экв/л;
- Мягкие — 1,5- 3,0 мг-экв/л;
- Среднежесткие — 3,0- 4,5 мг-экв/л;
- Довольно жесткие — 4,5 — 6,5 мг-экв/л;
- Жесткие — 6,5 — 11,0 мг-экв/л;
- Очень жесткие — свыше 11,0 мг-экв/л.
V. Подведение итогов работы
Сегодня на уроке мы практическим путем определили общую жесткость воды. Водопроводная вода, которую мы используем, является среднежесткой.
Какие способы устранения жесткости Вы знаете?
Способы устранения жесткости воды:
- Карбонатная (временная) жесткость — кипячение; добавление известкового молока или соды.
- Некарбонатная (постоянная) жесткость — добавление соды.
источник
Метод определения общей жесткости воды основан на том, что ионы кальция и магния связываются трилоном Б в комплексные соединения. О конце реакции судят по изменению цвета индикатора хромогена черного от розово-малинового до синевато-серого. Появление синевато-серого окрашивания свидетельствует об отсутствии ионов Са 2+ и Mg 2+ в растворе, т. е. о полном связывании их с трилоном Б.
В коническую колбу вместимостью 250 мл отмеривают 100 мл исследуемой воды, добавляют 5 мл аммиачного буферного раствора, индикатор хромоген (сухую смесь) и медленно титруют 0,1 н раствором трилона Б до перехода окраски в серовато-синюю.
Общую жесткость воды Жо, ммоль экв/л, вычисляют по формуле
где V1 – объем 0,1 н раствора трилона Б, израсходованный на титрование пробы, мл; К – коэффициент нормальности раствора трилона Б (К = Nфакт / 0,1); N1 – нормальность раствора трилона Б; V2 – объем исследуемой пробы воды, мл.
Определение карбонатной жесткости воды
Оттитровывают 100 мл воды 0,1 н раствором HCl в присутствии метилового оранжевого до перехода окраски от желтой к розовой. Карбонатную жесткость Жк, ммоль экв/л, вычисляют по формуле
где V3 – объем HCl, который пошел на титрование, мл; N2 – нормальность HCl, моль/л; V2 – объем воды, который взят для анализа, мл.
Некарбонатная жесткость определяется как разница между общей и карбонатной жесткостью
Определение количества диоксида углерода
В колбу поместите 200 мл исследуемой воды, добавьте 2 капли раствора фенолфталеина и взболтайте. Если вода окрасилась в интенсивный розовый цвет, это значит, что в ней нет растворенного диоксида углерода. Отсутствие окраски или очень слабая окраска свидетельствуют о присутствии растворенного диоксида углерода. В этом случае пробу титруют 0,1 н раствором NaOH до появления интенсивной окраски. Концентрацию диоксида углерода определяют по формуле
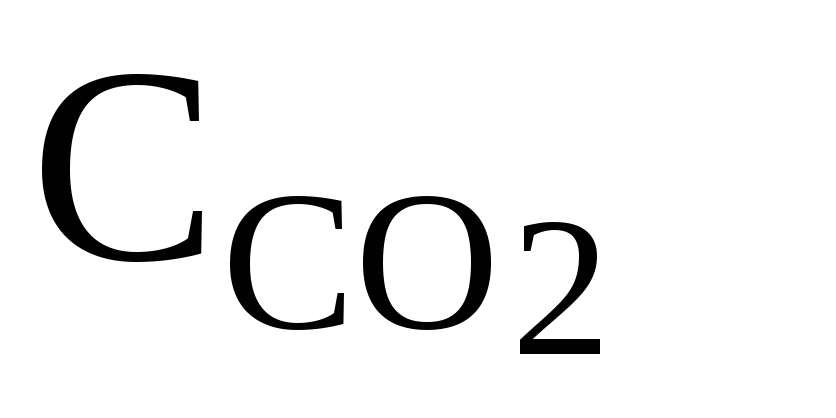
где N – нормальность NаОН, моль/л; V4 – его объем, мл.
Определение концентрации кальция и магния
К 100 мл воды добавляют 3 мл 10%-ного КОН до рН = 10–12, вносят примерно 0,2 г сухого индикатора мурексида, смешанного с сульфатом калия, и титруют трилоном Б до перехода окраски из розовой в фиолетовую.
Концентрацию кальция СК, ммоль экв/л, рассчитывают по формуле
где V5 – объем трилона Б, пошедший на титрование, мл.
Концентрацию магния См, ммоль экв/л, рассчитывают по формуле
После проведения полного обессоливания воды необходимо убедится в отсутствии в ней как катионов (Mg 2+ , Ca 2+ ), так и анионов (SO4 2– , NO3 – , Cl – ). Анализ на содержание указанных анионов в воде до ее обессоливания и после проводится качественно.
SO4 2– – раствор хлорида бария дает белый осадок сульфата бария;
Cl – – при добавлении раствора нитрата серебра образуется белый осадок хлорида серебра;
NO3 – – при добавлении раствора дифениламина в серной кислоте появляется характерное для ионов NO3 – синее окрашивание.
Определение содержания взвешенных частиц (мутность воды)
Мутность воды определяется фотоколориметрическим методом при длине волны 440 нм. Оптическую плотность измеряют в кюветах с толщиной поглощающего слоя 3 мм. Количество взвешенных частиц в воде находят по калибровочной кривой.
Регистрирующим прибором в фотоколориметре служит микроамперметр типа М907, оцифрованный в микроамперах и имеющий шкалу 0–100 делений, соответствующих шкале коэффициентов пропускания – и оптической плотности – D. При измерении со светофильтром 440 нм, отмеченным на лицевой панели колориметра черным цветом, ручку «Чувствительность» устанавливают в одно из положений 1, 2 или 3. Рабочие поверхности кювет перед каждым измерением необходимо тщательно протирать спирто-эфирной смесью, жидкость в кюветы наливать до метки на боковой поверхности кюветы. При установке кювет в кюветодержатель нельзя касаться пальцами участков поверхности кювет ниже уровня жидкости в них.
Колориметр включают в сеть за 15 мин до начала измерений. Во время прогрева кюветное отделение должно быть открыто (при этом шторка перед фотоприемником перекрывает световой пучок). В световой пучок помещают кювету со стандартным раствором, по отношению к которому производят измерения, и крышку кюветного отделения закрывают. Ручками «Чувствительность» и «Установка 100» устанавливают отсчет 100 по шкале колориметра. Затем поворотом ручки кювету со стандартным раствором заменяют кюветой с исследуемым раствором. После этого производят отсчет по шкале колориметра, соответствующий коэффициенту пропускания исследуемого раствора в процентах, или по шкале D в единицах оптической плотности. Измерения проводят 3–5 раз и окончательное значение измеряемой величины определяют как среднее арифметическое полученных значений.
источник
Объем гидрохимических работ, количество, сроки, место и способы взятия проб зависят от целей гидрохимических исследований.
Для рыбохозяйственных целей могут быть выполнены:
1)газовый анализ воды (определяют физические свойства воды, содержание растворенного кислорода, углекислого газа, концентрацию ионов водорода (рН), наличие и количество сероводорода, аммиака);
2)краткий анализ воды (кроме определений, перечисленных в газовом анализе, определяют окисляемость, щелочность, карбонатную жесткость воды и общее содержание растворенного железа);
3)полный общий анализ воды, который включает определение физических свойств (температуры, прозрачности, цвета, запаха и вкуса); содержания кислорода, углекислого газа, сероводорода, аммиака; концентрации ионов водорода (рН) и щелочности, общей, карбонатной жесткости; окисляемости нефильтрованной и фильтрованной воды; содержания альбуминоидиого азота, солевого аммиака, нитритов, нитратов, фосфатов, различных форм железа, кремния; сульфатов, хлоридов, кальция и магния.
Целью специальных исследований может быть определение содержания металлов и микроэлементов.
Полученные результаты сравнивают с нормативными значениями показателей качества воды, приведенными в таблице.
Большинство природных вод мало минерализовано, поэтому для количественного определения многих компонентов, растворенных в воде, требуются точные методики. Вместе с тем они должны быть достаточно простыми, не требующими сложного и дорогостоящего оборудования, доступными для выполнения в полевых условиях и в относительно небольших гидрохимических лабораториях рыбоводных хозяйств.
Методики исследования химического состава воды должны быть едиными при изучении водоемов в различных целях; для того чтобы полученные данные можно было сравнить и использовать.
Определения не должны занимать много времени, так как надо стремиться все необходимые показатели определить в течение 1 -2 сут.
Используемые в настоящее время в практических целях методы химического анализа природных вод можно разделить на:
1) химические (весовые, объемный анализ); 2) электрохимические (потенциометрический, кондуктометрический, полярографический); 3) оптические (фотометрические и спектрофотометрические, люминесцентный, спектральный анализ); 4) фотохимические, 5) хроматографичсские (жидкостная колоночная хроматография, тонкослойная хроматография, газовая хроматография и т.д.).
Наиболее распространены в гидрохимии первые три группы методов. К химическим методам относятся методы, предусматривающие проведение химической реакции и последующее количественное определение образующихся продуктов. Из химических методов при анализе природных вод широко используется метод объемного анализа. Основным преимуществом объемного анализа являются простота, быстрота определения, а также широкие возможности использования разнообразных химических свойств веществ. Именно благодаря этим достоинствам метода объемного анализа в настоящее время являются основными при определении макрокомпонентов природных вод. Суть объемного метода заключается во взаимодействии исследуемого компонента с реактивом, который добавляется в виде раствора определенной концентрации (титрованный раствор) до того момента, когда количество прибавленного реактива не станет эквивалентно количеству определяемого компонента в растворе. Этот процесс называется титрованием, а момент окончания титрования — точкой эквивалентности. Конец титрования обычно устанавливают по изменению цвета индикатора, т.е. вещества, которое изменяет вою окраску при концентрациях реагирующих веществ, близких к точке эквивалентности. Индикатор и условия титрования выбирают так, чтобы точка титрования индикатора совпадала с точкой эквивалентности или была, возможно, ближе к последней.
Процесс титрования осуществляется следующим образом.
В коническую колбу помещают исследуемую пробу воды, раствор индикатора, по каплям добавляют из бюретки титрующий раствор при постоянном перемешивании. Титрование продолжают до изменения цвета окраски в колбе. Обычно для установления конечной точки титрования используют «свидетель», в качестве которого обычно применяется проба, оттитрованная до эквивалентной точки. Сравнение окрасок следует производить на белом фоне. По окончании титрования по бюретке отмечают количество затраченного на титрование раствора.
В зависимости от типа реакций методы объемного анализа делятся на четыре большие группы: 1) кислотно-основное титрование, 2) титрование окислителями и восстановителями; 3) методы осаждения; 4) методы, основанные на образовании комплексов.
При кислотно-основном титровании в качестве титрованных растворов обычно применяют кислоты и щелочи. Определять этим методом можно кислоты, щелочи, соли слабых кислот и оснований; в частности, в гидрохимии этим методом определяют диоксид углерода и гидрокарбонаты.
Титрование окислителями и восстановителями применяется в гидрохимии в основном при определении растворенного кислорода и окисляемости.
Методы объемного анализа, основанные на реакциях осаждения, используются при определении сульфатов и хлоридов.
Примером титрования с образованием комплексов могут служить реакции взаимодействия ионов кальция и магния с трилоном Б, которые лежат в основе определения общей жесткости воды.
Электрохимические методы основаны на измерении электрохимических свойств компонентов — окислительного потенциала, электрической проводимости, силы полярографического тока и т.д. Простота выполнения определений, легкость автоматизации, высокая чувствительность делают эти методы весьма перспективными в анализе вод.
В основе оптических методовлежит способность всех веществ поглощать лучистую энергию в виде квантов, соответствующих определенным длинам волн. Линии или полосы поглощения при этом располагаются в ультрафиолетовой, видимой или инфракрасной областях спектра и могут использоваться для количественной оценки (см. лаб. раб.№2.).
В процессе выполнения анализа записи следует вести в табличной форме. При применении объемного метода рекомендуется форма табл.1(приложение), фотоколориметрического — табл.2(приложение) и при определении окисляемости перманганатным методом — табл.3 (приложение).
Такие таблицы позволяют легко произвести расчет, устранить неясности и при необходимости быстро проверить правильность вычислений.
Пользуясь указанными выше методами, результаты анализа выражают в виде
источник
Жесткость — свойство воды, обусловленное присутствием в ней растворенных солей щелочно-земельных металлов (преимущественно кальция и магния). Различают жесткость кальциевую и магниевую, связанную с присутствием в воде соответственно ионов кальция и магния. Суммарное содержание ионов этих металлов в воде называется общей жесткостью.
Общая жёсткость подразделяется на карбонатную, обусловленную присутствием в воде гидрокарбонатов и карбонатов кальция и магния, и некарбонатную, обусловленную наличием кальциевых и магниевых солей сильных кислот.
Карбонатную жёсткость также называют временной (устранимой), а некарбонатную — постоянной. Гидрокарбонаты кальция и магния при длительном кипячении воды разлагаются с выделением диоксида углерода и выпадающих в осадок карбонатов кальция и магния (при дальнейшем кипячении карбонат магния гидролизуется с образованием гидроксида); жесткость воды при этом уменьшается:
Жесткость, оставшаяся после кипячения воды в течение определенного времени, достаточного для полного разложения гидрокарбонатов и удаления диоксида углерода (обычно 1 — 1,5 ч), называется постоянной жесткостью. Постоянная жесткость является важной характеристикой качества воды, используемой для технических целей. Она преимущественно зависит от содержания ионов кальция и магния, которые после кипячения уравновешиваются сульфатами и хлоридами. Эту часть постоянной жесткости, называемую также остаточной жесткостью, можно найти по разности между общей жесткостью и концентрацией гидрокарбонатов, выраженной в миллимолях на кубический дециметр. Однако кроме остаточной жесткости в воде после кипячения остается небольшое количество ионов кальция и магния, обусловленное растворимостью карбоната кальция и гидроксида магния. Эта часть постоянной жесткости называется неустранимой жесткостью. Поскольку растворимость карбоната кальция и гидроксида магния в присутствии ионов кальция и магния в растворе весьма незначительна, обычно некарбонатную (остаточную) жесткость отождествляют с постоянной жесткостью. Способ расчета постоянной жесткости и составляющих ее остаточной и неустранимой жесткости на основе результатов определения компонентов солевого состава воды приведен в «Руководстве по химическому анализу вод суши». Л.: Гидрометеоиздат. 1973.
Жесткость воды в настоящее время выражают в миллимолях количества вещества эквивалентов (КВЭ) Са 2+ и Mg 2+ , содержащихся в 1 дм 3 воды — ммоль/дм 3 КВЭ (ранее эту единицу обозначали мг-экв/л или мг-экв/дм 3 ). Миллимоль КВЭ Са 2+ и Mg 2+ равны соответственно 20,04 мг/ммоль и 12,15 мг/ммоль.
В естественных условиях ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с карбонатными минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов являются также микробиальные процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий: силикатной, металлургической, стекольной, химической промышленности, стоки с сельскохозяйственных угодий.
Общая жесткость поверхностных вод колеблется в основном от единиц до десятков миллимолей КВЭ в кубическом дециметре, причем карбонатная жесткость часто составляет 70 — 80 % от общей жесткости. Она подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период паводка. Жесткость подземных вод более постоянна.
Вода с жесткостью менее 4 ммоль/дм 3 КВЭ характеризуется как мягкая; от 4 до 8 ммоль/дм 3 КВЭ — средней жесткости; от 8 до 12 ммоль/дм 3 КВЭ — жесткая; более 12 ммоль/дм 3 КВЭ — очень жесткая.
Обычно преобладает (иногда в несколько раз) жесткость, обусловленная ионами кальция, однако в отдельных случаях, магниевая жесткость может достигать 50 — 60 % общей жесткости и более (часто магниевая жесткость превосходит кальциевую в морских и океанических водах, либо в поверхностных водах суши с высоким содержанием сульфат-ионов).
Высокая жесткость оказывает отрицательное влияние на свойства воды используемой в промышленности и для хозяйственно-бытовых целей. Жесткие требования в отношении величины жесткости предъявляются к воде, питающей паросиловые установки, поскольку в присутствии сульфатов и карбонатов кальций и магний образуют прочную накипь, уменьшающую теплопроводность металла и приводящую к перерасходу топлива и перегреву котлов. Для устранения жесткости применяют различные способы — осаждение труднорастворимых солей кальция и магния химическим или термическим путем, умягчение с помощью ионитов.
Высокая жесткость, особенно, обусловленная превышением солей магния, ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное воздействие на органы пищеварения. Предельно допустимая величина жесткости в питьевых водах 7 ммоль/дм 3 КВЭ, но в некоторых случаях допускается использовать для питьевых целей воду с жесткостью 10 ммоль/дм 3 КВЭ.
ЖЕСТКОСТЬ ВОДЫ.
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
ТИТРИМЕТРИЧЕСКИМ МЕТОДОМ С ТРИЛОНОМ Б
1.1 Настоящий руководящий документ устанавливает методику выполнения измерений (далее — методика) общей и некарбонатной жесткости в пробах природных и очищенных сточных вод в диапазоне от 0,060 до 13,00 ммоль/дм 3 КВЭ (далее — ммоль/дм 3 ) титриметрическим методом с трилоном Б.
При анализе проб воды с величиной жесткости, превышающей 13,00 ммоль/дм 3 , допускается выполнение измерений после соответствующего разбавления пробы дистиллированной водой.
1.2 Настоящий руководящий документ предназначен для использования в лабораториях, осуществляющих анализ природных и очищенных сточных вод.
В настоящем руководящем документе использованы ссылки на следующие нормативные документы:
ГОСТ 12.1.005-88 ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 ССБТ. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
МИ 2881-2004 Рекомендация. ГСИ. Методики количественного химического анализа. Процедуры проверки приемлемости результатов анализа
РД 52.24.403-2007. Массовая концентрация кальция в водах. Методика выполнения измерений титриметрическим методом с трилоном Б
Примечание — Ссылки на остальные нормативные документы приведены в разделах 4, В.3 и В.4.
3.1 При соблюдении всех регламентируемых методикой условий проведения измерений характеристики погрешности результата измерения с вероятностью 0,95 не должны превышать значений, приведенных в таблице 1.
Таблица 1 — Диапазон измерений, значения характеристик погрешности и ее составляющих (Р = 0,95)
Показатель повторяемости (среднеквадратическое отклонение повторяемости) s r, ммоль/дм 3
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости) s R, ммоль/дм 3
Показатель правильности (границы систематической погрешности при вероятности Р = 0,95) ± D с, ммоль/дм 3
Показатель точности (границы погрешности при вероятности Р = 0,95) ± D , ммоль/дм 3
источник
Как выполняется контроль жёсткости воды. Понятие жёсткости, от чего она зависит. Анализ воды на жёсткость дома. Лабораторные методы контроля общей и временной жёсткости жидкости. Приборы для выполнения анализа. Методы борьбы с повышенной жёсткостью в быту. Контроль жёсткость воды или анализ воды на жёсткость нужен для определения концентрации солей в жидкости. Этот анализ можно проводить в лабораторных условиях и дома.
Жёсткость воды – термин, говорящий о процентном соотношении солевых частиц магния и калия в жидкости. Она подразделяется на две разновидности:
- Временная (такая жидкость называется карбонатная);
- Общая жёсткость (данная вода относится к некарбонатной).
Первый тип жёсткости характеризуется присутствием гидрокарбонатных солевых частиц магния и калия. Если такую воду закипятить, то элементы распадутся на карбонаты и гидроксиды и выпадут в осадок. Именно этот белый налёт часто покрывает наши чайники изнутри и собирается на других нагревательных элементах.
Для жидкости с общей жёсткостью характерно наличие других химических элементов (различных нитратов, хлоридов и тп.п). Обычно жёсткость питьевой воды связана с особенностями вашего региона, составом грунтов. Чем больше известковых пород находится в почве, тем выше жёсткость воды. Но важно не только понимать суть понятия, но и знать, как проверить жёсткость воды. Выполнить это легко как в быту, так и на заводе.
Для проверки жёсткости водопроводной воды дома можно использовать следующие способы:
- Постарайтесь обильно вспенить мыльный брусок или порошок для стирки. Если у вас образуется мало пены, то ваша вода имеет повышенную жёсткость. Это возникает по той причине, что солевые частицы калия и магния не позволяют мылу пениться. При обильной пышной пене от любого моющего средства можно утверждать, что вода нежёсткая. Но этот метод не позволят точно определить степень жёсткости.
- На вкус также можно отличить жёсткую воду от мягкой. Она более горькая. Но не все могут точно уловить горьковатый привкус солей магния и калия.
- Белый осадок в чайниках, накипь на нагревательных элементах других бытовых приборов – признак жёсткой воды. Осадок возникает из-за распада солей и выпадения их на дно. Данная особенность жёсткой воды очень вредит бытовым приборам и отопительному трубопроводу.
- От жёсткости воды зависит скорость заваривания чайного напитка. При мягкой воде на эту процедуру уйдёт от 3 до 6 мин., в жёсткой воде чай будет завариваться от 8 до 12 мин. Кстати, на вкус оба напитка будут существенно отличаться.
- Благодаря нехитрому компактному измерительному прибору можно очень легко определить жёсткость любой жидкости. Он называется TDS-метр. Агрегат измерят электропроводность жидкости. Чем выше показатель, тем больше уровень солесодержания жидкости. Обычно его ещё называют солемер. Чаще такой анализ воды на жёсткость делают владельцы аквариумов и цветоводы.
- Проверить жёсткость воды в быту можно, используя тест-полоски, продающейся в аптеках медтехники.
Для этого анализа можно использовать колориметрическую методику и принцип титрования. Процедура анализа выполняется так: порция воды смешивается с метилоранжем (индикатором), ёмкость устанавливается на светлом фоне. Во вторую тару с водой добавляют соляную кислоту, пока не получится красно-оранжевый цвет воды.
Временную жёсткость жидкости находят в процессе расчёта требуемого количества соляной кислоты по формуле: Нвр = NHCl * VHCL* 1000/ V1, где N-насыщенность раствора, V-его количество, V1-количество пробы.
Этот анализ проводят в лаборатории. Для него используют комплексонометрическую методику. Она базируется на принципе возникновения соединений ионов, подвергающихся анализу, с природными реагентами. Сначала воду в пробирке разводят раствором индикатора на спирту (чёрного этиохрома «Т»). Также для этих целей может использоваться сухая смесь кальциевых и натриевых хлоридов. В итоге полученная смесь окрашивается в насыщенный рубиновый цвет. Затем в пробирку капается вещество, называемое Трилон.
Расчёт общей жёсткости производится по уравнению: Жо=Nx*Vx*1000/V1, где N-насыщенность вещества Трилон, V-его количество, V1-количество пробы.
Как мы уже говорили выше, прибор контроля жёсткости воды называется солемер или TDS-метр. Точность проверки составляет 2%. Основной принцип работы данного агрегата построен на зависимости электропроводности жидкости от общего числа примесей солей магния и калия. То есть чем больше данных солей в воде, тем больше будут показания прибора, а следовательно, тем выше жёсткость воды.
На некоторых предприятиях и заводах наблюдается прямая зависимость между жёсткостью используемой воды и исправностью работы оборудования. Поэтому для обеспечения бесперебойной работы технологического оборудования требуется осуществлять постоянный автоматический контроль жёсткости воды.
Для этих целей используется специальное оборудование, например, анализатор «АКМС-1». Этот прибор непрерывно контролирует содержание солевых частиц кальция и магния в жидкости, поступающей в технологическое оборудование. То есть он подсчитывает общую жёсткость в пределах 0,005-25,0 мг-экв/л.
Как понять, что ваша водопроводная вода жёсткая, мы писали выше. Теперь перечислим ряд мер, позволяющих снизить жёсткость воды в домашних условиях:
- Самый простой способ – кипячение воды.
- Фильтрация воды через системы обратного осмоса (специальные мембраны).
- Использование смягчающих солей.
- Применение фильтрующих картриджей.
- Магнитное фильтрующее устройство.
- Использование ионообменной смолы в комплексе с солевым раствором.
Хотите провести контроль жёсткости воды? Заказать такую услугу вы можете у наших специалистов, для этого вам достаточно связаться с нами по указанным телефонам.
источник
ОПРЕДЕЛЕНИЕ ЖЕСТКОСТИ ВОДЫ И МЕТОДЫ ЕЕ УСТРАНЕНИЯ
Ермаченко Галина Дмитриевна
1.1.Нормирование качества питьевой воды………………………………………….5
1.2.Понятие о жесткости воды …………………. …..………….….…….………. 5
1.3. Последствия использования жесткой воды….………. …..…………………. 8
1.4 Методы определения жесткости воды…….………. ……….……………………9
1.5. Способы устранения жесткости…..…… …………………………………………. 11
1.5.1.Термический метод (кипячение либо вымораживание воды) ………………. 12
1.5.3. Физико-химический метод ……………………………………………………. 13
2. Экспериментальная часть………………………………. 15
2.2.Материалы и методика проведения определения жесткости воды……………..16
2.4 Методика по снижению жесткости воды……………….… …………..………….17
Вода принадлежит к веществам, наиболее распространенным на поверхности земного шара. Нельзя назвать такой точки на поверхности Земли, где бы не встречалась вода в том или ином состоянии.[1, с.3].
Вода — вещество, без которого нет жизни. Наше тело на 80% состоит из воды. Без пищи мы могли б прожить около месяца, а без воды лишь несколько суток. Вода выводит с нашего организма шлаки, токсины и отходы. Доставляет в клетки кислород и питательные вещества (минеральные соли, витамины).
Но мало кому известно, что более половины заболеваний человека связана с употреблением некачественной питьевой воды. Вода является основой здоровья человека, но она также может нести в себе опасность. Опасность, содержащаяся в воде, может быть как микробиологической — вода в природе содержит множество бактерий и вирусов, вызывающих у человека разные заболевания, так и химической — с немедленным или отсроченным действием.
Одной из актуальных проблем воды, является ее жесткость, обусловленная присутствием в воде значительного количества солей кальция и магния. Накипь на стенках нагревательных котлов, отложения солей на бытовой технике, и т.д. — все это показатели жесткой воды. Повышенная жесткость воды негативно сказывается на здоровье человека. В настоящее время известна взаимосвязь жесткости воды и образования камней в почках. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения. При умывании соли жесткости взаимодействуют с моющими веществами и образуют нерастворимые шлаки. Эти шлаки высыхают и остаются в виде микроскопической корки на кожном и волосяном покрове человека. Признак повышенной жесткости воды – скрип чисто вымытой кожи и волос.
Для каждой местности есть свои особенности грунтовых вод. Грунтовые воды нашего региона имеют высокую жесткость (18. 20 мг-экв/л), поскольку формируются под воздействием меловых и доломитовых пород.
Актуальность: Количество и качество воды определяют, какой будет жизнь человека. Поэтому контроль качества воды приобретает особую актуальность. Ж ё сткость воды — наиболее распространенная проблема качества воды . Такая вода неблагоприятно воздействует на здоровье человека, а также на техническое и промышленное оборудование.
Предмет исследования: жесткость воды.
Объект исследования: вода из различных источников.
Цель работы: определение общей жёсткости воды титриметрическим методом разных образцов воды.
Для этого были поставлены следующие задачи:
1. Провести анализ научной литературы относительно жесткости воды;
2.Овладеть методикой титриметрического определения жесткости воды;
3.Выполнить анализ отобранных проб питьевой воды из различных источников, провести исследования по снижению жесткости;
4.Проанализировать результаты и сделать выводы об эффективности использования различных методов умягчения воды.
1.1.Нормирование качества питьевой воды
Целью нормирования качества питьевой воды является сохранение здоровья человека. При употреблении недоброкачественной воды у человека возможно развитие заболеваний инфекционной и неинфекционной этиологии. Требования к качеству питьевой воды изложены в документе СанПиН 2.1.4.1074 – 01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества».
Нормирование осуществляется по следующим группам показателям:
4.Вещества, попавшие в воду в результате улучшения ее свойств. [2].
К химическим показателям качества воды относится:
В данной работе мы изучим один из важнейших химических показателей качества воды – её жесткость.
1.2.Понятие о жесткости воды
Жесткость воды является одним из основных показателей, характеризующим применение воды в различных отраслях. Жесткостью воды называется совокупность химических и физических свойств воды , связанных с содержанием в ней растворённых солей щёлочноземельных металлов , главным образом, катионами кальция (Са 2+ ) и в меньшей степени магния (Mg 2+ ). Вода с большим содержанием таких солей называется жёсткой, с малым содержанием — мягкой.
Общая жесткость воды складывается из временной и постоянной и обусловлена присутствием в воде кальция и магния, в виде гидрокарбонатов, карбонатов, хлоридов, сульфатов и других соединений. Временную жесткость можно устранить кипячением воды, что обусловлено свойством некоторых солей выпадать в осадок, образуя так называемую накипь.
1.Временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния Са(НСО 3 ) 2 , Mg(НСО 3 ) 2 ;
2.Постоянную (некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов кальция и магния (CaSO 4 , CaCl 2 , MgSO 4 , MgCl 2 ). [2].
Сумма карбонатной и не карбонатной жесткости определяет общую жесткость воды: Жобщ= Жк+ Жнк
Сумма временной и постоянной
временная (карбонатная) постоянная (некарбонатная)
Единицы измерения жёсткости . Существует несколько измерений общей жесткости воды. Для справки: миллимоль/дм 3 — это то же самое, что и мг- экв/л и то же самое, что и моль/м 3 . То есть, 7,0 ммоль/дм 3 = 7,0 мг-экв/л. В нашей работе мы используем моль на кубический метр (моль/м 3 ) или миллимоль на литр (ммоль/л).
В технической литературе встречается единица измерения степени жесткости воды – мг экв/дм 3 или мг-экв/кг. Один миллимоль-эквивалентов жесткости отвечает содержанию 20,04 мг/л Са 2+ или 12,16 мг/л Mg 2+ . Для выражения жесткости также применяют миллиграмм-эквивалента на 1л воды (мг-экв/л).
Зная, что молярные массы эквивалентов ионов Са 2+ и Mg 2+ соответственно равны 20,04 и 12,16 мг/дм 3 , можно рассчитать общую жесткость воды (в ммоль/дм 3 ).
Самая жесткая природная вода-это морская вода. Самые мягкие природные воды — это дождевая и талая содержание солей в которых близко к нулю. Самая мягкая исскуственная вода-дистиллированная.
Основными природными источниками жесткости воды являются осадочные породы, фильтрация и сток с почвы. Жесткая вода образуется в районах с плотным пахотным слоем и известковыми образованиями. Для подземных вод характерна большая жесткость, чем для поверхностных. Подземные воды, богатые карбоновыми кислотами и растворенным кислородом, обладают высокой растворяющей способностью по отношению к почвам и породам, содержащим минералы кальцита, гипса и доломита.
Основными промышленными источниками жесткости являются стоки предприятий, производящих неорганические химические вещества, и горнодобывающая промышленность. Оксид кальция используется в строительной промышленности, производстве бумажной массы и бумаги, рафинировании сахара, в очистке нефти, дублении и как реагент для очистки воды и сточных вод. Сплавы магния применяются в литейном и штамповочном производстве, бытовых продуктах. Соли магния используются в производстве металлического магния, удобрений, керамики, взрывчатых веществ, медикаментов. [2].
Общая жесткость природных вод зависит от типа контактирующих с ними пород и почв, климатических условий, а также сезона года. Наиболее мягкими являются воды атмосферных осадков (0,07. 0,1 мг-экв/л). Очень малую жесткость имеют воды Карелии, так как они омывают трудно растворимые гранитные породы.
Нормы содержания катионов жесткости в питьевой воде
В зависимости от показателя жесткости вода может быть (табл.1.1) :
Классификация воды по степени жесткости
Значение общей жесткости, ммоль/л
Стандарт на питьевую воду определяемый соответствующими нормами и ГОСТами. Требования к качеству питьевой воды изложены в документе- Санитарные правила и нормы ( СанПиН) 2.1.4.1074 – 01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества». Согласно нормативам СанПиН жесткость общая не должна превышать 7ммоль/л . [2].
В Европе требования к жёсткости воды гораздо строже: не более 2,5 ммоль/л.
1.3 . Последствия использования жесткой воды
При постоянной жёсткости в воде находится допустимое количество химических веществ, которое не приносит человеку вреда, а даже напротив насыщает организм необходимыми микроэлементами.
Сложнее обстоит дело с временной жесткостью, при которой в воде появляются гидрокарбонат кальция и магния. Эта крайне вредная смесь. Обычно, когда говорят о «жёсткой воде» подразумевают именно временную жёсткость. Рассмотрим проблемы связанные с жесткостью воды:
1)Ухудшаются органолептические свойства — вода имеет неприятный вкус;
2)Нарушается всасывание жиров в кишечнике в результате образования кальциево-магнезиальных нерастворимых мыл при омылении жиров;
3)У лиц с чувствительной кожей способствует появлению дерматитов в связи с тем, что кальциево-магнезиальные мыла обладают раздражающим действием. 4)Жёсткая вода плохо смывает мыльные растворы, такая вода портит волосы при мытье головы, так как оставляет налет на волосах, вызывает перхоть, ломкость волос. Поры кожи забиваются шлаками, появляется сухость кожи. Она высушивается и преждевременно стареет. Не зря косметологи рекомендуют для умывания использовать мягкую дождевую или талую воду.
5)В хозяйственно-бытовом аспекте: увеличивается расход моющих средств, образуется накипь при кипячении, в водопроводе и отопительных системах образуются известковые наросты — это снижает напор воды, уменьшает теплопроводность нагревательных элементов и со временем частично или полностью выводит из строя оборудование. Т кани одежды теряют мягкость и гибкость. Ухудшается разваривание мяса и овощей с потерей витаминов в результате связывания их в неусвояемые комплексы;
6)Имеются данные, что употребление слишком жесткой воды может приводить к увеличению частоты мочекаменной болезни, хотя есть сведения о том, что жесткость может служить защитой от болезней;
7)При резком переходе от пользования жесткой водой к мягкой и наоборот могут у людей наблюдаться диспептические явления;
8)Портит вид, вкус и качество чая, который является важнейшим напитком у населения, стимулирующим желудочную секрецию и утоляющим жажду.[2].
Имеются данные о том, что употребление мягкой воды — способствует дефициту в организме ионов Ca и Mg, что ослабляет сердечно-сосудистую систему. Такая вода не менее опасная, чем излишне жесткая. Мягкая вода способна вымывать из костей кальций. У человека может развиться рахит, если пить такую воду с детства, у взрослого человека становятся ломкие кости.
1.4.Методы определения жесткости воды
Существуют различные способы определения жесткости воды:
— методы атомной спектрометрии.
Рассмотрим комплексонометрический способ определения общей жесткости воды.
Определение общей жесткости проводят путем комплексонометрического титрования раствором комплексона III (ЭДТА , трилон Б) , в присутствии эриохром черного. Обычно определяют суммарное количество магния и кальция. Индикатор образует с ионами комплексное соединение синего цвета. При титровании раствора ЭДТА в точке эквивалентности красная окраска переходит в окраску характерную для свободного индикатора.[3].
Сущность метода: Комплексонометрия (трилонометрия) — титриметрический метод анализа, основанный на реакциях взаимодействия комплексонов (чаще всего трилона Б), с катионами щелочноземельных и тяжелых металлов, которые приводят к образованию растворимых в воде бесцветных прочных внутрикомплексных соединений. Трилон Б (комплексон III) образует внутрикомплексные соединения с катионами металлов за счет валентных связей с карбоксильными группами, вытесняя из них атомы водорода, а также за счет координационных связей ионов-комплексообразователей с атомами азота.
Для определения конечной точки титрования используют металлохромные индикаторы или органические вещества, образующие окрашенные комплексы с катионами определяемых металлов. В процессе комплексонометрического титрования в растворе протекает реакция связывания катионов металла в комплексонат.
ЭДТА (комплексон III, трилон Б) — двунатриевая соль этилендиаминтетрауксусной кислоты: Na 2 H 2 Y
В результате образуется комплексное соединение трилона Б (комплексонаIII) с ионами щелочноземельных элементов кальция и магния.
Схематически реакции комплексообразования с катионами, можно представить следующим уравнением:
В качестве титранта используют растворы 0,1; 0,05 или 0,02 моль/дм 3 трилона Б.
Способы фиксирования конечной точки титрования . При комплексонометрическом титровании используют индикатор эриохром черный Т, который образуют с определяемыми ионами растворимые в воде окрашенные комплексные соединения. При этом комплекс катиона с индикатором и свободный индикатор имеют различную окраску:
Конечную точку титрования определяют по собственной окраске индикатора.
В процессе титрования при взаимодействии катионов с трилоном Б (комплексоном III) в раствор переходят ионы Н + , в результате чего рН раствора понижается, что приводит к смешению реакции комплексообразования влево и делает реакцию обратимой. Для поддержания определенного значения рН титрование следует проводить в присутствии буферных растворов, имеющих определенное значение рН. Большинство катионов титруют трилоном Б (комплексонIII) в присутствии аммиачного буферного раствора : NH 4 ОH + NH 4 Cl при рН = 9,2 .
Метод применяют для определения суммарной концентрации кальция и магния в питьевой воде, грунтовых и поверхносных водах. Погрешность при титровании 100см 3 пробы составляет 0,05ммоль/дм 3 .
1.5. Способы устранения жесткости
Во многих сферах деятельности человека нужна вода с определенным содержанием растворенных в ней солей. На водоочистительных предприятиях используют различные методы очистки воды и ее умягчения.
Устранение жесткости, или умягчение, воды заключается в удалении ионов кальция и магния, которое осуществляется тремя методами: термическим, химическим и физико-химическим. Существует несколько способов устранения жесткости воды.
1.Кипячение и вымораживание.
1.Добавление кальцинированной соды Na 2 CO 3 .
2.Добавление гашеной извести Ca(OH) 2 .
1.5.1.Термический метод (кипячение либо вымораживание воды)
При кипячении воды происходит разложение гидрокарбонатов кальция и магния с образованием углекислого газа и карбонатов этих металлов, которые выпадают в осадок:
Таким образом, в результате кипячения воды устраняется жесткость, обусловленная присутствием именно гидрокарбонатов. Это так называемая устранимая (временная) жесткость.
Благодаря этому методу мы легко можем приготовить душистый чай или вкусный компот. Витамины и другие полезные соединения мягкой водой лучше извлекаются из натуральных или засушенных фруктов. Многие хозяйки об этом знают и для приготовления компотов, лечебных настоев пользуются предварительно прокипяченной водой, ее аккуратно сливают, не взмучивая карбонатный осадок.
Для некоторых химических целей требуется достаточно полная очистка воды от солей, которые создают жесткость. Для ее устранения используют химические реагенты, такие, как карбонат натрия, гидроксид кальция, ортофосфат натрия.
а) Известково-содовый метод основан на обработке воды гашеной известью, при этом устраняется временная жесткость, а также связываются ионы Fe 2+ .
При добавлении соды происходит устранение постоянной жесткости:
MgCl 2 + Na 2 CO 3 → Mg СОз↓ + 2 NaCl
Использование соды при стирке позволяет экономить моющие средства, а отсутствие хлопьевидных осадков улучшает качество ручной и машинной стирки, особенно легко удаляются пятна различных видов технических загрязнений.
б) Фосфатный метод базируется на образовании нерастворимых ортофосфатов кальция и магния, выпадающих в осадок:
Реагенты, составляющие основу химического метода умягчения воды, входят в состав средств, предотвращающих образование накипи на стиральных машинах-автоматах.
1.5.3. Физико-химический метод
Он основан на использовании ионообменных смол–ионитов. Они представляют собой твердые полиэлектролиты, у которых ионы одного знака заряда закреплены на твердой матрице, а противоионы способны переходить в раствор.
Иониты, используемые в ионообменных установках, достаточно компактны и применяются в большинстве современных фильтров для очистки и умягчения воды.
Катиониты содержат ионы Na + или Н + –это сульфоугли или алюмосиликаты. Катионитное умягчение основано на свойстве некоторых нерастворимых веществ обменивать ионы натрия, водорода и другие на ионы кальция, магния, извлекая их из воды и тем самым, умягчая ее. Процесс этот происходит при фильтрации воды через катиониты на так называемых ионообменных фильтрах. Аниониты включают подвижные гидроксид-ионы, это так называемые искусственные смолы. [4].
Устранение путем ионного обмена:
Катионный обмен: 2 RH + Ca 2+ → R 2 Ca +2 H +
Анионный обмен :2ROH+SO 4 2- → R 2 SO 4 +2OH —
R -сложный органический радикал
1.Кипяченая вода считается «мёртвой». С помощью кипячения, вода очищается от хлора и минеральных солей, которые негативно сказываются на здоровье почек.
2.Минеральную воду лучше пить по назначению врача, так как она содержит в себе определенные основания и соли, не всегда нужные здоровому человеку.
3.Фильтрованная вода. Употребление такой воды не возбраняется, главный фактор- правильно подобранный фильтр.
4.Дистиллированная вода используется в химических лабораториях и промышленности, такую воду пить явно не стоит.
5.Талая вода отличается своей структурой от обыкновенной воды. Так как вымораживание – получение «живой воды» В текстах по нетрадиционной медицине талую воду обозначают термином «структурированная вода». Это значит, что структура этой жидкости изменена относительно равновесия к окружающей среде. После оттаивания молекулы выстраиваются определенным образом, благодаря этому вода приобретает совсем иные свойства. Структурированная вода, как утверждают сторонники метода, способна лечить заболевания, которые официальная медицина признает неизлечимыми.
Определения жесткости воды проводилось методом комплексонометрического титрования.
Основной операций данной работы является титрование.
Особенности выполнения анализа титриметрическим методом . Титрование — это медленное прибавление по каплям стандартного раствора к пробе до точки эквивалентности.
Титриметрический метод анализа основан на количественном определении объема раствора одного или двух веществ, вступающих между собой в реакцию, причем концентрация одного из них должна быть точно известна.
При выполнении анализа титриметрическим методом определение проводят в склянках или пробирках. В процессе титрования раствор перемешивают стеклянной палочкой либо встряхиванием.
Проба — (анализируемый раствор) — это вещество, концентрацию которого необходимо определить.
Точка эквивалентности — это момент окончания реакции, когда количество рабочего раствора эквивалентно количеству анализируемого раствора, определяется по изменению окраски индикатора. [5].
Индикатор — это вещество, не участвующие в реакции, но показывающие точку эквивалентности (появление, исчезновение, изменение окраски индикатора, выпадение осадка, появление пузырьков газа, запаха).
2.1.Подготовка проб к анализу
Отбор проб – операция, от правильного выполнения которой во многом зависит точность получаемых результатов. Отбор проб проводят после спуска воды в течение 10–15 мин – времени. Посуда для отбора проб должна быть чистой. Пробы воды были взяты в пластиковые бутылки ёмкостью 1 литр, вымытые без применения синтетических моющих средств. Перед набором воды бутылки несколько раз ополоснули набираемой водой
2.2.Материалы и методика проведения определения жесткости воды
Для эксперимента №1 были взяты 5 образцов воды:
-бутилированная вода разных производителей;
Для эксперимента №2 были взяты образцы умягченной воды:
— вода, кипяченная в течение 5 минут ;
— вода, кипяченная в течение 15 минут ;
-вода, кипяченная в течение30 минут ;
-вода, прошедшая обработку фильтром «Барьер» (кувшин);
-вода после содового метода умягчения.
-колбы конические вместимостью 250-300см 3 ;
-воронки, стаканы химические;
— трилон Б (комплексон III, двунатриевая соль этилендиаминтетрауксусной кислоты) 0,02моль/л ;
-аммиачный буферный раствор ( рН=10);
-индикатор эриохром черный Т;
В ходе исследования я ознакомился с методом определения жесткости воды с помощью трилона Б (комплексонометрический метод). Проведения анализа данным способом требует определенных практических навыков. После неоднократного проведения анализа одной и той же пробы, данные навыки были мною получены.
1. Мерным цилиндром отмерить 100 мл исследуемой Н 2 О и перелить ее в коническую колбу.
2. Добавить к воде 5 мл аммиачно-буферной смеси, затем 7-8 капель спиртового раствора индикатора эриохром черного Т .
3. Тщательно перемешать, раствор окрасится в винно-красный цвет.
4. Смесь оттитровать раствором трилона Б. К концу титрования раствор трилона Б добавлять по каплям, встряхивая смесь в колбе после добавления каждой капли.
5.Титрование можно считать законченным если после добавления очередной капли окраска раствора приобретает синий цвет с зеленоватым оттенком и с добавлением лишней капли раствора комплексона не изменяется.
6. Определить объем трилона Б, израсходованного на титрование.
7.Титрование повторить 2-3 раза и для расчета взять среднее значение.
8. Произвести расчет общей жесткости воды.
По результатам 3 определений рассчитывают средний обьем титранта и вычисляют жесткость воды. [6].
Результаты титрования и расчётов представлены в Таблице 2.1.
Общую жесткость воды рассчитывают по формуле (2.1):
где V 1 — объем анализируемой воды, мл
V 2 — объем раствора Трилона Б, мл
С 2 — молярная концентрация эквивалента Трилона Б, моль/л
1000 — коэффициент перевода моль/л в ммоль/л
2.4.Методика по снижению жесткости воды
Умягчение воды проводилось 4 методами :
1.Вода кипятилась 5, 15, 30 минут. Затем проводился анализ жесткости воды.
2.Воду налили в пластмассовый стакан и поставили в морозильник. Когда лед растаял измерили жесткость талой воды.
3.Вода прошедшая обработку фильтром «Барьер».
4. Прежде чем проводить опыты по снижению жесткости воды содой, были проведены расчеты для определения количества — Na 2 CO 3 .
Сколько граммов карбоната натрия необходимо взять, чтобы максимально понизить жесткость, если жесткость воды равна 8,75ммоль/л.
где m– масса вещества, обусловливающего жёсткость воды, или применяемого для устранения жёсткости воды (г) ;
Э – эквивалентная масса этого вещества, г/моль; V– объём воды, л.
где n– количество ионов металла; В – валентность металла.
Э(Na 2 СO 3 ) = 106 / 2 =53 (г/моль)
Из формулы (2.2) выразим массу:
m = Ж*Э*V= 0,00875*53*100 = 46,375 (г) на 100 мл воды;
Ответ: 46,375 г ( Na 2 СO 3 ) на 100мл. воды.
2.5.Результаты и обсуждения
Для определения жесткости мы выбрали метод прямого комплексонометриичес-кого титрования.
Провели анализ водопроводной воды, бутилированной и воды из родника. По результатам титрования рассчитываем жесткость воды по формуле (2.4):
где 1000 – коэффициент пересчета;
V трилона Б –средний объем комплексона III (трилона Б), пошедший на титрование ,мл;
V пробы – объём воды, взятой для анализа (100 мл).
Измерив жесткость всех образцов, получили данные которые приведены
Результаты измерения жёсткости воды
источник