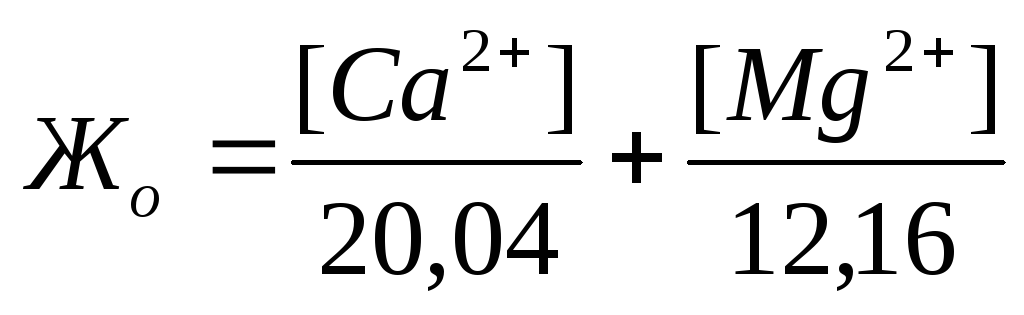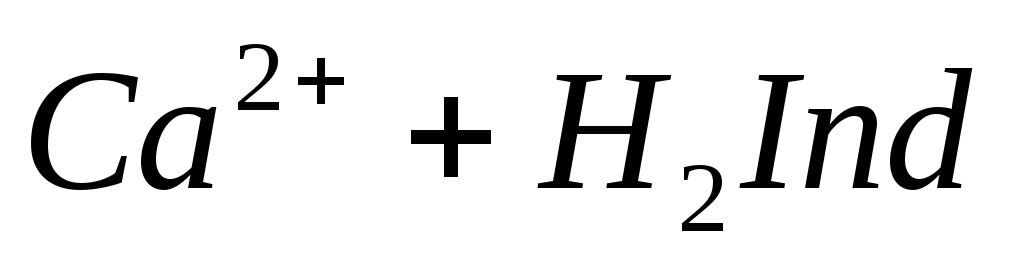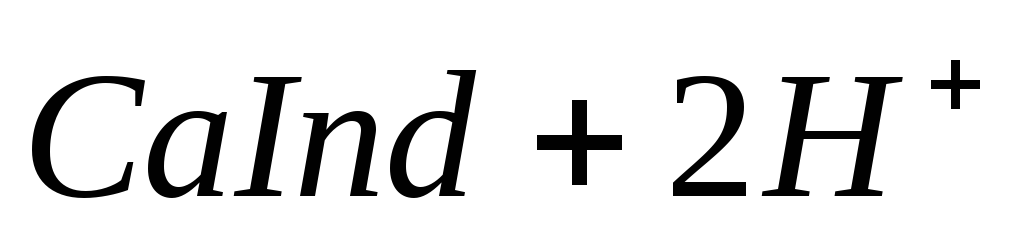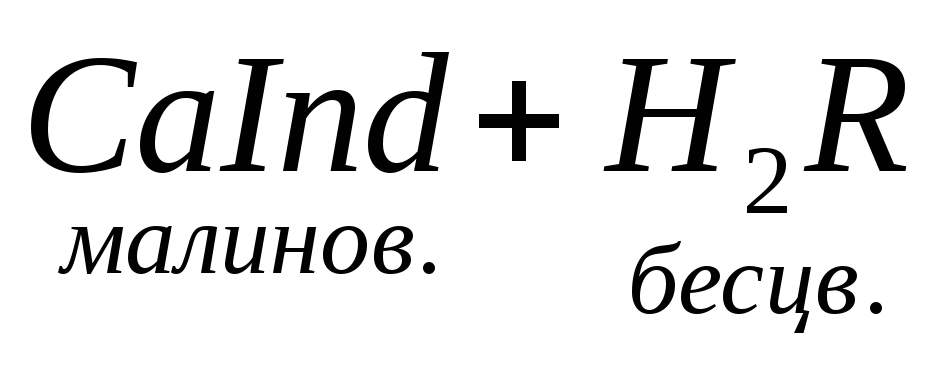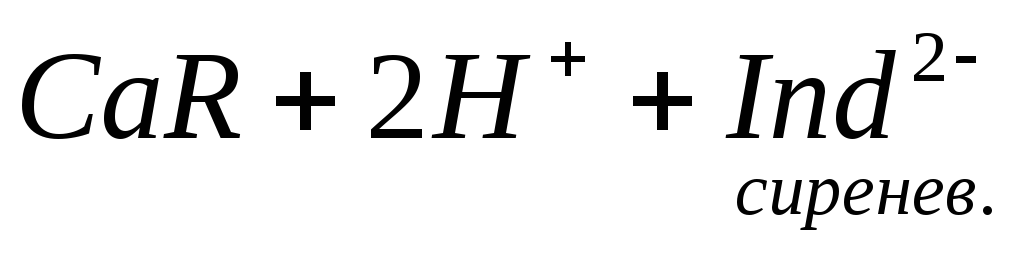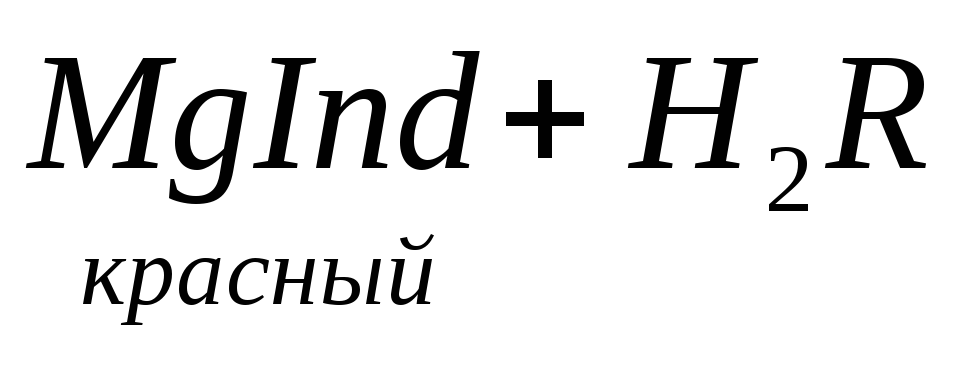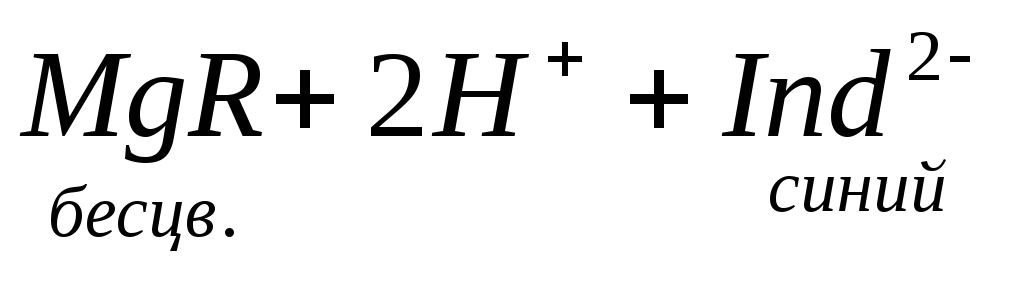В таблице ниже приведены основные показатели и их нормативы, рекомендуемые СанПиНом для питьевой воды трех категорий: водопроводной, бутилированной первой категории и бутилированной высшей категории.
Таблица поделена на области (тарифы), цена за выполнение анализа по всем показателям из соответствующей области указана в последнем столбце.
Вы можете заказать анализ как отдельно по любой из тарифных областей, так и в совокупности по всем областям.
Стоимость комплексного анализа воды на питьевые качества составляет 6000 руб. (без учета показателей радиационной безопасности, хлора и сероводорода)
| № | Показатели воды | Единицы измерения | Нормативы СанПиН 1) , не более | Нормативы СанПиН 2) , не более | Нормативы СанПиН 3) , не более | Класс опасности | Стоимость анализа |
| Оснвные интегральные показатели | |||||||
| I | Водородный показатель (pH) | отн.ед. | 6 — 9 | 6,5-8,5 | 6,5-8,5 | 4000 руб. | |
| Гидрокарбонаты | мг/л | — | — | — | |||
| Щелочность | мг-экв./л | — | 6,5 | 0,5-6,5 | |||
| Жесткость общая | мг-экв./л | 7,0 (10) 4) | 7,0 | 1,5-7 | |||
| Электропроводность | мкС/см | — | — | — | |||
| Мутность (взвешенные вещества) по формазину | ЕМФ | 2,6 (3,5) 4) | 1,0 | 0,5 | |||
| Запах при 20 о С | баллы | 2 | |||||
| Цветность | градусы | 20 (35) 4) | 5 | 5 | |||
| Привкус | баллы | 2 | |||||
| Сухой остаток (общая минерализация) | мг/л | 1000 (1500) | 1000 | 200-500 | |||
| Окисляемость перманганатная | мг О2/л | 5 | 3 | 2 | |||
| Аммиак и аммонийные соли | мг/л | 2 | 0,1 | 0,05 | — | ||
| Фториды | мг/л | 0,5-1,5 | 0,5-1,5 | 0,6-1,2 (0,6-0,7)* | |||
| Хлориды | мг/л | 350 | 250 | 150 | 4 | ||
| Нитриты | мг/л | 3,0 | 0,5 | 0,05 | 2 | ||
| Нитраты | мг/л | 45 | 20 | 5 | 3 | ||
| Фосфаты | мг/л | 3,5 | 3,5 | 3,5 | 3 | ||
| Сульфаты | мг/л | 500 | 250 | 150 | 4 | ||
| Железо | мг/л | 0,3 (1) 4) | 0,3 | 0,3 | 3 | ||
| Марганец | мг/л | 0,1 (0,5) | 0,05 | 0,05 | 3 | ||
| Дополнительные показатели для колодцев и воды с запахом | |||||||
| II | Сероводород и сульфиды | мг/л | 0,003 | 0,003 | 0,003 | 4 | 600 руб. |
| Дополнительные показатели для водопроводной воды | |||||||
| III | Хлор остаточый связанный | мг/л | 0,8-1,2 | 0,1 | 0,1 | 3 | 700 руб. |
| Хлор остаточный свободный | мг/л | 0,3-0,5 | 0,05 | 0,05 | 3 | ||
| Показатели химического микроэлементного состава | |||||||
| IV | Алюминий (Al 3+ ) | мг/л | 0,5 | 0,2 | 0,1 | 2 | 3500 руб. |
| Барий (Ba 2+ ) | мг/л | 0,1 | 0,7 | 0,1 | 2 | ||
| Бериллий (Be 2+ ) | мг/л | 0,0002 | 0,0002 | 0,0002 | 1 | ||
| Бор (B, суммарно) | мг/л | 0,5 | 0,5 | 0,3 | 2 | ||
| Ванадий (V, суммарно) | мг/л | 0,1 | 0,1 | 0,1 | 3 | ||
| Висмут (Bi, суммарно) | мг/л | 0,1 | 0,1 | 0,1 | 2 | ||
| Вольфрам (W, суммарно) | мг/л | 0,05 | 0,05 | 0,05 | 2 | ||
| Европий (Eu, суммарно) | мг/л | 0,3 | 0,3 | 0,3 | 4 | ||
| Железо (Fe, суммарно) | мг/л | 0,3 (1,0) | 0,3 | 0,3 | 3 | ||
| Кадмий (Cd, суммарно) | мг/л | 0,001 | 0,001 | 0,001 | 2 | ||
| Кобальт (Co, суммарно) | мг/л | 0,1 | 0,1 | 0,1 | 2 | ||
| Кремний (Si, суммарно) | мг/л | 10 | 10 | 10 | 2 | ||
| Литий (Li, суммарно) | мг/л | 0,03 | 0,03 | 0,03 | 2 | ||
| Марганец (Mn, суммарно) | мг/л | 0,1 (0,5) | 0,05 | 0,05 | 3 | ||
| Медь (Cu, суммарно) | мг/л | 1,0 | 1,0 | 1,0 | 3 | ||
| Молибден (Mo, суммарно) | мг/л | 0,25 | 0,07 | 0,07 | 2 | ||
| Мышьяк (As, суммарно) | мг/л | 0,05 | 0,01 | 0,006 | 2 | ||
| Натрий (Na + ) | мг/л | 200 | 200 | 20 | 2 | ||
| Никель (Ni, суммарно) | мг/л | 0,1 | 0,02 | 0,02 | 3 | ||
| Ниобий (Nb, суммарно) | мг/л | 0,01 | — | — | 2 | ||
| Ртуть (Hg, суммарно) | мг/л | 0,0005 | 0,0005 | 0,0002 | 1 | ||
| Рубидий (Rb, суммарно) | мг/л | 0,1 | 0,1 | 0,1 | 2 | ||
| Самарий (Sm, суммарно) | мг/л | 0,024 | — | — | 2 | ||
| Свинец (Pb, суммарно) | мг/л | 0,03 | 0,01 | 0,005 | 2 | ||
| Селен (Se, суммарно) | мг/л | 0,01 | 0,01 | 0,01 | 2 | ||
| Серебро (Ag + ) | мг/л | 0,05 | 0,025 | 0,0025 | 3 | ||
| Стронций (Sr 2+ ) | мг/л | 7,0 | 7,0 | 7,0 | 2 | ||
| Сурьма (Sb, суммарно) | мг/л | 0,05 | 0,005 | 0,005 | 2 | ||
| Таллий (Tl, суммарно) | мг/л | 0,0001 | — | — | 2 | ||
| Теллур (Te, суммарно) | мг/л | 0,01 | — | — | 2 | ||
| Фосфор элементарный (P, суммарно) | мг/л | 0,0001 | — | — | 1 | ||
| Хром (Cr 3+ ) | мг/л | 0,5 | — | — | 3 | ||
| Хром (Cr 6+ ) | мг/л | 0,05 | 0,05 | 0,03 | 3 | ||
| Цинк (Zn 2+ ) | мг/л | 5,0 | 5,0 | 3,0 | 3 | ||
| Показатели макро- и микроэлементного состава | |||||||
| Йодид-ион (I — ) | мг/л | 0,01-0,125** | 0,125** | 0,04-0,06*** | |||
| Кальций (Ca) | мг/л | 130 | 130 | 25-80 | |||
| Калий (K) | мг/л | — | 20 | 2-20 | |||
| Магний (Mg) | мг/л | 5 – 65 | 65 | 5-50 | |||
| Показатели радиационной безопасности | |||||||
| V | Удельная суммарная альфа-активность | Бк/кг | 0,2 | 0,1 | 0,1 | 4000 руб. | |
| Удельная суммарная бета-активность | Бк/кг | 1,0 | 1,0 | 1,0 | |||
* — Дополнительное требование, предъявляемое к расфасованная воде, используемой для приготовления детского питания (при искусственном вскармливании детей). По остальным показателям вода, используемая для приготовления детского питания, должна соответствовать нормативным величинам воды высшей категории.
** — Йодирование воды на уровне ПДК допускается при отсутствии профилактики йод-дефицита за счет йодированной соли при условии соблюдения допустимой суточной дозы (ДСД) йодид-иона, поступающего суммарно из всех объектов окружающей среды в организм.
*** — Йодирование воды на уровне 0,03 — 0,06 мг/л разрешается в качестве способа массовой профилактики йоддефицита при использовании иных мер профилактики.
Примечания к таблице:
• В 4-6 колонках таблицы указаны нормативы СанПиН для трех различных категорий питьевых вод:
1) (Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества).
2) (Питьевая вода. Гигиенические требования к качеству воды, расфасованной в ёмкости. Контроль качества) для расфасованной воды первой категории.
3) (Питьевая вода. Гигиенические требования к качеству воды, расфасованной в ёмкости. Контроль качества) для расфасованной воды высшей категории.
4) Величина, указанная в скобках к нормативу СанПиН 1) , может быть установлена по постановлению Главного государственного санитарного врача по соответствующей территории для конкретной системы водоснабжения на основании оценки санитарно-эпидемиологической обстановки в населённом пункте и применяемой технологии водоподготовки.
• В седьмой колонке указан класс опасности вещества:
1 класс — чрезвычайно опасные;
2 класс — высокоопасные;
3 класс — опасные;
4 класс — умеренно опасные.
источник
Имея собственную скважину на приусадебном участке, можно не переживать из-за стихийных отключений воды и экономить на оплате коммунальных услуг. Но есть и оборотная сторона медали. Если качество жидкости в центральном водопроводе еще более-менее соответствует гигиеническим нормам, то состав живительной влаги из колодца зачастую остается загадкой. Чтобы не играть со своим здоровьем в русскую рулетку, стоит периодически проводить количественный анализ воды из скважины. Нехитрая процедура позволит вам вовремя выявить посторонние «включения» и установить подходящие фильтры.
Нормы качества воды регламентирует «СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества». Согласно документу, вода для питья не должна нести угрозы по химическому и бактериологическому составу и обладать приятными органолептическими свойствами. Главными критериями считаются прозрачность, отсутствие привкуса и нейтральный запах.
Вот здесь и начинается самое интересное. Корректировка нормативов проводится в среднем раз в десятилетие, при этом пересмотру подвергается не только нормативная база, но и методики проведения анализов. К сожалению, данные по органолептическим показателям остаются неизменными в течение почти полувека. Как и несколько десятков лет назад, они определяются по субъективным ощущениям.
Реальную картину может предоставить только количественный химический анализ вод, проведенный в аттестованной лаборатории или СЭС. По данным ВОЗ, в повседневной жизни применяется около 70 тысяч видов химических веществ, около 20 процентов из них могут представлять потенциальную токсическую опасность. Чтобы достоверно определить показатели воды, необходимо сложное техническое оснащение и высокочувствительные реагенты.
Впрочем, не все так страшно. Несмотря на впечатляющее количество потенциальных угроз, в скважинах и колодцах встречается лишь малая часть вредоносных «добавок». Наиболее распространенной проблемой считается жесткая, то есть перенасыщенная минеральными компонентами, вода. Чрезмерная жесткость появляется в результате высокой концентрации солей магния и калия. Чем она грозит в быту? Нагревающие приборы быстро покрываются налетом накипи, что значительно снижает их ресурс. В жесткой воде плохо или совсем не пенятся моющие средства, что создает определенные проблемы при стирке и мытье посуды. Минеральные соли плохо влияют на чувствительную кожу – она пересыхает и начинает шелушиться.
Важно! Проблема жесткости воды решается установкой умягчающих фильтров, самый эффективный из которых – система обратного осмоса.
Количественный анализ воды разделяется на несколько видов:
- Сокращенный анализ;
- Полный химический анализ;
- Анализ отдельных показателей.
В большинстве случаев достаточно лайт-версии. Если результаты подобной проверки выявили отклонения от нормы, то проводится полный анализ с упором на отдельные элементы.
На сегодняшний день наиболее информативным является количественный химический анализ вод. Для глубоких источников (от 25 метров) достаточно изучения состава воды по 14 пунктам. Жидкость из колодцев чаще подвергается загрязнению неорганическими соединениями, поэтому ее исследуют по 25 параметрам.
Важно! Перед вводом в эксплуатацию нового источника всегда проводится расширенный анализ.
Исследование состава воды затрагивает следующие показатели:
- Жесткость;
- Щелочность;
- Содержание железа;
- Окисляемость;
- Наличие и процентное содержание химических примесей.
Стоимость количественного анализа воды колеблется в пределах 50-75 долларов (зависит от лаборатории).
Достоверность результатов зависит не только от уровня лаборатории, но и от правильности забора воды из скважины. Чтобы в жидкость не попали сторонние примеси, соблюдайте определенные правила:
- Используйте стерильную емкость. Стеклянную тару нужно прокипятить, пластиковую – обдать кипятком.
- Минимальный показательный объем – 1 литр, но лучше набирать не менее 1,5-2 литров.
- Нельзя брать пластиковые бутылки из-под газированных напитков – красители, входящие в состав лимонада, могут негативно повлиять на результаты анализа.
Важно! Пробы воды необходимо доставить в лабораторию в течение 24 часов.
Как сделать количественный анализ воды в домашних условиях? В хозяйственных магазинах и аптеках можно приобрести экспресс-тесты – комплекты с полосками, пропитанными соответствующими реагентами. Как правило, в набор входит несколько тестов, определяющих самые распространенные загрязнения. Специалисты не рекомендуют полагаться на результаты подобных исследований, поскольку бытовые реагенты срабатывают только при очень высоком уровне содержания вредных веществ. Для периодического контроля или подбора фильтрующих систем домашние способы не подходят.
Важно! Приобретая экспресс-тесты, убедитесь, что они прошли государственную аттестацию и испытания в центрах Минприроды России. Продавец обязан предоставить вам соответствующие документы.
Количественный химический анализ вод служит основанием для подбора фильтров очистки. Но насколько чистой должна быть питьевая вода? Стоит ли избавляться от всех минеральных веществ, содержащихся в жидкости? Специалисты говорят твердое «нет», и тому есть ряд причин:
- Химические элементы поддерживают кислотно-щелочной баланс нашего организма.
- Фтор, содержащийся в воде, укрепляет зубную эмаль.
- Микроэлементы и соли снижают риск развития сердечно-сосудистых заболеваний.
Для здоровья человека крайне важно очистить питьевую воду от излишков солей и минералов, но не сделать ее дистиллированной, то есть полностью избавленной от каких-либо запахов и примесей. Не стоит надеяться на результаты сомнительных тестов и приобретать супер-мощные системы фильтрации без проведения лабораторных анализов. Обращайтесь в сертифицированные центры и будьте здоровы!
источник
Температура воды поверхностных источников зависит от температуры воздуха, его влажности, скорости и характера движения воды и ряда других факторов. Она может изменяться в весьма широких пределах по сезонам года (от 0,1 до 30* С). Температура воды подземных источников более стабильна (8-12 * С).
Оптимальной температурой воды для питьевых целей считается 7-11*С.
Для некоторых производств, в частности для систем охлаждения и конденсации пара, температура воды имеет большое значение.
Мутность (прозрачность, содержание взвешенных веществ) характеризует наличие в воде частиц песка, глины, илистых частиц, планктона, водорослей и других механических примесей, которые попадают в нее в результате размыва дна и берегов реки, с дождевыми и талами водами, со сточными водами и т.п. Мутность воды подземных источников, как правило, невелика и обуславливается взвесью гидрооксида железа. В поверхностных водах мутность чаще обусловлена присутствием фито- и зоопланктона, глинистых или илистых частиц, поэтому величина зависит от времени паводка (межени) и меняется в течении года.
По нормам СанПиН 2.1.4.1074-01 мутность питьевой воды должна быть не выше 1,5 мг/л.
На многих производствах можно использовать воду с гораздо большим содержанием взвешенных веществ, чем определено ГОСТом. В то же время для некоторых производств химической, пищевой, электронной, медицинской и других видов промышленности требуется вода такого же или даже более высокого качества.
Цветность воды (интенсивность окраски) выражается в градусах по платиново-кобальтовой шкале. Один градус шкалы соответствует цвету 1 литра воды, окрашенного добавлением 1 мг соли — хлорплатината кобальта. Цветность воды подземных вод вызывается соединениями железа, реже — гумусовыми веществами (грунтовка, торфяники, мерзлотные воды); цветность поверхностных — цветением водоемов.
По нормам СанПиН 2.1.4.1074-01 на питьевую воду, цветность воды не должна быть выше 20 град. (в особых случаях не выше 35 град.)
Многие виды промышленности предъявляют гораздо более жесткие требования в отношении цветности используемой воды.
Запахи и привкусы воды обусловливаются присутствием в ней органических соединений. Интенсивность и характер запахов и привкусов определяют органолептически, т.е. с помощью органов чувств по пятибалльной шкале или по «порогу разбавления» испытуемой воды дистиллированной водой. При этом устанавливают кратность разбавления, необходимую для исчезновения запаха или привкуса. Запах и вкус определяют непосредственным дегустированием при комнатной температуре, а также при 60″С, что вызывает их усиление. По ГОСТ 2874-82 привкус и запах, определяемые при 20″С, не должны превышать 2 баллов.
0 баллов — запах и привкус не обнаруживается
1 балл — очень слабые запах или привкус (обнаруживает только опытный исследователь)
2 балла — слабые запах или привкус, привлекающие внимание неспециалиста
3 балла — заметные запах или привкус, легко обнаруживаемые и являющиеся причиной жалоб
4 балла — отчётливые запах или привкус, которые могут заставить воздержаться от употребления воды
5 баллов — настолько сильные запах или привкус, что вода для питья совершенно непригодна.
Вкус вызывается наличием в воде растворенных веществ и может быть соленым, горьким, сладким и кислым. Природные воды обладают, как правило, только солоноватым и горьковатым привкусом. Солёный вкус вызывается содержанием хлорида натрия, горький — избытком сульфата магния. Кислый вкус воде придаёт большое количество растворённой углекислоты (минеральные воды). Вода может иметь также чернильный или железистый привкус, вызванный солями железа и марганца или вяжущий привкус, вызванный сульфатом кальция, перманганатом калия, щелочной привкус — вызван содержанием поташи, соды, щелочи.
Привкус может быть естественного происхождения (присутствие железа, марганца, сероводорода, метана и т.д.) и искусственного происхождения (сброс промышленных стоков)
По нормам СанПиН 2.1.4.1074-01 привкус должен быть не более 2 баллов.
Запахи воды определяются живущими и отмершими организмами, растительными остатками, специфическими веществами, выделяемыми некоторыми водорослями и микроорганизмами, а также присутствием в воде растворенных газов — хлора, аммиака, сероводорода, меркаптанов или органических и хлорорганических загрязнений. Различают природные (естественного происхождения) запахи: ароматический, болотный, гнилостный, древесный, землистый, плесневый, рыбный, травянистый, неопределённый и сероводородный, тинистый и др. Запахи искусственного происхождения называют по определяющим их веществам: хлорный, камфорный, аптечный, фенольный, хлор-фенольный, смолистый, запах нефтепродуктов и так далее.
По нормам СанПиН 2.1.4.1074-01 запах воды должен быть не более 2 баллов.
Содержание растворенных веществ (сухой остаток). Общее количество веществ (кроме газов), содержащихся в воде в растворенном состоянии, характеризуется сухим остатком, получаемых в результате выпаривания профильтрованной воды и высушивания задержанного остатка до постоянной массы. В воде, используемой для хозяйственно-питьевых целей, сухой остаток не должен превышать 1000 мг/л в особых случаях — 1500 мг/л. Общее солесодержание и сухой остаток характеризуют минерализацию (содержание растворенных солей в воде).
По СанПиН 2.1.4.1074-01 на питьевую воду, сухой остаток должен быть не более 1000 мг/л
Активная реакция воды — степень её кислотности или щёлочности — определяется концентрацией водородных ионов. Обычно выражается через рН — водородный и гидроксильный показатель. Концентрация ионов водорода определяет кислотность. Концентрация ионов гидроксила определяет щелочность жидкости. При рН = 7,0 — реакция воды нейтральная, при рН 7,0 — среда щелочная.
По нормам СанПиН 2.1.4.1074-01 рН питьевой воды должен быть в пределах 6,0. 9,0
Для вод большинства природных источников значение рН не отклоняется от указанных пределов. Однако после обработки вод реагентами значение рН может существенно измениться. Для правильной оценки качества воды и выбора способа очитски необходимо знать значение рН воды источника в различные периоды года. При низких значениях сильно возрастает ее коррозирующее действие на сталь и бетон.
Очень часто для описания качества воды используется термин — жесткость. Пожалуй, самое большое расхождение между российскими нормами и директивой Совета ЕС по качеству воды относится к жесткости: 7 мг-экв/л у нас и 1 мг-экв/л у них. Жесткость самая наиболее распространенная проблема качества воды.
Жесткость воды определяется содержанием в воде солей жесткости (кальция и магния). Она выражается в миллиграмм-эквивалентах на литр (мг-экв/л). Различают карбонатную (временную) жесткость, некарбонатную (постоянную) жесткость и общую жесткость воды.
Карбонатная жесткость (устранимая), определяется наличием в воле двууглекислых солей кальция и магния — характеризуется содержанием в воде гидрокарбоната кальция, который при нагревании или кипячении воды разлагается на практически нерастворимый карбонат и углекислый газ. Поэтому её еще называют временной жесткостью.
Некарбонатная или постоянная жесткость — содержание некарбонатных солей кальция и магния — сульфаты, хлориды, нитраты. При нагревании или кипячении воды они остаются в растворе.
Общая жесткость — определяется как суммарное содержание в воде солей кальция и магния, выражается как сумма карбонатной и некарбонатной жесткости.
Вода поверхностных источников, как правило, относительно мягкая (3. 6 мг-экв/л) и зависит от географического положения — чем южнее, тем жесткость воды выше. Жесткость подземных вод зависит от глубины и расположения горизонта водоносного слоя и годового объема осадков. Жесткость воды из слоёв известняка составляет обычно 6 мг-экв/л и выше.
По нормам СанПиН 2.1.4.1074-01 жесткость питьевой воды должна быть не выше 7 (10) мг-экв/л, ( или не более 350 мг/л).
Жесткая вода просто неприятна на вкус, в ней излишне много кальция. Постоянное употребление внутрь воды с повышенной жесткостью приводит к снижению моторики желудка, к накоплению солей в организме, и, в конечном итоге, к заболеванию суставов (артриты, полиартриты) и образованию камней в почках и желчных путях.
Хотя очень мягкая вода не менее опасная, чем излишне жесткая. Самая активная — это мягкая вода. Мягкая вода способна вымывать из костей кальций. У человека может развиться рахит, если пить такую воду с детства, у взрослого человека становятся ломкие кости. Есть еще одно отрицательное свойство мягкой воды. Она, проходя через пищеварительный тракт, не только вымывает минеральные вещества, но и полезные органические вещества, в том числе и полезные бактерии. Вода должна быть жесткостью не менее 1,5-2 мг-экв/л.
Использование воды с большой жесткостью для хозяйственных целей также нежелательно. Жесткая вода образует налет на сантехнических приборах и арматуре, образует накипные отложения в водонагревательных системах и приборах. В первом приближении это заметно на стенках, например, чайника.
При хозяйственно-бытовом использовании жесткой воды значительно увеличивается расход моющих средств и мыла вследствие образования осадка кальциевых и магниевых солей жирных кислот, замедляется процесс приготовления пищи (мяса, овощей и др.), что нежелательно в пищевой промышленности. Во многих случаях использование жесткой воды для производственных целей (для питания паровых котлов, в текстильной бумажной промышленности, на предприятиях искусственного волокна и др.) не допускается, так как это связано с рядом нежелательных последствий.
В системах водоснабжения — жесткая вода приводит к быстрому износу водонагревательной технике (бойлеров, батарей центрального водоснабжения и др.). Соли жесткости (гидрокарбонаты Ca и Mg), отлагаясь на внутренних стенках труб, и образуя накипные отложения в водонагревательных и охлаждающих системах, приводят к занижению проходного сечения, уменьшают теплоотдачу. Не допускается использовать воду с высокой карбонатной жесткостью в системах оборотного водоснабжения.
Щёлочность воды. Под общей щёлочностью воды подразумевается сумма содержащихся в ней гидратов и анионов слабых кислот (угольной, кремниевой, фосфорной и т.д.). В подавляющем большинстве случаев для подземных вод имеется в виду гидрокарбонатная щёлочность, то есть содержание в воде гидрокарбонатов. Различают бикарбонатную, карбонатную и гидратную щелочность. Определение щелочности (мг-экв/л) необходимо для контроля качества питьевой воды, полезно для определения воды как пригодной для полива, для расчета содержания карбонатов, для последующей очистки сточных вод.
ПДК по щелочности составляет 0,5 — 6,5 ммоль / дм3
Содержание сульфатов и хлоридов. Сульфаты и хлориды кальция и магния образуют соли некарбонатной жесткости.
Хлориды присутствуют практически во всех водах. В основном их присутствие в воде связано с вымыванием из горных пород наиболее распространённой на Земле соли — хлорида натрия (поваренной соли). Хлориды натрия содержатся в значительных количествах в воде морей, а также некоторых озер и подземных источников
ПДК хлоридов в воде питьевого качества — 300. 350 мг/л (в зависимости от стандарта).
Повышенное содержание хлоридов в совокупности с присутствием в воде аммиака, нитритов и нитратов может свидетельствовать о загрязнённости бытовыми сточными водами.
Сульфаты попадают в подземные воды в основном при растворении гипса, находящегося в пластах. Повышенное содержание сульфатов в воде приводит к расстройству желудочно-кишечного тракта (тривиальные названия сульфата магния и сульфата натрия (солей, обладающих слабящим эффектом) — «английская соль» и «глауберова соль» соответственно).
ПДК сульфатов в воде питьевого качества — 500 мг/л.
Содержание кремниевых кислот. Кремниевые кислоты встречаются в воде как подземных, так и поверхностных источников в различной форме (от коллоидной до ионодисперсной). Кремний отличается малой растворимостью и его в воде, как правило, не много. Попадает кремний в воду и с промышленными стоками предприятий, производящих керамику, цемент, стекольные изделия, силикатные краски.
Воды, содержащие кремниевые кислоты, не могут быть использованы для питания котлов высокого давления, так как образуют силикатную накипь на стенках.
Фосфаты обычно присутствуют в воде в небольшом количестве, поэтому их присутствие указывает на возможность загрязнения промышленными стоками или стоками с сельскохозяйственных полей. Повышенное содержание фосфатов оказывает сильное влияние на развитие сине-зелёных водорослей, выделяющих токсины в воду при отмирании.
ПДК в питьевой воде соединений фосфора составляет 3,5 мг/л.
Фториды и йодиды. Фториды и йодиды в чём-то похожи. Оба элемента при недостатке или избытке в организме приводят к серьёзным заболеваниям. Для йода это — заболевания щитовидной железы («зоб»), возникающие при суточном рационе менее 0,003 мг или более 0,01 мг. Для восполнения дефицита йода в организме возможно употребление йодированной соли, но лучший выход — это включение в рацион рыбы и морепродуктов. Особенно богата йодом морская капуста.
Фториды входят в состав минералов — солей фтора. Как недостаток, так и избыток фтора могут приводить к серьезным заболеваниям. Содержание фтора в питьевой должно поддерживаться в пределах 0,7 — 1,5 мг/л (в зависимости от климатических условий)
Воды поверхностных источников характеризуются преимущественно низким содержанием фтора (0,3-0,4 мг/л). Высокие содержания фтора в поверхностных водах являются следствием сброса промышленных фторсодержащих сточных вод или контакта вод с почвами, богатыми соединениями фтора. Максимальные концентрации фтора (5-27 мг/л и более) определяют в артезианских и минеральных водах, контактирующих с фторсодержащими водовмещающими породами.
При гигиенической оценке поступления фтора в организм важное значение имеет содержание микроэлемента в суточном рационе, а не в отдельных пищевых продуктах. В суточном рационе содержится от 0,54 до 1,6 мг фтора (в среднем 0,81 мг). Как правило, с пищевыми продуктами в организм человека поступает в 4-6 раз меньше фтора, чем при употреблении питьевой воды, содержащей оптимальные его количества (1 мг/л).
Повышенное содержание фтора в воде (более 1,5 мг/л) оказывает вредное влияние на людей и животных, у населения развивается эндемический флюороз («пятнистая эмаль зубов»), рахит и малокровие. Отмечается характерное поражение зубов, нарушение процессов окостенения скелета, истощение организма. Содержание фтора в питьевой воде лимитируется. Установлено, что систематическое использование населением фторированной воды снижает и уровень заболеваний, связанных с последствиями одонтогенной инфекции (ревматизм, сердечно-сосудистая патология, заболевания почек и др.). Недостаток фтора в воде (менее 0,5 мг/л) приводит к кариесу. При пониженном содержание фтора в питьевой воде рекомендуется пользоваться зубной пастой с добавлением фтора. Фтор — один из немногих элементов, которые лучше усваиваются организмом из воды. Оптимальная доза фтора в питьевой воде составляет 0,7. 1,2 мг/л.
ПДК фтора составляет 1,5 мг/л.
Окисляемость обусловлена содержанием в воде органических веществ и отчасти может служить индикатором загрязнённости источника сточными водами. Различают окисляемость перманганатную и окисляемость бихроматную (или ХПК — химическая потребность в кислороде). Перманганатная окисляемость характеризует содержание легкоокисляемой органики, бихроматная — общее содержание органических веществ в воде. По количественному значению показателей и их отношению можно косвенно судить о природе органических веществ, присутствующих в воде, о пути и эффективности технологии очистки.
По нормам СанПиН перманганатная окисляемость воды должна быть не выше 5,0 мг О2/л и предельно допустимая концентрация (ПДК) 2 мг-экв/л.
Если меньше 5 мг-экв/л вода считается чистой, больше 5 грязной.
Содержание соединений железа. Железо может встречаться в природных водах в следующих видах:
— Истинно растворённом виде (двухвалентное железо, прозрачная бесцветная вода);
— Нерастворённом виде (трёхвалентное железо, прозрачная вода с коричневато-бурым осадком или ярко выраженными хлопьями);
— Коллоидном состоянии или тонкодисперсной взвеси (окрашенная желтовато-коричневая опалесцирующая вода, осадок не выпадает даже при длительном отстаивании);
— Железоорганика — соли железа и гуминовых и фульвокислот (прозрачная желтовато-коричневая вода);
— Железобактерии (коричневая слизь на водопроводных трубах);
В поверхностных водах средней полосы России содержится от 0,1 до 1 мг/дм3 железа, в подземных водах содержание железа часто превышает 15-20 мг/дм3.
Значительные количества железа поступают в водоемы со сточными водами предприятий металлургической, металлообрабатывающей, текстильной, лакокрасочной промышленности и с сельскохозяйственными стоками. Очень важен анализ на содержание железа для сточных вод. Концентрация железа в воде зависит от рН и содержания кислорода в воде. Железо в воде колодцев и скважин может находится как в окисленной, так и в востановленной форме, но при отстаивании воды всегда окисляется и может выпадать в осадок. Много железа растворено в кислых бескислородных подземных водах.
По нормам СанПиН 2.1.4.1074-01 содержание железа общего допускается не более 0,3 мг/л.
Длительное употребление человеком воды с повышенным содержанием железа может привести к заболеванию печени (гемосидерит), увеличивает риск инфарктов, негативно влияет на репродуктивную функцию организма. Такая вода неприятна на вкус, причиняет неудобства в быту.
На многих промышленных предприятиях, где вода употребляется для промывки продукта в процессе его изготовления, в частности в текстильной промышленности, даже невысокое содержание железа в воде приводит к браку продукции.
Марганец встречается в аналогичных модификациях. Марганец активизирует ряд ферментов, участвует в процессах дыхания, фотосинтеза, влияет на кроветворение и минеральный обмен. Недостаток марганца в почве вызывает у растений некрозы, хлорозы, пятнистости. При недостатке этого элемента в кормах животные отстают в росте и развитии, у них нарушается минеральный обмен, развивается анемия. На почвах, бедных марганцем (карбонатных и переизвесткованных), применяют марганцевые удобрения.
Для человека опасен как недостаток, так и переизбыток марганца.
По нормам СанПиН 2.1.4.1074-01 содержание марганца допускается не более 0,1 мг/л.
Избыток марганца вызывает окраску и вяжущий привкус, заболевание костной системы.
Присутствие в воде железа и марганца может способствовать развитию в трубах и теплообменных аппаратах железистых и марганцевых бактерии, продукты жизнедеятельности которых вызывают уменьшение сечения, а иногда их полную закупорку. Содержание железа и марганца строго ограничено в воде, используемой при производстве пластмасс, текстильной, пищевой промышленности и т.п.
Повышенное содержание обоих элементов в воде вызывает потёки на сантехнике, окрашивает бельё при стирке и придаёт воде железистый или чернильный привкус. Длительное употребление такой воды для питья вызывает отложение указанных элементов в печени и по вредности значительно обгоняет алкоголизм.
ПДК железа — 0,3 мг/л, марганца — 0,1 мг/л.
Натрий и калий попадают в подземные воды за счёт растворения коренных пород. Основным источником натрия в природных водах являются залежи поваренной соли NaCl, образовавшиеся на месте древних морей. Калий встречается в водах реже, так как он лучше поглощается почвой и извлекается растениями.
Биологическая роль натрия крайне важна для большинства форм жизни на Земле, включая человека. Организм человека содержит около 100 г натрия. Ионы натрия активируют ферментативный обмен в организме человека.
ПДК натрия составляет 200 мг/л. Избыточное содержание натрия в воде и пище приводит к гипертензии и гипертонии.
Отличительная особенность калия — его способность вызывать усиленное выведение воды из организма. Поэтому пищевые рационы с повышенным содержанием элемента облегчают функционирование сердечно-сосудистой системы при ее недостаточности, обусловливают исчезновение или существенное уменьшение отеков. Дефицит калия в организме ведет к нарушению функции нервно-мышечной (парезы и параличи) и сердечно-сосудистой систем и проявляется депрессией, дискоординацией движений, мышечной гипотонией, гипорефлек-сией, судорогами, артериальной гипотонией, брадикардией, изменениями на ЭКГ, нефритами, энтеритами и др.
ПДК калия составляет 20 мг/л
Медь, цинк, кадмий, свинец, мышьяк, никель, хром и ртуть преимущественно попадают в источники водоснабжения со стоками промышленных вод. Медь и цинк могут также попадать при коррозии соответственно оцинкованных и медных водопроводных труб из-за повышенного содержания агрессивной углекислоты.
ПДК в питьевой воде согласно СанПиН меди составляет 1,0 мг/л; цинка — 5,0 мг/л; кадмия — 0,001 мг/л; свинца — 0,03 мг/л; мышьяка — 0,05 мг/л; никеля — составляет 0,1 мг/л (в странах ЕС — 0,05 мг/л), хрома Cr3+ — 0,5 мг/л, хрома Cr4+ — 0,05 мг/л; ртути — 0,0005 мг/л.
Все вышеперечисленные соединения относятся к тяжёлым металлам и обладают кумулятивным действием, то есть свойством накапливаться в организме и срабатывать при превышении определённой концентрации в организме.
Кадмий — очень токсичный металл. Избыточное поступление кадмия в организм может приводить к анемии, поражению печени, кардиопатии, эмфиземе легких, остеопорозу, деформации скелета, развитию гипертонии. Наиболее важным в кадмиозе является поражение почек, выражающееся в дисфункции почечных канальцев и клубочков с замедлением канальцевой реабсорбции, протеинурией, глюкозурией, последующими аминоацидурией, фосфатурией. Избыток кадмия вызывает и усиливает дефицит Zn и Se. Воздействие на протяжении продолжительного времени может вызывать поражение почек и легких, ослабление костей.
Симптомы кадмиевого отравления: белок в моче, поражение центральной нервной системы, острые костные боли, дисфункция половых органов. Кадмий влияет на кровяное давление, может служить причиной образования камней в почках (в почках он накапливается особенно интенсивно). Опасность представляют все химические формы кадмия
Алюминий — легкий серебристо-белый металл. Попадает в воду в первую очередь в процессе водоподготовки — в составе коагулянтов и при сбросе сточных вод переработки бокситов.
ПДК в воде солей алюминия составляет — 0,5 мг/л
Избыток алюминия в воде приводит к повреждению центральной нервной системы.
Бор и селен присутствуют в некоторых природных водах в качестве микроэлементов в весьма незначительной концентрации, однако, при их превышении возможно серьёзное отравление.
Содержание газов. В воде природных источников чаще всего присутствуют следующие газы: кислород О2, диоксид углерода (углекислый газ) СО2 и сероводород Н2S
Кислород находится в воде в растворенном виде. Растворенный кислород в подземных водах отсутствует, содержание в поверхностных водах соответствует парциальному давлению, зависит от температуры воды и интенсивности процессов, обогащающих или обедняющих воду кислородом и может достигать 14 мг/л
Содержание кислорода и двуокиси углерода даже в значительных количествах не ухудшает качества питьевой воды, но способствует коррозии металла. Процесс коррозии усиливается с повышением температуры воды, а также при движении её. При значительном содержании в воде агрессивной двуокиси углерода коррозии подвергаются также стенки бетонных труб и резервуаров. В питательной воде паровых котлов среднего и высокого давления присутствие кислорода не допускается. Содержание сероводорода придает воде неприятный запах и, кроме того, вызывает коррозию металлических стенок труб, баков и котлов. В связи с этим присутствие Н2S не допускается в воде, употребляемой для хозяйственно-питьевых и для большинства производственных нужд.
Вещества, содержащиеся в воде и их свойства, ухудшающие качество питьевой воды и вредно влияющие на организм человека.
Соединения азота. Азотосодержащие вещества (нитраты NO3-, нитриты NO2- и аммонийные соли NH4+) почти всегда присутствуют во всех водах, включая подземные, и свидетельствуют о наличии в воде органического вещества животного происхождения. Являются продуктами распада органических примесей, образуются в воде преимущественно в результате разложения мочевины и белков, поступающих в неё с бытовыми сточными водами. Рассматриваемая группа ионов находится в тесной взаимосвязи.
Первым продуктом распада является аммиак (аммонийный азот) — является показателем свежего фекального загрязнения и является продуктом распада белков. В природной воде ионы аммония окисляются бактериями Nitrosomonas и Nitrobacter до нитритов и нитратов. Нитриты являются лучшим показателем свежего фекального загрязнения воды, особенно при одновременном повышенным содержании аммиака и нитритов. Нитраты служат показателем более давнего органического фекального загрязнения воды. Недопустимо содержание нитратов вместе с аммиаком и нитратами.
По наличию, количеству и соотношению в воде азотсодержащих соединений можно судить о степени и давности заражения воды продуктами жизнедеятельности человека.
Отсутствие в воде аммиака и в то же время наличие нитритов и особенно нитратов, т.е. соединений азотной кислоты, свидетельствуют о том, что загрязнение водоема произошло давно, и вода подверглась самоочищению. Наличие в воде аммиака и отсутствие нитратов указывают на недавнее загрязнение воды органическими веществами. Следовательно, в питьевой воде не должно быть аммиака, не допускаются соединения азотной кислоты (нитриты).
По нормам СанПиН ПДК в воде аммония составляет 2,0 мг/л; нитритов — 3,0 мг/л; нитратов — 45,0 мг/л.
Наличие иона аммония в концентрациях, превышающих фоновые значения, указывает на свежее загрязнение и близость источника загрязнения (коммунальные очистные сооружения, отстойники промышленных отходов, животноводческие фермы, скопления навоза, азотных удобрений, поселения и др.).
Употребление воды с повышенным содержанием нитритов и нитратов приводит к нарушению окислительной функции крови.
Хлор появляется в питьевой воде в результате её обеззараживания. Сущность обеззараживающего действия хлора заключается в окислении или хлорировании (замещении) молекул веществ, входящих в состав цитоплазмы клеток бактерий, отчего бактерии гибнут. Очень чувствительны к хлору возбудители брюшного тифа, паратифов, дизентерии, холеры. Даже сильно заражённая бактериями вода в значительной мере дезинфицируется сравнительно малыми дозами хлора. Однако отдельные хлоррезистентные особи сохраняют жизнеспособность, поэтому полной стерилизации воды не происходит.
Ввиду того, что свободный хлор относится к числу вредных для здоровья веществ, гигиенические номы СанПиН строго регламентирует содержание остаточного свободного хлора в питьевой воде централизованного водоснабжения. При этом СанПиН устанавливает не только верхнюю границу допустимого содержания свободного остаточного хлора, но и минимально-допустимую границу. Дело в том, что, что несмотря на обеззараживание на станции водоочистки, готовую «товарную» питьевую воду подстерегает немало опасностей по пути к крану потребителя. Например, свищ в стальной подземной магистрали, сквозь которые не только магистральная вода попадает наружу, но и загрязнения из почвы могут попасть в магистраль.
Остаточный хлор (оставшийся в воде после обеззараживания) необходим для предотвращения возможного вторичного заражения воды во время прохождения по сети.
По нормам СанПиН 2.1.4.559-96 содержание остаточного хлора в водопроводной воде должно быть не менее 0,3 мг/л и не более 0,5 мг/л.
Хлорированная вода неблагоприятно воздействует на кожу и слизистые оболочки, поскольку хлор является сильным аллергическим и токсическим веществом. Так, хлор вызывает покраснения различных участков кожи, а также становится причиной аллергического конъюктевита, первыми признаками которого являются жжение, слезотечение, отек век и другие болевые ощущения в области глаз. Дыхательная система также подвергается вредному воздействию: у 60% пловцов регистрируется проявление бронхоспазма после нескольких минут нахождения в бассейне с хлорированной водой.
Исследования показали, что около 10% хлора, используемого при хлорировании, участвует в образовании хлорсодержащих соединений. Приоритетными хлорсодержащими соединениями являются хлороформ, четырёххлористый углерод, дихлорэтан, трихлорэтан, тетрахлоэтилен. В сумме образующихся при водоподготовке ТГМ хлороформ составляет 70 — 90 %. Хлороформ вызывает профессиональные хронические отравления с преимущественным поражением печени и центральной нервной системы.
При хлорировании есть вероятность образования чрезвычайно токсичных соединений, тоже содержащих хлор, — диоксинов (диоксин в 68 тыс. раз ядовитее цианистого калия).
Хлорированная вода обладает высокой степенью токсичности и суммарной мутагенной активностью (СМА) химических загрязнений, что многократно увеличивает риск онкологических заболеваний.
По оценке американских экспертов, хлорсодержащие вещества в питьевой воде косвенно или непосредственно виновны в 20 онкозаболеваниях на 1 млн. жителей. Риск онкозаболеваний в России при максимальном хлорировании воды достигает 470 случаев на 1 млн. жителей. Предполагается, что 20-35% случаев заболевания раком (преимущественно толстой кишки и мочевого пузыря) обусловлены потреблением питьевой воды.
Сероводород, встречающийся в подземных водах, преимущественно неорганического происхождения. Он образуется в результате разложения сульфидов (пирит, серный колчедан) кислыми водами и восстановления сульфатов сульфатредуцирующими бактериями.
Сероводород обладает резким неприятным запахом, вызывает коррозию металлических стенок труб, баков и котлов и является общеклеточным и каталитическим ядом. Соединяясь с железом образует черный осадок сернистого железа FeS. По этим причинам, а также вследствие интенсификации процессов коррозии, сероводород следует полностью удалять из воды хозяйственно-питьевого назначения (по ГОСТ 2874-82 «Вода питьевая»).
СанПиН 2.1.4.559-96 (СанПиН2.1.4.1074-01) на питьевую воду мало того, что допускает присутствие сероводорода в воде до 0,03 мг/л, а сульфидов — до 3 мг/л, так эти цифры ещё никак не согласуется с элементарными знаниями химии: по данным диссоциации сероводорода и сульфидов в воде, при рН=9,0 (верхняя граница норматива на питьевую воду) доля сульфидов составляет примерно 98,5-99%, то есть в сто раз выше, чем сероводорода, и ПДК сульфидов соответственно должен быть не выше 0,3 мг/л .
Микробиологические показатели. Общая бактериальная загрязненность воды характеризуется количеством бактерий, содержащихся в 1 мл воды. Согласно ГОСТу, питьевая вода не должна содержать более 100 бактерий в 1 мл.
Особую важность для санитарной оценки воды имеет определение бактерий группы кишечной палочки. Присутствие кишечной палочки свидетельствует о загрязнении воды фекальными стоками и, следовательно, о возможности попадания в нее болезнетворных бактерий, в частности бактерий брюшного тифа.
В связи с тем, что при биологическом анализе воды определение патогенных бактерий затруднено, бактериологические определения сводятся к определению общего числа бактерий в 1 мл воды, растущих при 37″С, и кишечной палочки — бактерии коли. Наличие последней имеет индикаторные функции, т.е. свидетельствует о загрязнении воды выделениями людей и животных и т.п. Минимальный объем испытуемой воды, мл, приходящейся на одну кишечную палочку, называется колититром, а количество кишечных палочек в 1 л воды — коли-индексом. По ГОСТ 2874-82 допускается коли-индекс до 3, колититр — не менее 300, а общее число бактерий в 1 мл — до 100.
По нормам СанПиН2.1.4.1074-01 допустимо общее микробное число 50 КОЕ/мл, общие колиформные бактерии КОЕ/100мл и термотолетарные колиформные бактерии КОЕ/100мл — не допускаются.
Бактерии и вирусы из числа патогенных, т.е. паразитов, живущих на живом субстрате, развивающиеся в воде, могут вызвать заболевания брюшным тифом, амебиазом, парафитом, дизентерией, бруцеллезом, инфекционным гепатитом, острым гастроэнтеритом, сибирской язвой, холерой, полиомиелитом, туляремией, туберкулезом, диареей и др.
Экспертами всемирной организации здравоохранения (ВОЗ) установлено, что 80% всех заболеваний в мире связано в той или иной степени связаны с неудовлетворительным качеством питьевой воды и нарушением санитарно-гигиенических и экологических норм водообеспечения. В связи с чем, проблема обеспечения высококачественной водой является актуальной.
источник
Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
состав растворенных газов.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей.
Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или
12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO32 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO32 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общаяжесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам:
Общая жесткость
Карбонатная жесткость равна концентрации (мг/л) [HCO3– ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:
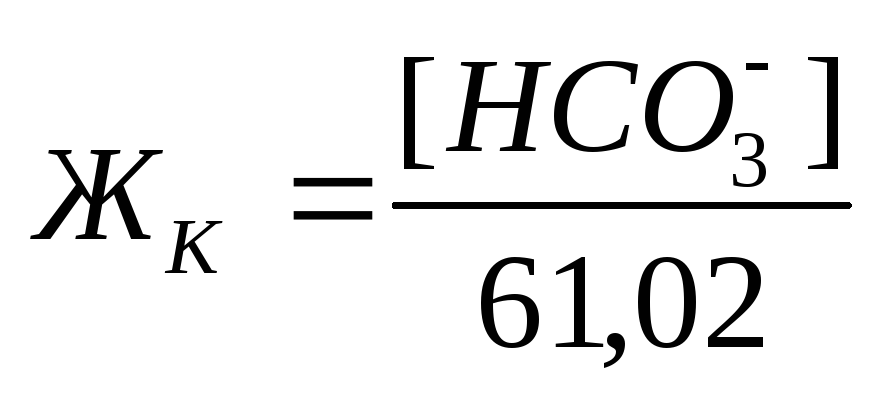
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК= ЖО– ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Окисляемость характеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества.
Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме
требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л.
При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Определение иона Cl – . В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO42– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO42– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO42– .
Определение ионов CO32– и HCO3– . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии.
Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO32 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО32– и НСО3– , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния:
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)
N
образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет.
Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:
Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна:
С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка.
Растворенные в воде газы определяют химическими методами или газовой хроматографией.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
Определение растворенного кислорода производится йодометрическим методом.
Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом:
Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе:
Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия:
I2+ 2Na2S2O3
Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II):
Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску.
В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания.
Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом.
В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом:
К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе.
источник