Химический анализ подземных вод может служить качественным показателем использования воды для хозяйственно-питьевого водоснабжения, бальнеологических, промышленных и хозяйственных целей, а также диагностическим признаком при гидрохимических методах поисков и разведки месторождений полезных ископаемых.
Результаты химического анализа подземных вод могут быть выражены в табличной или сокращенной отчетной форме в виде формулы Курлова.
1). Табличная форма выражения химического анализа.
Количественно концентрация катионов и анионов выражается в г/дм 3 , мг/дм 3 , а эквивалентное содержание – миллимолях (ммоль) и процентах (%).
Пример расчета химического анализа воды в табличной форме приводится ниже.
| Ионы | Содержание, мг/дм 3 | Эквивалентное содержание | |
| ммоль | % | ||
| Na + Ca 2+ Mg 2+ | 88,04 22,75 15,62 | 69,9 17,6 12,5 | |
| Сумма катионов | — | 126,41 | |
| Cl — SO4 2 — HCO3 — | 98,40 17,43 3,51 | 82,5 14,5 3,0 | |
| Сумма анионов | — | 119,34 | |
| М (сухой остаток) | — | — | |
| СО2(свободный) | — | — | |
| рН водородный показатель | 5,3 | — | — |
| Т воды, градус С | — | — |
Эквивалентное (молярное) содержание определяется путем умножения каждого иона на пересчетный коэффициент, учитывающий его атомный вес и валентность и представляющий собой величины, обратные эквивалентным массам ионов (таблица 2).
| Катионы | Коэффициент | Анионы | Коэффициент |
| Na + Ca 2+ Mg 2+ | 0,0435 0,0499 0,08222 | Cl — SO4 2- HCO3 — | 0,0282 0,0208 0,0164 |
Для пересчета в %-эквивалентную форму суммы катионов и анионов в миллимолях принимаются за 100%, а затем определяется доля каждого катиона и аниона в % от соответствующей суммы катионов и анионов.
Химический анализ считается достоверным, если ошибка анализа не превышает 5%.
В нашем случае С = 2,88%. Анализ достоверен.
2) Сокращенная форма выражения химического анализа (формула М.Г. Курлова)
Формула Курлова представляет собой псевдодробь, в числителе которой в порядке убывания в %-эквивалентной форме располагаются анионы, а в знаменателе – катионы. Ионы, содержание которых менее 1%, в формулу не включаются. Проценты округляют до целых чисел.
Слева от дроби указывается содержание газов в мг/дм 3 и минерализация (М) в г/дм 3 , за которую принимается сухой остаток. Справа записывают значение (рН), температуру воды (Т) в градусах Цельсия, дебит источника в м 3 /сут и содержание микроэлементов, если такие имеются.
В нашем случае формула Курлова (таблица 1):
3) Наименование воды по химическому составу.
Наименование химического типа подземных вод должно состоять из двух частей, отражающих преобладающий анионный и катионный состав воды. Наименование химического типа воды начинается с ее анионного, а затем катионного состава в %-эквивалентной форме, превышающего 20% от суммы миллимолярной концентрации. Перечисление ионов производится в порядке возрастания концентрации – от меньшего значения к большему.
В сокращенном анализе анионы представлены хлоридами, сульфатами и гидрокарбонатами, а катионы – натрием, кальцием и магнием. В нашем случае вода хлоридно-натриевая.
4) Классификация воды по минерализации.
В зависимости от величины минерализации, за которую принимается сухой остаток, подземные воды классифицируются в соответствии с приведенной таблицей 3.
| Минерализация М, г/дм 3 | Подгруппа | Группа |
| £ 0,5 >0,5-1,0 | Весьма пресные Пресные | Пресные |
| >1,0-1,5 >1,5-3,0 >3,0-5,0 >5,0-10,0 >10,0-25,0 | Весьма слабосолоноватые Слабо солоноватые Умеренно солоноватые Солоноватые Сильно солоноватые | Солоноватые |
| >25,0-36,0 >36,0-50,0 | Слабосоленые Сильносоленые | Соленые |
| >50,0-150,0 >150,0-350,0 >350,0 | Рассолы слабые Рассолы крепкие Рассолы весьма крепкие (рапа) | Рассолы |
В нашем случае М = 6,9 г/дм 3 . Вода солоноватая.
Реакция воды обусловлена величиной концентрации водородных ионов рН, которая представляет собой обратный логарифм концентрации ионов водорода. Классификация воды по водородному показателю приведена в таблице 4.
| Водородный показатель рН при Т22 о С | Подгруппа | Группа |
| £ 3,5 >3,5-4,5 >4,5-5,5 >5,5-6,0 | Весьма кислая Кислая Умеренно кислая Слабокислая | Кислая |
| >6,0-8,0 | Нейтральная | Нейтральная |
| >8,0-8,5 >8,5-9,0 >9,0-9,5 >9,5 | Слабощелочная Умеренно щелочная Щелочная Весьма щелочная | Щелочная |
В нашем случае рН = 5,3. Вода умеренно кислая.
6) Классификация подземных вод по температуре воды.
Классификация воды по температуре приведена в таблице 5.
| Температура, Т о С | Наименование |
| 0-4 >4-20 >20-37 >37-50 >50-75 >75-100 >100-200 >200-374 | Переохлажденная Очень холодная Холодная Теплая Очень теплая Горячая Очень горячая Слабо перегретая Весьма перегретая |
Примечание: воды с температурой от 20 до 100 о С называются термальными.
В нашем случае Т15 о С. Вода холодная.
Жесткость воды имеет большое значение при использовании подземных вод для питьевого водоснабжения, промышленных и хозяйственных целей. Жесткость воды обусловливается содержанием в ней солей кальция и магния. Измеряется в миллимолях (мг-экв/дм 3 ).
Различают общую жесткость (ОЖ), устранимую или временную жесткость (УЖ) и постоянную жесткость (ПЖ).
Общая жесткость обусловлена присутствием в воде гидрокарбонатов, хлоридов и сульфатов кальция и магния и равняется сумме устранимой и постоянной жесткости.
Устранимая жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния. Такая жесткость получила название карбонатной (КЖ) и может быть устранена при кипячении
Карбонат кальция и магния выпадает в осадок, образуя накипь. При использовании такой воды для промышленных и коммунальных целей происходит отложение карбоната кальция и магния на стенках котлов и трубопроводов, что приводит к выводу их из эксплуатации.
При высоком содержании НСО3 — в воде, превышающем суммарную концентрацию кальция и магния, вся жесткость считается карбонатной.
Постоянная жесткость обусловлена наличием в воде сульфатов и хлоридов кальция и магния и равняется разности между общей и карбонатной жесткостью.
Классификация воды по общей жесткости приводится в таблице 6 (ГОСТ 6055-86).
| Содержание в ммоль | Группа жесткости |
| £ 1,5 >1,5-3,0 >3,0-6,0 >6,0-9,0 >9,0 | Очень мягкая Мягкая Умеренно жесткая Жесткая Очень жесткая |
Подземные воды, жесткость которых превышает 7 ммоль, не могут быть использованы для питьевого и промышленного водоснабжения.
В нашем случае общая жесткость составляет 38,37 ммоль, устранимая (карбонатная) – 3,50 ммоль, постоянная – 34,86 ммоль. Вода очень жесткая, непригодная для питьевого и промышленного водоснабжения.
8) Пригодность для питьевого водоснабжения.
Пригодность воды для питьевого водоснабжения нормируется ГОСТ 6055-86 «Вода питьевая». В рамках сокращенного гидрохимического анализа нормативными являются минерализация, общая жесткость, содержание Cl — и SO 2- 4 , а также величина рН с предельно допустимыми концентрациями, приведенными в таблице 7.
| Наименование показателей | ПДК | Содержание в нашем примере | Степень пригодности |
Минерализация М, мг/дм 3 Общая жесткость ОЖ, ммоль 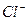 , мг/дм 3 , мг/дм 3 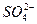 , мг/дм 3 рН , мг/дм 3 рН | 6,5-8,5 | 38,37 5,3 | Не пригодна Не пригодна Не пригодна Не пригодна Не пригодна |
В нашем случае вода по всем компонентам не пригодна для водоснабжения.
9) Пригодность для ирригационных целей.
Пригодность использования подземных вод, в том числе и шахтных, для ирригационных целей в сельском хозяйстве нормируется степенью минерализации воды и расчетным ирригационным коэффициентом. Классификация воды по минерализации, нормирующая степень пригодности для орошения сельскохозяйственных угодий, приведена в таблице 8.
| Минерализация, г/дм 3 | Степень пригодности для орошения |
| £1,7 >1,7-5,0 >5,0 | Пригодна Пригодна условно (возможно засоление) Не пригодна |
В нашем случае минерализация 6,9 г/дм 3 . Вода для орошения не пригодна.
Расчет ирригационного коэффициента выполняется в зависимости от соотношения ионов натрия, хлора и сульфатов в эквивалентной форме в миллимолях.


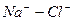
 |
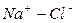

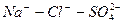
Во втором случае избыточное содержание катионов натрия может быть нейтрализовано содержащимся в воде сульфат-ионом. В третьем случае избыток натрия накапливается в почве в виде поглощенных катионов.
В первых двух случаях вода улучшению не подлежит, в третьем случае воду можно улучшить добавкой гипса. Классификация воды по ирригационному коэффициенту приведена в таблице 9.
| Ирригационный коэффициент | Характеристика воды | |
| >18 >6-18 ³1,2-6,0 + — , Кир= 0,58. Вода очень плохая и улучшению не подлежит. 10) Агрессивность подземных вод. Подземные воды в зависимости от состава могут оказывать разрушающее действие на бетоны, цементы и металлы. Оценка агрессивности подземных вод по отношению к бетонам марки W4 и металлам производится на основании таблиц 5-7 и 26 СНиП 2.03.11-85 «Защита строительных конструкций от коррозии» (в скобках указаны номера таблиц согласно СНиП). Дата добавления: 2015-04-18 ; просмотров: 71 ; Нарушение авторских прав источник Основными задачами химического анализа подземных вод в практике гидрогеологических исследований являются:
Существует четыре типа химических анализов подземных вод: полевой, сокращенный, полный и специальный. Полевой анализ наиболее прост, он применяется для предварительной характеристики подземных вод района. Его проводят в полевых условиях в походных гидрохимических лабораториях, часто упрощенными методами. При полевом анализе определяют: физические свойства воды, ее pH, наличие Сl — , SO 2- 4 , NO — 3, HCO — 3, СО3 2- , общую жесткость, присутствие Са 2+ , Fe 2+ , Fe 3+ , NH + 4 , N0 — 2, С02своб; вычисляют: Na + + К + , карбонатную жесткость, Mg 2+ и общую минерализацию. Сокращенный анализ . Этот анализ производят более точными методами в стационарных лабораториях. При сокращенном анализе определяют: физические свойства воды, величину pH, содержание ионов и компонентов (Сl — , SO 2- 4 — , NO — 3, HCO — 3, СО3 2- , Na + , К + , Ca 2+ , Mg 2+ , Fe 2+ , Fe 3+ , NH + 4 , N0 — 2, свободную и агрессивную углекислоту С02, Si02, окисляемость, сухой остаток, жесткость общую, карбонатную и некарбонатную. Полный анализ применяется для подробной характеристики химического состава подземных вод. Он производится наиболее точными методами в стационарных лабораториях. Анализ позволяет произвести контроль определений как по сухому остатку, так и по суммам мг-экв катионов и анионов. При полном анализе определяют: физические свойства воды, ее pH, наличие Сl — , SO 2- 4 — , NO — 3, HCO — 3, СО3 2- , Na + , К + , Ca 2+ , Mg 2+ , Fe 2+ , Fe 3+ , NH + 4 , N0 — 2, С02 своб и C0 2arpec, Si 0 2, окисляемость, сухой остаток; вычисляют: жесткость общую, карбонатную и некарбонатную, С0 2агрес. Специальный анализ. Помимо характеристик, определяемых при перечисленных выше типах анализа, этот анализ включает установление специальных показателей (микрокомпонентов, органических веществ, газов, Eh и др.) по особому заданию в соответствии с целевым назначением исследований. Количество отбираемой для анализа воды зависит от точности и чувствительности анализа и минерализации воды. Чем выше требования к чувствительности и точности анализа, тем больше должен быть объем пробы; пресные и слабо минерализованные воды отбирают в ббльших объемах, чем сильно минерализованные. При полевом анализе обычно бывает достаточно 0,5 л воды, при сокращенном — от 0,5 до 1,0 л (в зависимости от минерализации), а при полном — от 1,0 до 2,0 л. Для определения неустойчивых (изменяющихся во времени) компонентов — С02, H 2 S, 02, Fe и др. — применяют специальные методы отбора и хранения проб. Результаты химического анализа воды выражают в массовых количествах веществ, растворенных в 1 л (или в 1 кг воды), в эквивалентных количествах или в процент-эквивалентных количествах (%-экв) воды. В гидрогеологической практике принято массовые количества компонентов выражать в миллиграммах на 1 л (мг/л), а эквивалентные количества ионов — в миллиграмм-эквивалентах (мг-экв) каждого иона в 1 л воды. Величину сухого (плотного) остатка получают взвешиванием пробы после выпаривания воды. Сумму ионов определяют суммированием массы всех ионов, содержащихся в исследуемой воде. Сумма минеральных веществ — более полное выражение, чем сумма ионов, так как она учитывает и недиссоциированные неорганические вещества Si0 2 и Fe 2 03. В настоящее время принята ионная форма выражения химических анализов воды. Данные лабораторных анализов подземных вод, выраженные в мг/л, подвергаются дальнейшей обработке (табл.ниже). источник Химический состав подземных вод неодинаков и зависит от растворяемости прилегающих пород. Подземные воды представляют собой природные растворы, содержащие свыше 60 химических элементов, а также микроорганизмы. Сумма растворенных в воде веществ, исключая газы, определяет её минерализацию (выражаемую в г/л или мг/л).
При этом верхние горизонты подземных вод обычно пресные или слабоминерализованые, а нижние горизонты могут быть сильноминерализованными. Подземные воды, которые благодаря своим физико-химическим свойствам оказывают благотворное физиологическое воздействие на организм людей и используются для лечебных целей, называются минеральными. Химический состав минеральных вод весьма разнообразный: бывает углекислая вода (Кисловодск и другие курорты района Кавказских Минеральных вод, Боржоми, Карлови-Вари и др.), азотная (Цхал-тубо), сероводородная (Мацеста), железистая, радоновая и др. По В.И. Вернадскому по степени общей минерализации выделяют воды:
В бассейнах Восточно-Европейской платформы мощность зоны пресных подземных вод варьирует от 25 до 350 м, солёных вод — от 50 до 600 м, рассолов — от 400 до 3000 м. Приведенная классификация указывает на значительные изменения в минерализации воды – от десятков миллиграммов до сотен граммов на 1 литр воды. Максимальная величина минерализации, достигающая 500 – 600 г/л, встречена в последнее время в Иркутском бассейне. В последующем А.М. Овчинниковым и другими исследователями дано более дробное подразделение подземных вод по их минерализации (табл. 1). Для питьевых целей наилучшими водами являются пресные, с минерализацией до 1 г/л; при необходимости можно употреблять и слабо-солоноватые воды с общей минерализацией до 2 – 3 г/л. Воды с большей минерализацией для водоснабжения практически Са(НСО3)2 непригодны. Примечание : Уважаемые посетители, дефисы в длинных словах в таблице поставлены для удобства мобильных пользователей — иначе слова не переносятся и таблица не помещается в экран. Спасибо за понимание! – , SO4 2– , НСО3 – . Na + , Са 2+ , Mg 2+ иногда в заметных количествах NH4 + , К + , Fe 2+ и Mg 2+ , а из газов СО2, О2, реже H2S, N2. Различные сочетания первых основных шести элементов и определяют основные свойства подземной воды (рис. 1) – щелочность, соленость и жесткость. Так, например, при значительной концентрации ионов Na + и Cl – – вода приобретает соленый вкус, а при большом содержании ионов Na + и НСО3 – приобретает щелочные свойства. Рис. 1. Сочетания различных элементов, обусловливающих основные свойства воды. Классификация подземных вод по химическому составу в большинстве случаев производится по преобладающим анионам и катионам. Так, выделяются следующие наиболее распространенные классы: 1) гидрокарбонатные воды (НСО3 – >25 экв-%); 2) сульфатные воды (SO4 2– >25 экв-%); 3) хлоридные воды (Cl – >25 экв-%); 4) воды сложного состава: хлоридно-гидрокарбонатные, сульфатно-гидрокарбонатные, хлоридно-сульфатные и другие еще более сложного состава. По соотношению с катионами каждый из них может быть натриевым, или кальциевым, или магниевым, или смешанным – кальциево-магниевым, натриевокальциевым и др. Это хорошо выражено в классификации, предложенной С.А. Шукаревым и в последующем видоизмененной Н.Н. Славяновым (табл. 2). Каждый анион или группа анионов (указанных по вертикали) может образовывать с отдельными катионами или группой катионов (указанных по горизонтали) различные сочетания. Цифрами в таблице обозначены типы вод, соответствующие различным сочетаниям анионов и катионов. Например: к 1-му типу будут относиться гидрокарбонатно-кальциевые воды, ко 2-му – гидрокарбонатно-кальциево-магниевые, к 8-му – гидрокарбонатно-сульфатно-кальциевые, к 49-му – хлоридно-натриевые. Как видно из табл. 2, отчетливо проявляется закономерность изменения химического состава подземных вод с увеличением их минерализации от гидрокарбонатных к хлоридным. В ряде артезианских бассейнов наблюдается хорошо выраженная вертикальная зональность. В верхних водоносных горизонтах развиты гидрокарбонатные воды, ниже – смешанные и далее сульфатные, а еще ниже – высокоминерализованные хлоридные. Существуют и другие классификации подземных вод (Алекин, 1970), в которых учитывается не только деление по преобладающим анионам и катионам, но и соотношение между ними. Минерализация и химический состав подземных вод зависит от сочетания ряда факторов: происхождения вод, взаимодействия подземных вод с вмещающими породами, условий водообмена. Рассмотрим влияние этих факторов.
Воды, фильтруясь через толщи пород, растворяют их, обогащаясь рядом элементов. Так при растворении соленосных толщ сложенных галитом (NaCl) воды приобретают хлоридный натриевый состав; при фильтрации через известняки — гидрокарбонатный кальциевый и т.д. Условия водообмена определяют интенсивность участия подземных вод в гидрологическом цикле.
В этой статье мы рассмотрели тему Химический состав подземных вод. Далее читайте: Минеральные воды. источник Формула Курлова, название воды. Графические изображения химического состава подземных вод. 1. Пересчет результатов химических анализов.Для выяснения количественных соотношений между ионами данные химических анализов, выполненные химической лабораторией, должны быть представлены в миллиграмм-эквивалентной форме, т.к. ионы в растворе реагируют между собой в эквивалентных количествах. Пересчет из ионной формы, выраженной в мг/л в моль-экв, осуществляется делением числа кг каждого иона на его эквивалентный вес (ионный вес, деленный на валентность) или умножением на пересчетный коэффициент. Наиболее просто находить моль-экв.. пользуясь пересчетной таблицей. Na(мг/л)* К=Na моль- экв,. где Кпересчетный коэффициент. 2.Пересчет результатов анализов. Пересчет результатов анализов заканчивается выражением его в процентах моль-эквивалентов. Для этого принимают каждую из вычисленных сумм мг/экв. катионов и анионов за 100% и по формулам x = определяют процентное содержание каждого из катионов и анионов в отдельности. Все данные записывают в соответствующую ведомость химических анализов. Ведомость химических анализов. Содержание воды. | ||
| мг/л | моль-экв/л | моль-экв% |
| Катионы | ||
| Сумма | ||
| Анионы | ||
| Сумма |
1. Вычисление видов жесткости. Жесткость воды обуславливается присутствием в воде ионов кальция,железа, алюминия, марганца, бария, стронция. Для вод , используемых в хозяйственных и технических целях, жесткость воды не учитывать нельзя. Жесткая вода требует больше мыла для получения пены, в ней медленнее развариваются овощи, мясо, образуется накипь на стенках труб и паровых котлов, что уменьшает теплоотдачу и требует большего потребления тепла. Различают жесткость воды общую, временную (устранимую, карбонатную) и постоянную (неустранимую, остаточную).
Общая жесткость определяется суммарным содержанием в воде иона Ca** и Mg**, так как содержание других элементов в воде ничтожно мало. Величина карбонатной жесткости соответствует количеству иона НСО 
Эта величина является расчетной и определяется по количеству ионов Са** Мg**, связанных с ионами НСО 



Временную жесткость определяют ионы Са** и Мg**, осаживающиеся при кипячении воды в виде карбонатов вследствие разрушения гидрокарбонат – иона.
Постоянную жесткость определяют ионы Са** и Мg**, остающиеся в воде после кипячения. Это есть разность между общей карбонатной жесткостью (в моль-экв).
Жесткость воды О.А.Алекин рекомендует следующее подразделение подземных вод по степени жесткости.
Классификация подземных вод по величине жесткости.
Для питьевых целей большей частью используются подземные воды с общей жесткостью до 7 моль-экв/л (около 20 нем. град.), но в некоторых местностях для питья потребляются и более жесткие воды.
2. Для наглядного изображения химического состава можно применять запись в виде формулы Курлова. Эта запись имеет структуру в виде дроби. В числителе в убывающем порядке (по абсолютному содержанию в % экв) записываются анионы, а в знаменателе в таком же порядке – катионы. Слева от дроби в кг/л становится газовый состав (СО 






[CO 





В наименование состава воды включаются анионы и катионы, содержание которых превышает 25%-экв, название включает и специфические элементы, а также газовый состав.
Основные ионы Курлов М.Г. предлагает назвать в убывающем порядке, причем, первыми называются анионы, а вторыми , в таком же порядке – катионы. В приведенном примере название состава воды, выраженной формулой Курлова, будет борная, углекислая, железистая, фтористая, хлоридно- сульфатная натриево-магниевое.
Как видно из указанного примера, основные ионы определяют химический состав воды, а газовый и специфические элементы – специфическое содержание. При составлении химического названия воды необходимо соблюдать элементарные правила русского языка, согласно которым основное прилагательное пишется полностью а прилагательное, указывающее на второстепенное свойство предмета, пишется сокращенно. Если в химическом составе воды преобладают анионы хлоридный и сульфатный, причем сульфатного больше, чем хлоридного, то воду следует называть хлоридно-сульфатной, а не сульфатно-хлоридной.
Приведем два примера. Химический состав вод изображен в виде формул Курлова, причем скобками второстепенные ионы отделены от главных.
Здесь мы имеем пресную, гидрокарбонатную магниево-кальциевую воду с повышенным содержанием сульфатов. По классификации О. А. Алекина, данная вода принадлежит к гидрокарбонатному классу, группе кальция и магния и второму типу (CII Ca , Mg 0.4).
Вода солоноватая, сульфатно-хлоридная магниево-натриевая.
Как установлено, ионная форма свойственна в полной мере лишь водам низкой минерализации. При увеличении концентрации растворенных солей между ионами усиливается взаимодействие, причем развивается процесс, обратный диссоциации, т. е. ассоциация. В растворе образуются ассоциированные пары: нейтральные ( СаSО4 0 , МgSО4 0 , СаСО3 0 ) или несущие заряд (Mg(HCO3)2 Са(НСО3)2 + ).Ввиду сложности химического состава природных растворов во многих случаях нельзя предугадать, какие соли в каком порядке будут выпадать из данного раствора, так как на ход кристаллизации влияет температура и другие факторы. Поэтому наши пересчеты из ионной в солевую форму принято называть гипотетическими. При оценке питьевых, лечебных, технических и других качеств воды полезно принимать во внимание не только абсолютное содержание отдельных ионов, но
и предполагаемые ассоциации анионов с катионами (соли). Изображение химического состава вод в виде солей следует рассматривать как очень удобную рабочую гипотезу, позволяющую лучше разобраться в химических свойствах и происхождении природных вод.Пересчет из ионной формы в солевую производится в соответствии с растворимостью солей. В первую очередь комбинируются малорастворимые, а затем все более и более растворимые.
Простейшим для изображения единичных анализов является график-прямоугольник химического состава воды. График строится в виде двух прямоугольников, на одном из которых в масштабе нанесены %-эквиваленты анионов, на другом %-эквивалента катионов в последовательности, определяемой правилом Фрезениуса, т.е. в порядке их химической активности: К*, Na*, Mg**, Fe, Mg, H, NO , Cl, Br, I, SO, НCO, CO, OH. .
Графически изображать единичные анализы можно также с помощью круглой диаграммой Н.И.Толстихина.
Горизонтальной линией круг делится на две части. В верхней части по секторам откладываются в масштабе катионы слева направо в обратном порядке , чем на прямоугольной диаграмме, а в нижней — в таком же порядке анионы. Диаметр круга в масштабе отвечает минерализации воды, точно также и ширина прямоугольной диаграммы в масштабе соответствует величине минерализации воды.
Классификация Алекина О.А. сочетает принцип преобладающего иона и соотношение между ионами. За основу взято шесть главных иона (3 катиона, 3 аниона), содержание которых выражено в моль- эквивалентах:
По преобладающему аниону воды подразделяются на три класса: гидрокарбонатные и карбонатные (НСО 

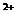
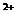


Каждая группа по соотношению между ионами подразделяются на три типа. Всего выделено четыре типа:
I) НСО 

II) НСО
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студента самое главное не сдать экзамен, а вовремя вспомнить про него. 9620 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Тел: +7 (495) 728-94-19
Тел: +7 (963) 659-59-00
Москва, Олонецкий пр. д. 4/2
выполняем работы по г. Москве
и всей Московской области
Геология
Грунтовая лаборатория
Грунтовая лаборатория
Оснащенность лаборатории
Область аккредитации
Типы исследуемых грунтов
песчаные грунты
глины, суглинки, супеси
заторфованные грунты
техногенные грунты
Механические свойства грунтов
испытания грунтов на срез
компрессионные испытания
трехосное сжатие
свободное набухание
Физические свойства грунтов
гранулометрический состав
природная влажность
показатель текучести
предел пластичности
пористость, коэфф. пористости
определение плотности грунта
Химический анализ
химанализ водной вытяжки
коррозийная агрессивность
Библиотека
ООО «Буровики»:
Контакты
Рекомендательные письма
Допуски и Лицензии
Цены и сроки, прайс лист
Написать письмо
1 400 рублей за метр. Подробнее
Почему стоит заказать именно у нас
Грунтовые воды относятся к разновидностям подземных вод, которые залегают на водоупоре, расположенном ближе к поверхности. На территориях с влажным климатом происходит развитие интенсивных процессов инфильтрации, а также подземного стока, что приводит к выщелачиванию грунтов и горных пород. В некоторых случаях происходит излишнее их испарение, что приводит к засолению почвы. Поэтому стандартный анализ грунтовой воды, когда выполняются инженерно-геологические изыскания для проектирования зданий (сооружений), считается обязательным.
Стандартный анализ грунтовой воды выполняется в условиях лаборатории для получения показателей минерализации образца, его жесткости, агрессивности по отношению к различным материалам строительства (в первую очередь к стали, бетону и алюминиевым оболочкам кабелей), электропроводность и т.д. Минерализацией следует считать сумму всех минеральных веществ, которые растворены в грунтовой воде. Данный показатель получается методом выпаривания исследуемого образца. Следует различать такие степени минерализации грунтовых вод:
Жёсткость грунтовой воды определяется исходя из наличия ионов кальция и магния. Эти химические показатели важны при бурении скважин для поиска пресной воды населению. Также под застройку домов (коттеджей, сооружений) геология участка исследуется на показатель чистоты и безопасности для проживания в данной местности. А, как известно грунтовые воды являются главными показателями чистоты грунта.
Проводя инженерные изыскания на отводимом участке (площадке) важно учитывать фактор агрессивности грунтовых вод. Грунтовые воды могут оказывать разрушающий эффект для бетона и других строительных материалов. Для этого в условиях лаборатории стандартный анализ грунтовой воды выполняется также для получения показателя агрессивности. Агрессивность грунтовых вод бывает таких типов:
- выщелачивающая;
- общекислотная;
- сульфатная;
- магнезиальная;
- углекислотная
СП 11-105-97 Часть I. Общие правила производства работ Приложение Н (обязательное)
Показатели химического состава подземных и поверхностных вод
и методы их лабораторных определений при инженерно-геологических изысканиях
Показатели химического состава воды
Коррозионная активность воды к оболочкам кабелей
Метод испытания или обозначение государственного
стандарта на методы определения
температура в момент взятия пробы, °С
вкус и привкус при температуре 20 °С
Примечание — При проведении комплексных изысканий состав определяемых компонентов следует устанавливать с учетом требований СП 11-102-97
Результаты анализа грунтовой воды позволяет определить уровень ее рН. Если он пребывает ниже уровня нейтрального значения, которое составляет 7 единиц, то вода является кислотной. В таком случае она может разрушать бетон, вне зависимости от того, какого типа портландцемент использован в нем. Степень разрушения также зависит от вида и концентрации кислоты, возможности непрерывного обновления кислоты, скорости течения и давление грунтовой воды на бетон, расхода цемента, непроницаемости бетона и типа заполнителя.
Сама по себе величина рН является определяющим фактором вида или концентрации присутствующей кислоты, ведь это всего лишь мера степени кислотности. В качестве предварительных данных измерения рН очень полезны и позволяют получить представление о наличии или отсутствии кислот. Однако в большинстве случаев необходимым является проведение химического анализа, при котором определяется характер и концентрация кислоты. Как правило, кислотность естественных грунтовых вод, которые имеют низкий рН, вызвана органическими кислотами и растворенной углекислотой, а также, в отдельных случаях, сернистой и серной кислотой, которая поступает из соединений серы в торфяных грунтах. По мере увеличения интенсивности агрессивного воздействия можно повышать качество бетона, например, увеличивать расход цемента с более низким водоцементным отношением.
В зависимости от типа агрессивности грунтовых вод проектировщик принимает решения по выбору материала для строительства строения, а также глубины фундамента.
Анализ грунтовой воды необходим для получения детальной информации об участке исследований. Зная особенности данной жидкости можно своевременно предотвратить неприятные последствия: разрушение, усадка фундамента, трещины на здании, сезонное подтопление и т.д. Для этого проектировщики на первоначальных стадиях проектирования объекта планируют защитные мероприятия (дренажную систему), а также по возможности выбирают более подходящий для данной среды тип фундамента. Для зданий, не имеющих подвальных помещений и при высоком уровне грунтовых вод достаточно просто изолировать стены строения от влаги (не дать возможности поднятию уровня грунтовых вод по стенам). В некоторых случаях выполняют гидроизоляцию фундамента. В любом случае, необходимо учитывать тот факт, что грунтовые воды неблагоприятно влияют на строение в разные времена года (особенно зимой и во время таяния) и заранее принимать меры по их устранению.
источник
Рубрика: Науки о Земле
Научный журнал «Студенческий форум» выпуск №13(13)
Анализ химического состава подземных вод в районе рудника «Мир»
Подземные воды при отработке рудника «Мир» в гидрохимическом отношении претерпевали неоднократные изменения, однако с 1993г. и по настоящее время гидродинамический режим соответствует промышленным закачкам в водоносный комплекс. C 1993г. действует система обратной закачки СОЗ для рудника Мир и с 1995г. постоянно ведется мониторинг, за химическим анализом на объекте СОЗ. По результатам мониторинга за последние 23 года были проанализированы значения изменений минерализации и основных макрокомпонентов. На сегодняшний день можно сказать, что : во-первых — годовые колебания амплитуды минерализации достигают 82 г/л, а во-вторых — сезонные колебания минерализации до 35 г/л, а в-третьих, среди макрокомпонентов первые места занимает — хлорид и натрий ион.
Динамика изменения содержаний макроэлементов представлена на графиках 1, 2 и 3 [3,7].
Рисунок 1. Динамика изменения содержания ионов хлора, натрия и калия в закачиваемых водах СОЗ
Рисунок 2. Динамика изменения содержания ионов магния и гидрокарбонат-ионов в закачиваемых водах СОЗ
Из представленных графиков можно сделать вывод, что содержание макрокомпонентов постоянно колеблется, соответственно и минерализация тоже, но при этом химический тип вод остается неизменным.
Рисунок 3. Динамика изменения содержания ионов кальция и сульфат-ионов в закачиваемых водах СОЗ
Отдельно стоит отметить период с начала 2008 г., так как с этого года начинает работать шахтный водоотлив рудника. С этого года дренажные воды рудника «Мир» начали сбрасываться в карьер и далее, смешиваясь с водами карьера в накопитель минерализованных вод. Это означает, что в процесс изменения состава закачиваемых вод СОЗ вошла новая составляющая: более минерализованные и имеющие несколько отличный состав относительно вод метегеро-ичерского горизонта – внутриформационные воды чарской свиты. Результат привноса данных вод прослеживается при приближенном рассмотрении динамики изменения состава. Особо стоит отметить изменение и появление динамики увеличения содержания сульфат-иона [6].
Рисунок 4. Динамика изменения содержания сульфат-ионов в закачиваемых водах СОЗ в период с 2008г
Увеличение содержания сульфат-иона в водах накопителя имеет крайне негативные последствия для эксплуатации объекта СОЗ, так как при отрицательной температуре образуются мирабилит и криогалит [2].
Мирабилит — минерал, водный сульфат натрия. Химический состав: Na2О — 19,3 %, SО3 — 24,8 %, Н2O — 55,9 %. Это типичный осадочный хемогенный минерал, кристаллизующийся обычно из рассолов озёрного или морского происхождения при температуре ниже 20-25°С. Происхождение экзогенное — выпадение из естественных рассолов в соляных озерах в зимнее время года при температуре ниже 6°.
Криогалит — минерал, водный хлорид натрия. Химический состав: H2O -61-78% , NaCl — 23-39% .Температура образования: -21,9° С. Данный минерал является эвтектической смесью гидрогалита и льда. В связи с тем, что криогалит в обыкновенных условиях не сохраняется, он изучен слабо [5].
Данная проблема актуальна на сегодняшний день, так как отложения солей выводит из строя насосы и засоряет из строя трубы объекта СОЗ, следовательно и весь накопитель прекращает работу. В свете актуальности проблемы солеотложения в оборудовании СОЗ сотрудниками АК «АЛРОСА» были проведены работы по опробованию накопителя и в последствии выполнена обработка результатов [4,6,7].
На сегодняшний день главной гипотезой образования солей в трубах и насосном оборудовании, является суждение о сбросе в накопитель рудничных вод. Приток к подземному руднику формируется за счет перетекания сквозь предохранительный целик вод из внутрикарьерного пространства и потока из более глубоких горизонтов. В свою очередь химический состав рассолов, перетекающих в подземный рудник через целик, формируется в результате смешения рассолов метегеро-ичерского горизонта с атмосферными осадками, растворение солей в блоке № 1 и последующим взаимодействием с солями и засоленными породами, складированными во внутрикальерном отвале [4].
Рисунок 5. Образование корок и налетов солей в трубах и насосах в зимнее время года
Поскольку конечной точкой пути всех дренажных вод является их сброс в накопитель, то анализ и сравнения будут проводиться именно с ним.
Таблица 1
Данные по химическому составу рассолов на сбросе в накопитель
источник
Полезные, либо вредные свойства воды и ее пригодность для использования человеком можно определить исходя из рассмотрения растворенных в воде химических элементов и соединений.
Такое содержание в количественном выражении определяют в процессе выполнения химических анализов. Анализы подразделяют на общий анализ и специальные виды анализа.
Общий анализ , который также известен как стандартный, либо шестикомпонентный анализ, включает определение шести основных ионов: Cl — , SO 4 2 – , HCO 3 – , Ca 2 + , Mg 2 + , Na + , минерализации, плотности и рН воды.
Специальные виды анализа разнообразны. Их вид зависит от поставленной задачи. В поисковой нефтяной гидрогеологии, выполняют часто определение содержания J , Br , аммония, органических соединений, а также газовый состав, содержащийся в пробах воды.
Санитарный анализ выполняют чтобы определить пригодна ли вода в качестве питьевой, а также удовлетворяет ли она требованиям к воде для бытового использования. При этом определяют содержание ионов NH 2 + , NO 2 – , NO 3 – и окисляемость воды. В ряде случаев выполняют бактериологический анализ.
Бальнеологические анализы выполняют с тем, чтобы определить лечебные свойства воды. Как правило, такие анализы включают расширенный список дополнительных элементов, таких как определение содержания сульфидов, железа, мышьяка, лития, радиоактивности (например, содержание радона) и газовой составляющей.
Технические анализы выполняют с целью определить степень пригодности воды для технических нужд, таких как – для закачки вод в нефтяные пласты для вытеснения нефти, в котельных – для питания паровых котлов, для оценки других коррозионных (агрессивных) свойств воды.
На практике используют следующие формы отображения: весовая ионная, эквивалентная и процент-эквивалентная формы.
Весовая ионная форма – это выражение состава воды в виде весового количества отдельных ионов. При этом, содержание ионов (в миллиграммах, либо граммах) в единице объема, либо единице массы (обычно в 100 см 3 , 1000 см 3 , 100 г, 1 кг).
Если для пресных вод не имеет решающего значения, в каких единицах приведено это выражение, то для рассолов есть различие. Для выражения содержания растворенных газов в ряде веществ, находящихся в коллоидном состоянии, весовая ионная форма не используется.
Эквивалентная форма более точно учитывает химические свойства воды, позволяет контролировать точность результатов анализа и вычислять содержание ионов натрия и калия без прямого их аналитического определения.
Ионы, содержащиеся в растворе, реагируют между собой в количествах, определяемых весом и валентностью ионов (другими словами – в эквивалентных количествах). Как известно, эквивалентный вес (эквивалент) иона — это частное от деления ионного веса на его валентность. Так, эквивалент иона Са 2+ равен 20 (40 : 2), а эквивалент иона SO 4 2 – , — 48 (96 : 2), или 20 весовых единиц иона Са 2+ соответствует 48 весовым единицам иона SO 4 2 – .
Весовую ионную форму переводят в эквивалентную форму путем деления содержания ионов ( в мг, или г) на величину эквивалента иона. Можно также умножить содержание иона в весовой форме на коэффициент реакции (являющийся обратной величиной эквивалента этого иона).
Наличие перед химическим символом иона буквы r (например, r Na + , r Cl – и т.д.) показывает, что содержание этого элемента выражено в эквивалентной форме.
Если же анионы и катионы даны в эквивалентной форме, то исходя из принципа электронейтральности раствора сумма анионов (Σ r a ) должна быть всегда равна сумме катионов (Σ r к)
Тогда всегда можно определить содержание одного из шести ионов, если известны содержания других пяти. Тк, например иногда определяют содержание Na + :
rNa + = (rCl – + rHCO3 – + rSO4 2 – ) – (rCa 2+ + rMg 2+ ).
Чтобы определить содержание Na + в весовой ионной форме, полученную величину rNa + умножают на его эквивалент.
Процент-эквивалентная форма является модификацией эквивалентной формы и характеризует относительную долю каждого иона в общей сумме растворенных ионов, равную 100 %. Здесь сумма катионов и сумма анионов составляют по 50 %. Иногда принимают за 100 % сумму катионов (равной сумме анионов), при этом общее содержание ионов будет 200 %.
Содержание каждого иона в процентах от суммы всех ионов дает процент-эквивалентную форму отображения ионно-солевого состав воды.
Составив пропорции, где сумма всех ионов в эквивалентной форме равна (100% (или 200%), находим процентное содержание всех ионов последовательно:
Где Σ(а +к) – сумма ионов и катионов в эквивалентной форме; i – содержание искомого иона в эквивалентной форме; x – содержание искомого иона в процент-эквивалентной форме.
Заметим, что процент-эквивалентная форма не учитывает минерализацию воды. Это дает возможность сравнивать химический состав вод независимо от их степени минерализации.
В гидрогеологии используют три рассмотренные формы. Кроме того, чтобы кратко изобразить химический состав воды используют формулу М.ГЭ. Курлова. Она представляет собой сложную дробь. В числителе указывают содержание анионов, а в знаменателе – катионов в процент-эквивалентной форме. Ионы записывают по убывающим величинам. Перед дробью перечисляют основные компоненты состава растворенных газов и величину минерализации (г/дм 3 ). За дробью приводят температуру, рН, содержание микрокомпонентов состава.
При этом, можно сказать, что состав воды следующий: сероводородная соленая вода гидрокарбонатно-хлоридного магниево-кальциево-натриевого состава имеет температуру 35 ˚С, слабощелочная, содержит йод (7.9 мг/дм 3 ) и бром (25 мг/ дм 3 ).
Ранее применяли характеристику Пальмера для определения характеристики воды нефтяных месторождений. Это определение воды по содержанию в ней тех или иных групп солей. Последние сочетаются из ионов по правилу Фрезениуса, утверждающей о том, что ионы соединяются между собой в порядке уменьшения химической активности. Последовательность степени активности основных ионов следующая: анионы – Cl – , SO 4 2– , HCO 3 — , катионы – Na + , Mg 2+ , Ca 2+ .
Ионы Br — , J — располагаются за ионом Cl — ; ионы H + , Fe 3+ , Al 3+ — после иона Ca 2+ ; ион HS – — после HCO 3 – ; ион K + — перед Na + ; ион NH 4 + — после Na + .
В соответствии с формулой Фрезениуса ион Cl – соединяется с ионом Na + , при избытке хлора его остаток затем соединяется с магнием, а в случае преобладания над ним – с кальцием; при избытке же натрия, его остаток соединяется с сульфат-ионом. Если натрий преобладает над сульфатом, то он (натрий) соединяется с гидрокарбонатом.
Пальмер выделил шесть солевых характеристик. Основное значение имеют: первая соленость ( S 1), вторая соленость ( S 2), первая щелочность (А1) и вторая щелочность (А2).
Графические методы изображения состава вод применяют для наглядного сравнения состава различных вод, а также – на картах и разрезах.
График Толстихина имеет круговую форму. Он используется для изображения состава отдельных проб воды в процент-эквивалентах. При этом, минерализация воды соответствует в выбранном масштабе радиусу круга. Он используется для вынесения единичных проб воды на карты. С его помощью можно изображать и состав растворенных и свободных газов.
График Роджерса представляет собой 3 столбика одинаковой высоты. В крайних столбиках расположены ионы в порядке убывания их химической активности – левый столбик соответствует суммарному содержанию анионов, а правый – катионов. Вся высота столбика соответствует 50%-экв. Средний столбик отображает характеристику Пальмера. Его высота равна 100%-экв. Таким образом, график Роджерса изображает состав воды в процент-эквивалентной форме и позволяет легко графически находить характеристики Пальмера.
Метод «узоров» Стиффа. Он заключается в том, что содержание главных ионов (в миллиграмм-эквивалентной форме) откладывается в масштабе от общей оси. Концы отрезков, соединенных ломаной линией, образуют узор. От этого произошло его название.
Полулогарифмическая диаграмма Шеллера – это график, по оси абсцисс которого отложены ионы, а по оси ординат – их содержание в миллиграмм-эквивалентах (в полулогарифмическом масштабе). Удобство заключается в том, что на одну диаграмму наносят ряд анализов воды, что позволяет сравнивать их между собой.
Наконец, любая гидрохимическая карта также представляет собой графическое изображение химического состава подземных вод.
источник
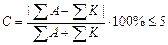

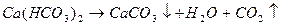
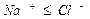
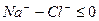
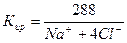
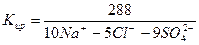

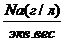 =Na моль-экв. или
=Na моль-экв. или А – 100%
А – 100% = Cl%
= Cl%


