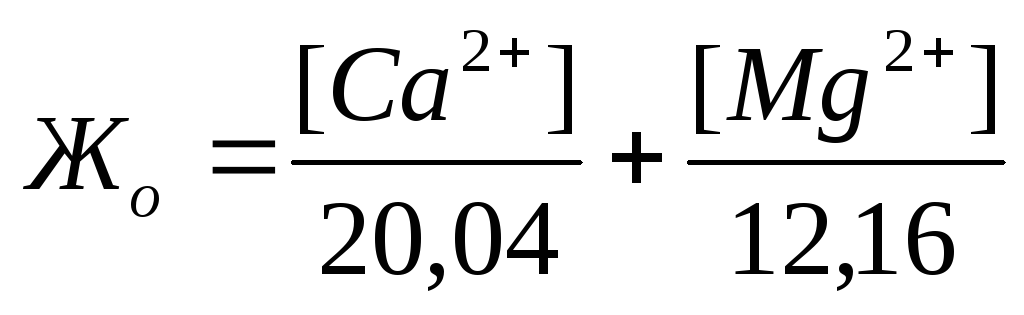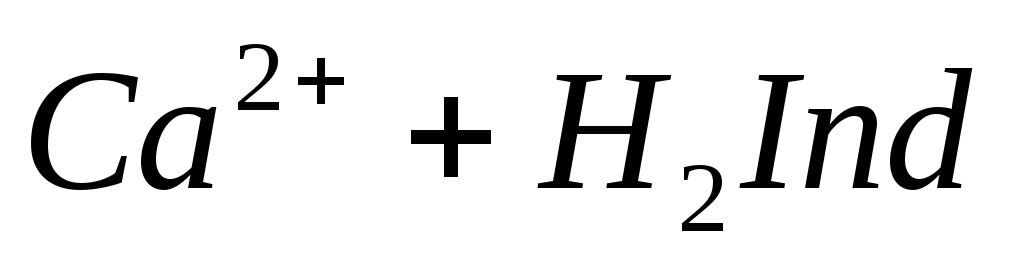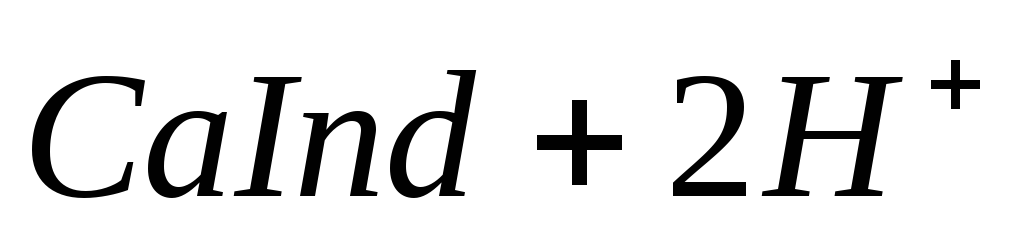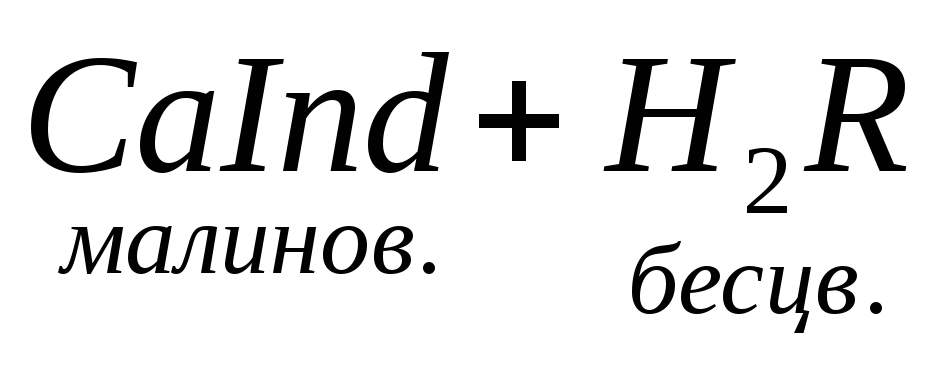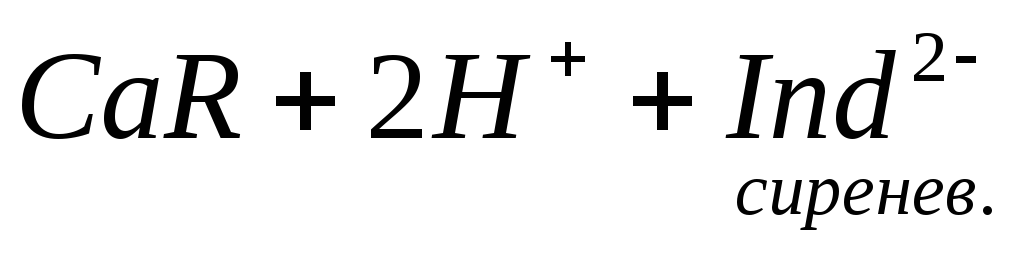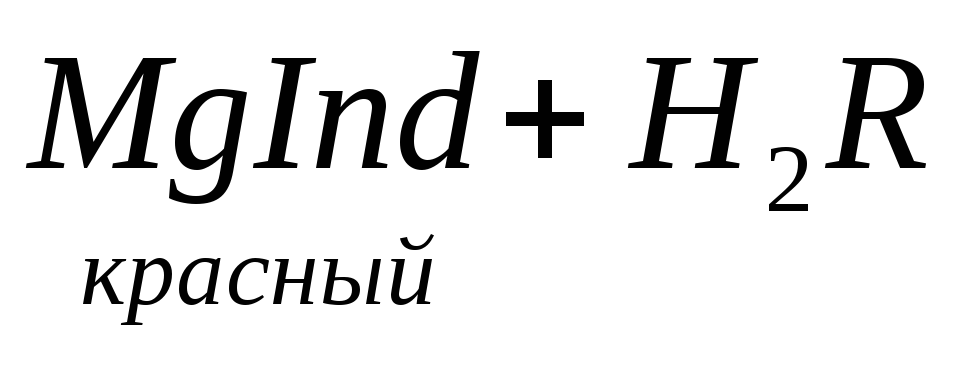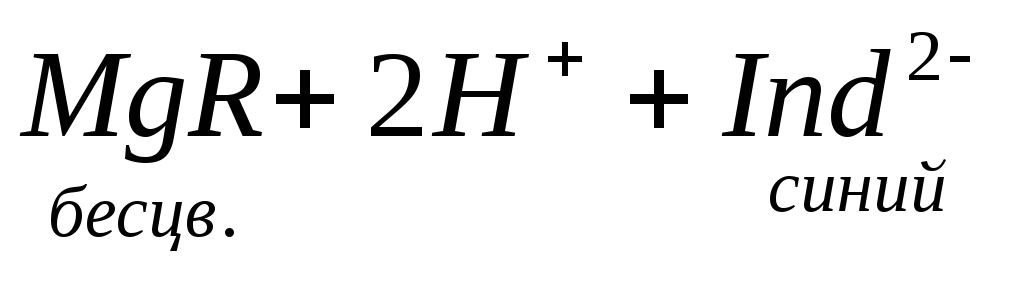Ежедневно человек впивает больше 2 литров воды в сутки. Многие даже не задумываются про ее качество. А именно от него зависит здоровье организма. Только малая часть население страны знает, что воду можно сдать на анализ и узнать ее развернутый состав. Следует задуматься, какую воду человек употребляет и как это влияет на его здоровье.
Анализ питьевой воды является точным определением ее состава по заданным компонентам: биологические и химические. Стандартный анализ включает в себя 9 главных показателей питьевой воды. При желании, можно провести подробное исследование качества воды по 40 критериям. На территории России анализ воды проводится всеми лабораториями, получившие аккредитацию Госстандарта. Результаты выдаются в форме официального заключения. Только анализ питьевой воды поможет правильно выбрать тип очистительной системы, что бы минимизировать влияние вредных факторов на здоровье человека. В официальном заключении обязательно будет указано значение рН, количество железа и хлора, степень жесткости, содержание нитратов, тяжелых металлов и других вредных элементов.
ВОЗ сообщила следующую статистику. В воде содержится более 13 000 токсичных веществ. Каждый год эта цифра увеличивается на 0,5-1 тысячу. Это связано с активной деятельностью человека по синтезированию новых химических веществ.
Большинство клиентов лабораторий, которые проводят анализ воды, задают один и тот же вопрос: «Безопасно ли употреблять прошедшую анализ воду в пищевых целях?». Многие даже не имеют представления об основных показателях качества. Условно их разделяют на несколько групп:
- органолептические: мутность, цвет, вкус и запах;
- токсикологические: содержание пестицидов, фенолов, мышьяка, свинца, алюминия;
- паразитологический;
- химические вещества, попавшие в процессе обработки воды: серебро, хлороформ, хлор;
- радиационный контроль: активность альфа и бета частиц
- микробиологический состав: ОМЧ, E.coli;
- вирусологический;
- показатели, изменяющие свойства воды: железо, сульфиты, марганец, кальций, магний, нефтепродукты, жесткость, рН.
Определенные территории характеризуются своим набором загрязнений. К примеру, в Московской области увеличено содержание органики, магния, марганца, железа, фторидов, сульфидов и др.
Опытным путем было выявлено, что человек предпочитает употреблять более жесткую воду. В исследованиях принимали участия люди с разных регионов, в том числе и тех, где вода более мягкая. Даже длительное употребление хлоридно-сульфатной воды (мягкой) не препятствовало большинству людей выбрать по вкусу гидрокарбонатную воду с солями кальция и магния.
Некоторые компоненты не только ухудшают пищевые качества воды, но и являются вредными для человеческого организма.
Железо в воде находится в составе сульфатов, гидрокарбонатов, хлоридов и органических соединений. Так же может присутствовать в виде высокодисперсной взвеси, которая придает воде коричневый с красным оттенком цвет и снижает вкусовые качества. Благодаря высокой концентрации железа в ней развиваются железобактерии и образуются различные засорения водопроводных труб. Допустимая концентрация железа в питьевой воде – 0,3 мг/л. Большая его концентрация вызывает болезни печени, аллергию и т.д.
Марганец является виновником генетическим мутаций. Вода обладает неприятным вкусом, а на оборудовании и белье образуются пятна. Он так же способствует отложения осадка в сантехническом оборудовании. Допустимая концентрация – 0,1 мг/л. Однако даже при количестве марганца 0,02 мг/л в воде приводит к образованию пленки на трубах и черного осадка.
Катионы марганца и кальция делают воду более жесткой. Существуют различные единицы ее измерения. Наиболее распространено – мг-экв/л. Оптимальное значение жесткости воды – 3-3,5 мг-экв/л. При значении 4,5 мг-экв/л накапливается осадок на сантехническом оборудовании и нагревательных элементах бытовых приборов. В инструкции большинство бытовых приборов рекомендуют использовать воду до 2 мг-экв/л. Для человека жесткая вода является вредной. начинают накапливаться соли , что приводит к болезням суставов и образованию камней.
Перманганатная окисляемость указывает на количество кислорода к концентрации иона перманганата необходимого для окисления воды. Допустимое значение – 5 мг О2/л. по ней можно судит о содержании органики в воде и окисляемых неорганических веществ. При высоком значении перманганатной окисляемости страдают почки, печень и репродуктивная функция, нервная и иммунная системы человека. Не рекомендуют употреблять воду без обработки при значении перманганатной окисляемости выше 2 мг О2/л.
Сульфиды являются виновниками посторонних запахов в воде. Трубы начинают подвергаться коррозии, а в воде увеличивается содержание серобактерий. Сероводород ядовит для человека. Он оказывает токсичное действие и раздражает кожу.
Концентрация фторидов не должна превышать 1,5 мг/л. Однако организм нуждается во фторе. Для профилактики флюороза в некоторой местности происходит искусственное обогащение воды фтором. Рекомендуемое количество – 0,7-1,5 мг/л.
Низкая минерализация питьевой воды (до 50 мг/л) приводит к нарушению водно-солевого обмена и дисфункции желудка. К тому же такой водой нельзя полностью утолить жажду.
Малые концентрации тяжелых металлов вредят различным органам: свинец – нервной и кровеносной системе; кадмий и хром приводят к заболеванию почек; медь опасна для желудочно-кишечного тракта; ртуть разрушает центральную нервную и кровеносную системы, цинк вредит двигательному аппарату, особенно мышцам и т.д.
Соединения азота, в том числе нитраты могут быть природного происхождения. Но большая часть является результатом хозяйственно-бытовой деятельности человека. Большое содержание нитратов в воде опасно для детей. Детский цианоз – изменение формы гемоглобина, который не может переносить кислород к клеткам органов.
Перечисленные компоненты не являются сильно токсичными, что бы образовалось сильное отравление. Однако постоянное употребление малых количеств этих веществ вызывают патологии в организме из-за хронической интоксикации. Некоторые вещества попадают в организм путем всасывания через кожу во время водных процедур (бассейн, душ).
Научно установлен факт вредности дистилянта в качестве питьевой воды.
Он плохо утоляет жажду. Его большое количество вредит пищеварительной системе. В дистилянте отсутствуют минеральные вещества, которые являются важными составляющими человеческого организма.
Как упоминалось в начале статьи, существует большое количество потенциально опасных химических веществ в воде. Сегодняшние лаборатории определяют только 10 % всех нормированных веществ. Даже эта малая доля всех примесей требует наличие определенного оборудования, реактивов, технического потенциала и много времени. Определение токсичных соединений с низким ПДК с каждым годом становиться более затратным и сложным.
Определенные вещества могут быть в допустимом диапазоне. Но при их взаимодействии с другими вещества образуются токсичные соединения.
Следует контролировать не только структурный состав воды, но и интегральный функциональные характеристики.
Современные аттестованные метрологические приборы разработаны только для наиболее распространенных химических показателей. Бактериальный состав определяется в лабораториях, что позволяет говорить про их надежность. Но их трудно использовать в полевых условиях.
Существует 3 вида анализа воды:
- сокращенный;
- полный химический;
- определение отдельных составляющих.
Для оценки качества бывает достаточно и сокращенного анализа, но некоторые случаи требуют дополнительного определения компонентов или полный анализ.
Для ускорения и удешевления контроля качества воды прибегают к экспресс анализу воды, который определяет обобщенные показатели. Наиболее частыми определяемыми показателями являются:
- биохимическое потребление кислорода (растворимого органического углерода);
- количество адсорбируемых или экстрагируемых галогенов органического происхождения;
- рН;
- органолептические свойства воды.
Экспресс анализ значительно сокращает потребность в оборудовании и реактивов. Например, тяжелые металлы определяют с помощью атомно-эмиссионной спектроскопии, которая выявляет только наличие, а не количество.
Экспресс анализ не гарантирует высокое качество исследований.
Наиболее сложным является определение бактериального и вирусного состава.
Сегодня наиболее популярны лазерные системы для микробиологического исследования.
Растет использование сенсоров – чувствительных элементов. наиболее распространены биосенсоры, которые распознают многие компоненты индивидуально. Они лежат в основе работы многих многокомпонентных анализаторов.
Сенсоры используются в экспрессных тест-системах. Берется проба воды и вводится в систему. Тест-система регистрирует изменение оптических свойств. Так определяют содержание ферментов антропогенного происхождения и патогенную микрофлору.
Сегодня экспресс анализ питьевой воды проводится следующими методами:
- флюорометрия;
- фотометрия;
- газовая хроматография;
- атомно-абсорбционная спектрофотометрия;
- кондуктометрия;
- нефелометрия;
- турбидиметрия;
- спектрофотометрия;
- потенциометрия;
- титрометрия
Биотестирование определяет токсичность определенного химического вещества на водные организмы или биоценоз. Оценочными критериями являются:
- активность микроорганизмов;
- их выживаемость;
- скорость размножения и т.д.
Этот метод экспресс анализа требует определенных условия: освещенность, температура, кислотность, состав и др.
Есть множество других быстрых и простых способов определения качества питьевой воды: используя органы чувств, отстаивание, попробовать на вкус и т.д. Однако оценка может носить субъективный характер и иметь большую вероятность ошибки. Единственный надежный способ – анализ питьевой воды в лабораторных условиях.
источник
Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
состав растворенных газов.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей.
Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или
12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO32 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO32 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общаяжесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам:
Общая жесткость
Карбонатная жесткость равна концентрации (мг/л) [HCO3– ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:
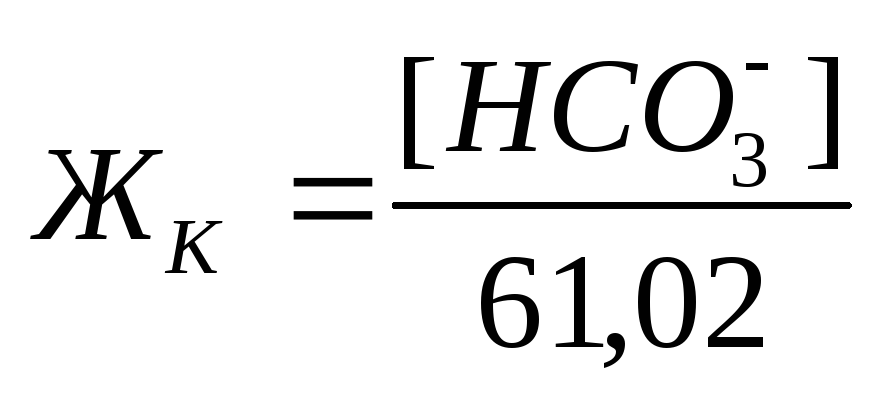
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК= ЖО– ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Окисляемость характеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества.
Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме
требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л.
При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Определение иона Cl – . В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO42– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO42– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO42– .
Определение ионов CO32– и HCO3– . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии.
Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO32 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО32– и НСО3– , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния:
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)
N
образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет.
Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:
Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна:
С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка.
Растворенные в воде газы определяют химическими методами или газовой хроматографией.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
Определение растворенного кислорода производится йодометрическим методом.
Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом:
Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе:
Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия:
I2+ 2Na2S2O3
Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II):
Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску.
В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания.
Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом.
В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом:
К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе.
источник
Качество потребляемой человеком воды определяется с учетом ее свойств и состава. Данные показатели также определяют пригодность применения воды в тех или иных сферах жизнедеятельности. Нормативы (или стандарты) качества составляются с учетом требований заказчика и основных характеристик. Во многом содержание воды определяется с учетом источника ее происхождения (он может быть антропогенным либо естественным).
Чистая питьевая вода – залог здоровья человека и его отличного самочувствия. Чтобы понять, является она такой или нет, обращайтесь в специализированные инстанции, которые проводят анализ качества жидкости и ее соответствия нормативным стандартам, принятым на сегодняшний день. При выполнении анализа учитываются бактериологические, химические и физические показатели.
Проводить химический анализ по закону обязаны различные организации и предприятия при выполнении определенных работ – например, возведении моста через реку. Обязаны соблюдать требования к химсоставу предприятия, которые осуществляют выпуск бутилированной воды. Частные лица заказывают проведение анализа для:
- оценки качества питьевой воды из водопровода, скважин, родников;
- подтверждения качества бутилированной воды;
- подбора фильтра для воды, оценки его эффективности;
- контроля качества воды в бассейнах;
- оценки качества жидкости, используемой для полива растений;
- контроля среды в аквариуме;
- пр.
- щелочность;
- жесткость;
- содержание ионов;
- водородный фактор;
- минерализация.
Бактериологические параметры жидкости:
- степень загрязненности источника кишечной палочкой;
- наличие радиоактивных, токсичных элементов;
- бактериальная зараженность.
Рассмотрим данные характеристики подробнее.
Цветность – показатель, который всегда должен учитываться при анализе воды. Он обуславливает присутствие железа и включений других металлов в виде коррозионных продуктов. Цветность является косвенной характеристикой присутствия в жидкости растворенной органики, зависит от загрязненности источника стоками промышленной категории, определяется путем сравнения образцов с эталонными. Максимально допустимый показатель составляет 20°.
Мутность зависит от наличия мелкодисперсных взвесей нерастворенных частиц. Выражается она в:
- наличии осадка;
- взвешенных, грубодисперсных примесях, определяемых в ходе фильтрации;
- степени прозрачности.
Можно определять мутность фотометрическим путем – то есть по качеству проходящего через толщу жидкости светового луча.
Запах зависит от присутствия в воде пахнущих веществ, которые попадают в нее из стоков. Практически все органические жидкие вещества передают воде специфический аромат растворенных в ней газов, органики, минеральных солей. Запахи делятся на природные (гнилостные, болотные, серные) и искусственные (фенольные, нефтяные, пр.).
Вкус воды может быть соленым, кислым, сладким или горьким, все остальные «нотки» относятся уже к привкусам – например, хлорные, аммиачные, металлические, сладковатые, пр. Оценка привкуса и запаха производится по пятибалльной шкале.
Химические показатели, степень загрязненности зависят от глубины забора водных масс, просачивания в стоки различных веществ (отбросы предприятий, свалки, выгребные ямы и т.д.). Анализ проводить нужно обязательно, поскольку загрязнению подвергаются даже артезианские скважины с низким давлением, а что уже говорить о колодцах.
Жесткость характеризуется наличием в жидкости элементов кальция и магния, которые со временем превращаются в нерастворимые соли. Итог – образование накипи, отложений на внутренних поверхностях емкостей, котлов, рабочих узлах бытовой техники.
Сухой осадок указывает на степень концентрации органических элементов, а также растворенных неорганических солей. Его высокое содержание приводит к нарушению солевого баланса организма человека.
Водородный фактор рН характеризуется щелочным и кислотным фоном жидкости. Изменение фактора указывает на нарушения в технологиях водоподготовки. Норма – 6-9 единиц.
Некоторые компоненты ухудшают пищевые качества воды, а также являются потенциально опасными для здоровья человека. Рассмотрим основные:
- Железо в составе сульфатов, гидрокарбонатов, органических соединений, хлоридов. Может оно присутствовать и в виде высокодисперсных взвесей, придающих жидкости коричневый с красным оттенком цвет, снижающий вкусовые качества. Из-за высокой концентрации железа в воде начинают развиваться железобактерии, образуются засоры труб. Максимально допустимая концентрация железа по нормам составляет 0,3 мг/л.
- Марганец – главная причина генетических мутаций. Элемент оказывает негативное влияние на вкусовые характеристики жидкости, после стирки на белье появляются характерные пятна и разводы, на сантехнике образуется осадок. Максимальная концентрация согласно нормативам – 0,1 мг/л.
- Катионы марганца и кальция повышают жесткость воды. Для измерения их содержания обычно используется такой показатель как мг-экв/л. Пороговые значения находятся на отметке 3-3.5 мг-экв/л, при более высоком содержании катионов накапливается осадок на сантехническом оборудовании, нагревательных элементах бытовых приборов. Для здоровья человека жесткая вода очень вредна.
- Перманганатная окисляемость указывает на количественное содержание кислорода к концентрации иона перманганата, который принимает участие в процессах окисления воды. Предельно допустимое значение составляет 5 мг О2/л. При высоких показателях перманганатной окисляемости страдают почки и печень, репродуктивная функция, иммунная, нервная системы человека. Не рекомендуют употреблять воду без обработки при значении перманганатной окисляемости выше 2 мг О2/л.
- Сульфиды – благодаря им жидкость приобретает посторонние неприятные ароматы, а трубы начинают ржаветь. Именно сульфиды являются токсичными компонентами, вызывающими кожные аллергические реакции.
- Фториды – их концентрация не должна составлять более 1,5 мг/л. Обратите внимание, что полностью лишенная фтора вода также не полезна.
Перечисленные компоненты к сильно токсичным не относятся и отравлений не вызывают, но их постоянное употребление в пищу (даже в малых дозах) наносит непоправимый вред здоровью и приводит к хронической интоксикации.
Определение токсичных соединений, содержащихся в сравнительно небольших количествах, становится с каждым годом все более сложным и затратным. Определенные вещества в воде присутствовать могут, но строго в установленных количествах. Важно контролировать как структурный состав жидкости, так и ее функциональные интегральные характеристики.
Метрологические приборы позволяют определять только основные химические показатели, для проверки бактериального состава образцы отправляются в лаборатории. В зависимости от глубины проверки данных, анализы делятся на полные химические, сокращенные, направленные на определение некоторых составляющих. В большинстве случаев сокращенного анализа достаточно, но в целях определения полного набора компонентов требуется выполнение более глубокой проверки.
При анализе результатов нужно учитывать все показатели и сравнивать данные анализа с полученными характеристиками. Для каждого элемента есть предельно допустимая концентрация – она не должна быть превышена.
Рассмотрим основные способы, используемые для проверки качества воды.
Метод позволяет оценивать те качества, которые доступные органам чувств. Органолептическое исследование предполагает оценку цветности, прозрачности, аромата и вкуса воды.
Анализ воды на физико-химические показатели учитывает:
- жесткость;
- минерализацию;
- щелочность;
- окисляемость.
Методика позволяет определять наличие в воде паразитов и бактерий, среди которых могут присутствовать болезнетворные микроорганизмы. Обычно подсчитывается количество организмов на 1 мл жидкости
При анализе химического состава определяется наличие и количество органических, неорганических включений – к ним относят сложные органические вещества, металлы, нефтепродукты, ПАВы и так далее. Под сложными органическими веществами подразумеваются акриламиды, стиролы, фенолы, винилхлориды, тетрахлорид углероды, диоксины.
Анализ на альфа- и бета-частицы, радий проводится в целях определения радиационной безопасности жидкости. Определение содержания радионуклидов – основа для снижения дозовых нагрузок на организм. Вместе с результатами по комплексному анализу заказчик обычно получает также рекомендации, которые помогут ему улучшить качество воды.
Экспресс-анализы используются в целях ускорения процедуры проверки и снижения ее стоимости. Они позволяют анализировать такие показатели как:
- биохимическое потребление кислорода;
- число адсорбируемых либо экстрагируемых галогенов органического происхождения;
- кислотно-щелочной баланс;
- органолептические свойства воды.
Экспресс-анализ позволяет сокращать потребность в сложном оборудовании и реактивам. Важно! Высокое качество исследования поверхностная проверка гарантировать не может.
Все чаще в последние годы для проверки состава воды используются сенсоры – чувствительные элементы, которые являются основой большинства многокомпонентных анализаторов и экспрессных тест-систем. Они эффективно определяют содержание ферментов антропогенного происхождения, а также патогенную микрофлору.
Биотестирование – передовая методика определения токсичности химического вещества на биоценоз или водные организмы. Оценочные критерии – выживаемость и активность микроорганизмов, скорость их размножения, пр. Для получения корректных результатов биотестирования нужны соответствующие показатели температуры, освещенности, состава, кислотности и так далее.
Существует множество других быстрых способов определения качества питьевой воды – например, на вкус или используя другие органы чувств. Но вы должны понимать, что подобная оценка является очень субъективной, поэтому ставку следует делать на лабораторные исследования.
источник
Выпускается в 7-ми различных вариантах исполнения — ручное или автоматическое управление, корпус из армированного пластика или нержавейки, есть вариант нержавеющего корпуса с нижним сливом для простоты консервации на зиму. Посмотреть все варианты исполнения фильтров
Анализ воды из скважины, колодца или водопровода сделать в лаборатории Санкт-Петербурге, стоимость экспертизы питьевой воды, где сделать, цена.
Согласно санитарным нормам питьевая вода должна быть безопасна в эпидемиологическом и радиационном отношении, безвредна по химическому составу, и иметь приятные органолептические свойства. Поэтому, целесообразно проверить качество воды из вашего источника — сделать анализ качества воды на соответствие требованиям санитарных норм и правил на питьевую воду. Для выбора системы очистки воды из скважины или колодца важно проверить воду не менее, чем по 15-ти основным показателям.
Требования (нормативы), которым должна соответствовать вода, изложены в санитарных нормах и правилах РФ (СанПиН) и международных нормативах Всемирной организации здравоохранения (ВОЗ), основные положения которых приведены в представленной ниже таблице. И так, рассмотрим основные показатели качества воды.
К органолептическим свойствам воды относят следующие характеристики: запах, привкус, цветность и мутность.
Запах и привкус воды объясняются присутствием в ней естественных или искусственных загрязнений. Природа запахов и привкусов очень различна, и может быть обусловлена как наличием в воде определенных растворенных солей, так и содержанием различных химических и органических соединений.
Кроме того, следует отметить, что запах и привкус может появиться в воде на нескольких этапах: из исходной природной воды, в процессе водоподготовки (в том числе в водонагревателе), при транспортировке по трубопроводам. Правильное определение источника запахов и привкусов — залог успешности их устранения.
Величина (интенсивность) запаха определяется по 6-ти бальной шкале. Например, запах тухлых яиц обусловлен наличием в воде сероводорода (Н2S), а также присутствием сульфатредуцирующих бактерий, вырабатывающих этот газ, а гнилостный запах обусловлен присутствием в воде природных органических соединений. Химические запахи (например, бензиновый, фенольный) указывают на антропогенный характер загрязнений.
Вкус воды обусловлен растворенными в воде природными веществами, каждое из которых придает воде определенный привкус:
- солоноватый — хлоридом натрия;
- горьковатый — сульфатом магния;
- кисловатый — растворенным углекислым газом или растворенными кислотами.
Приятный или неприятный вкус воды обеспечивается как наличием, так и концентрацией находящихся в ней примесей.
Под цветностью понимается естественная окраска природной и питьевой воды. Цветность косвенно характеризует наличие в воде некоторых органических и неорганических растворенных веществ и является одним из важных показателей, позволяющих правильно выбрать систему водоочистки.
Цветность воды определяется сравнением с растворами специально приготовленной шкалы цветности (на основе определенных концентраций хромово-кобальтового раствора) и выражается в градусах цветности этой шкалы. По требованиям к питьевой воде данный показатель не должен превышать 20 градусов.
Главными «виновниками» цветности воды, являются вымываемые из почвы органические вещества (в основном гуминовые и фульвовые кислоты). Повышенная цветность воды также может свидетельствовать о возможной ее техногенной загрязненности. Наличие гуминовых кислот может приводить к определенной биологической активности воды, повышает проницаемость в кишечнике ионов металлов: железа, марганца и др.
Показатель, характеризующий наличие в воде взвешенных веществ неорганического происхождения (например, карбонаты различных металлов, гидроокиси железа), органического происхождения (коллоидное железо и т.п.), минерального происхождения (песка, глины, ила), а также микробиологического происхождения (бактерио-, фито- или зоопланктона). Мутность выражается в мг/дм3.
Мутность также может быть обусловлена наличием на поверхности и внутри взвешенных частиц различных микроорганизмов, которые защищают их как от химического, так и от ультрафиолетового обеззараживания воды. Поэтому снижение мутности в процессе очистки воды способствует также значительному снижению уровня микробиологического загрязнения.
Химические показатели характеризуют химический состав воды. К данным показателям относят водородный показатель воды рН, жесткость и щелочность, минерализацию (сухой остаток), анионный и катионный состав (неорганические вещества), содержание органических веществ.
Показатель, характеризующий интегральную загрязненность воды, т.е. содержание в воде окисляющихся органических и неорганических примесей, которые в определенных условиях способны окисляться сильным химическим окислителем. К упомянутым выше загрязнителям относятся в основном органические вещества — для воды из поверхностных источников, и неорганические ионы (Fe 2+ ,Mn 2+ , и т.п.) — для воды из артезианских скважин.
Различают несколько видов окисляемости воды: перманганатную (ПМО), бихроматную, иодатную. Как видно из названий — при этом для проведения химического анализа воды используются соответствующие окислители. Показатель окисляемости — мгО2/л. Это количество миллиграмм кислорода, эквивалентное количеству реагента (окислителя), пошедшего на окисление веществ, содержащихся в 1 л воды.
Величина бихроматной окисляемости обычно используется для определения такого важного показателя воды как ХПК — химическая потребность в кислороде. ХПК используется для характеристики загрязненных природных поверхностных вод, а также для сточных вод. Этот показатель свидетельствует о степени биогенной загрязненности воды.
Бихроматная окисляемость позволяет получить значение наиболее полно характеризующее присутствие органических загрязнителей, за исключением таких химически инертных веществ как бензин, керосин, бензол, толуол и т.п. Считается, что при определении этого показателя окисляются до 90% органических примесей.
На практике для характеристики питьевой воды обычно используется показатель перманганатная окисляемость (ПМО) или перманганатный индекс (ПМИ). Чем больше значение ПМО, тем выше концентрация загрязнителей. Отметим, что величина перманганатной окисляемости ниже, чем значение, полученное для бихроматной примерно в 3 раза.
Водородный показатель или рН представляет собой логарифм концентрации ионов водорода, взятый с обратным знаком, т.е. pH = -logH + 1. Величина рН определяется количественным соотношением в воде ионов Н + и ОН — , образующихся при диссоциации воды. Если ионы ОН — в воде преобладают, что соответствует значению рН>7, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н + , что соответствует рН + >+ HCO3 —
В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды, токсичность загрязняющих веществ и многие другие ее характеристики.
Обычно уровень рН для воды, используемой в хозяйственных и питьевых целях, нормируется в пределах интервала 6-9.
Эта величина характеризует количество растворенных неорганических и органических веществ. В первую очередь это сказывается на органолептических свойствах воды. Установлено, что до 1000 мг/л вода может быть использована для водопотребления.
Величина сухого остатка влияет на вкусовые качества питьевой воды. Человек может без риска для своего здоровья употреблять воду с сухим остатком до 1000 мг/л. При большем значении вкус воды чаще всего становится неприятным горько-соленым. Следует также отметить, что у воды с низким уровнем сухого остатка вкус может отсутствовать и употреблять ее тоже не очень приятно.
Этот показатель характеризует свойство воды, связанное с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»).
Вода с большим содержанием таких солей называется жёсткой, с малым содержанием — мягкой.
Численное выражение жёсткости воды — это концентрация в ней катионов кальция и магния. По ГОСТ Р 52029-2003 жесткость выражается в градусах жесткости (°Ж), что соответствует концентрации щелочноземельного элемента, численно равной 1/2 его моля, выраженной в мг/дм³ (г/м³) (1 °Ж = 1 мг-экв/л).
Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния (катионов Ca 2+ и Mg 2+ и анионов HCO3—).
При кипячении воды гидрокарбонатные анионы вступают в реакцию с этими катионами и образуют с ними малорастворимые карбонатные соли, которые осаждаются на нагревательных элементах в виде накипи белого цвета, называемой в простонародии известью.
Временную жесткость можно устранить кипячением — отсюда и ее название.
Постоянная (некарбонатная) жесткость воды вызвана присутствием солей, не выпадающих в осадок при кипячении. В основном, это сульфаты и хлориды кальция и магния (CaSO4, CaCl2, MgSO4, MgCl2). Следует отметить, что именно присутствие соли CaSO4, растворимость которой с повышением температуры воды понижается, приводит к образованию плотной накипи.
Вода с высокой жесткостью наносит большой вред бытовым электронагревательным приборам, образуя накипь и тем самым вызывая их перегрев и разрушение, образует неприятные матовые налеты на сантехнике; в ней плохо пенятся мыло и шампуни, а поэтому увеличивается их расход.
Жесткая вода сушит кожу и вредит волосам; отрицательно влияет на качество приготовленной пищи, полезные вещества которой могут образовывать с солями жесткости плохо усваиваемые организмом соединения.
Жесткая вода вредна и для организма человека: увеличивается риск развития мочекаменной болезни, нарушается водно-солевой обмен.
Иногда в качестве характеристики встречается показатель «полная жесткость» воды, равный сумме постоянной и переменной (карбонатной) жесткости.
Его токсичное влияние на организм человека незначительно, но все же употребление питьевой воды с повышенным содержанием железа может привести к отложению его соединений в органах и тканях человека.
В общем случае в воде железо может встречаться в свободной форме в виде двух- и трехвалентных ионов:
Fe 2+ , как правило, в артезианских скважинах при отсутствии растворенного кислорода. Вода с повышенным содержанием такого железа может быть первоначально прозрачна (Fe 2+ ), но при отстаивании или нагреве приобретает желтовато-бурую окраску. Это происходит в результате окисления растворенного железа до Fe 3+ с образованием нерастворимых солей трехвалентного железа:
Fe 3+ — содержится в поверхностных источниках водоснабжения в так называемом окисленном состоянии, и, как правило, в нерастворимом виде.
Существует еще одна форма присутствия железа в природной воде — это органическое железо. Оно встречается в воде в разных формах и в составе различных комплексных соединений трехвалентных ионов железа с растворенными неорганическими и органическими соединениями, и, главным образом, с солями гуминовых кислот — гуматами. Повышенное содержание такого железа наблюдается в болотных водах, и вода имеет бурое или коричневатое окрашивание.
Органические соединения железа, как правило, растворимы или имеют коллоидную структуру (коллоидное железо) и очень трудно поддаются удалению. Коллоидные частицы из-за своего малого размера и высокого поверхностного заряда, который не позволяет частицам сближаться и препятствует их укрупнению, предотвращая образование конгломератов, создают в воде суспензии и не осаждаются, находясь во взвешенном состоянии и, тем самым, обуславливают мутность исходной воды.
На вкус такая вода имеет характерный неприятный металлический привкус, образует ржавые подтеки. Присутствие в воде коллоидного железа способствует развитию железистых бактерий, что еще больше ухудшает вкусовые качества воды и вызывает отложение осадка на внутренней поверхности трубопроводов и санитарно-технического оборудования вплоть до их полного засорения.
Марганец входит в состав многих ферментов, гормонов и витаминов, которые влияют на процессы роста, кровообразование, формирование иммунитета. Однако, повышенное его содержание в воде может оказывать токсический и мутагенный эффект на организм человека.
Вода с повышенным содержанием марганца обладает металлическим привкусом. Его присутствие приводит к значительно более быстрому износу бытовой техники и систем отопления, поскольку он способен накапливаться в виде черного налета на внутренних поверхностях труб с последующим отслаиванием и образованием взвешенного в воде осадка черного цвета. Кроме того, повышенное содержание марганца приводит к образованию черных пятен на посуде, белом белье при стирке, окрашивает ногти и зубы в серовато-черный цвет.
Также существуют «марганцевые» бактерии, которые, как и «железистые» бактерии, могут развиваться в такой воде и становиться причиной зарастания и закупорки трубопроводов.
Показатель, чаще всего характеризующий наличие в воде органических веществ животного или промышленного происхождения. Источниками азота аммонийного являются: животноводческие фермы, хозяйственно бытовые сточные воды, сточные воды с сельскохозяйственных угодий, предприятий пищевой и химической промышленности.
Указанные соединения являются главным образом продуктами распада мочевины и белков. Лимитирующая величина показателя «аммонийный азот» — токсикологическая. По нормам СанПиН содержание в воде аммония не должно превышать 2,0 мг/л.
К микробиологическим показателям безопасности питьевой воды относят общее микробное число, содержание бактерий группы кишечной палочки (общие колиформные бактерии и колифаги), споры сульфитредуцирующих клостридий и цисты лямблий.
В зависимости от характеристик водного источника с целью безопасности воды могут проверяться и такие показатели, как паразитологические и радиологические.
Анализ качества питьевой воды производится исходя из норм показателей по требованиям нормативных документов государств.
В таблице представлены нормативы основных показателей качества по санитарным нормам СанПиН Российской Федерации, указанные в столбце 3 — СанПиН 2.1.4.1074-01 «Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения» и столбце 4 — СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
Именно по этим показателям следует проверить качество воды из вашего источника и оценить необходимость установки дополнительного оборудования для очистки воды.
Для сравнения приведены нормативы Всемирной организации здравоохранения (ВОЗ).
источник
Химический анализ воды на 13 показателей. 1. Мутность — показатель содержания в воде различных взвешенных веществ (минерального происхождения) песок, глина, карбонатов различных металлов, гидроокиси железа. 2. Цветность — Сильно влияет на эту характеристику в воде вымываемых из почвы органических веществ (гуминовых и фульвовых кислот, в основном) железа и других металлов. 3. Запах — за счет присутствия в ней растворенных газов, органических веществ, минеральных солей, химических техногенных загрязнений. 4. Общее железо — Суммарное железо в воде двух и трехвалентного на 1 литр 5. Железо двухвалентное — растворенное в воде железо не должно быть больше 0,3 миллиграмма на литр, то пить такую воду не безопасно для организма. 6. Железо трехвалентное — не растворенное в воде выпавшее в момент соприкосновения воды с атмосферным кислородом. Выпадение в качестве осадка. 7. Общая жесткость — суммарное количество солей жесткости в воде на 1 литр 8. Кальций -количество в миллиграммах на 1 литр 9. Магний -количество в миллиграммах на 1 литр 10. Марганец -количество в миллиграммах на 1 литр как правило присутствует в воде вместе с железом 11. PH воды — общая щелочность и кислотность воды 12. Перманганатная окисляемость воды — наличие в воде вредной органики, бактерий, гуминовых соединений, не должна превышать 5 мг О2/л 3 13. Сухой остаток — Общая минерализация — количественный показатель растворенных в 1 л воды веществ (неорганических солей, органических веществ — кроме газов).
Стоимость 950 рублей. Выдается протокол образца СанПиН 2.1.4.1074-01, 2.1.4.1175-02 Для чего делается именно анализ на 12 показателей? Ответ: Для того, чтобы правильно подобрать засыпку или систему, которая будет очищать вашу воду максимально эффективно, здесь играют очень важную роль такие показатели как:(pH, марганец, соли жесткости, перманганатная окисляемость, наличие двух и трех валентного железа, сероводород). Каждая засыпка по разному себя проявляет при наличии в воде данных соединений и может оказаться бесполезной тратой денег, что повлечет в последствии лишние траты на переделку системы. Каждый дополнительный показатель + 140 рублей к общему анализу воды.Перечень дополнительных показателей, входящих в расширенный анализ воды из скважины или колодца, включает в себя:
- Алюминий, мг/д м³
- Кадмий, мг/д м³
- Медь, мг/д м³
- Мышьяк, мг/д м³
- Ртуть, мг/д м³
- Свинец, мг/д м³
- Натрий, мг/д м³
- Калий, мг/д м³
- Нитраты, мг/д м³
- Нитриты, мг/д м³
- Щелочность, ммоль/д м³
- Гидрокарбонаты, мг/д м³
- Нефтепродукты, мг/д м³
- Аммиак (по азоту), мг/д м³
- Сульфаты, мг/д м³
- Хлориды, мг/д м³
- Фториды, мг/д м³
- Сульфиды (сероводород), мг/д м³
Традиционно показатели качества воды подразделяют на физические (температура, цветность, вкус, запах, мутность и т.д.). Химические (водородный показатель воды pH, щелочность, жесткость, общее железо, железо двух валентное, трехвалентное, окисляемость, общая минерализация сухой остаток и другие). И санитарно-бактериологические (общая бактериальная загрязненность воды, количество-индекс, содержание в воде токсичных и радиоактивных компонентов и др.). Для определения, насколько вода соответствует требуемым нормам, документально устанавливаются численные значения показателей качества воды, с которыми производится сравнение измеренных показателей. Нормативно-техническая литература, составляющая водно-санитарное законодательство, предъявляет конкретные требования к качеству воды – в зависимости от ее назначения. К таким документам относятся «Питьевая вода» СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения».. Гигиенические требования к качеству воды, расфасованной в емкости. Контроль качества», СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды не централизованного водоснабжения. Санитарная охрана источников». Согласно требованиям СанПиН питьевая вода должна быть безвредной по своему химическому составу, безопасной в радиационном и эпидемиологическом отношении, а также обладать приятным вкусом и запахом. Поэтому для сохранения собственного здоровья так важно знать, что за воду вы пьете. Для этого ее надо сдать на анализ – проверить, насколько вода соответствует требованиям санитарных норм и правил. Рассмотрим подробно параметры, по которым оценивается качество воды. Физические показатели качества воды: Температура воды поверхностных источников определяется температурой воздуха, его влажностью, скоростью и характером движения воды (а также рядом других факторов). В зависимости от времени года она может претерпевать значительные изменения (от 0,1 до 18º С). Для подземных источников температура воды отличается большей стабильностью (4-12 º С). Оптимальная температура воды для питьевых целей составляет 6-12 ºС. Мутность – Показатель содержания в воде различных взвешенных веществ (минерального происхождения – частиц глины, ржавчины, осадочного железа, песка, ила; неорганического происхождения – карбонатов различных металлов, гидроокиси железа; органического происхождения — планктона, водорослей и др.). Попадание взвешенных веществ в воду колодцев происходит вследствие размыва берегов и дна реки, поступления их с талыми, дождевыми и сточными водами. В летнем трубопроводе на зимний период отключают воду, труба ржавеет, и впервые месяцы вымывается большое количество не растворенного железа. Подземные источники глубокого происхождения, имеют, как правило, небольшую мутность воды за счет наличия в ней взвеси гидроксида железа. Для поверхностных вод мутность чаще обуславливается присутствием ЗОО — и фитопланктона, илистых или глинистых частиц; ее величина колеблется в течение года. Мутность воды обычно выражается в миллиграммах на литр (мг/л); ее величина для питьевой воды по нормам СанПиН 2.1.4.559-96 не должна превышать 1,5 мг/л. Для ряда производств пищевой, медицинской, химической, электронной промышленности используется вода такого же или более высокого качества. В то же время во многих производственных процессах допустимо использование воды с повышенным содержанием взвешенных веществ. Цветность воды — показатель, характеризующий интенсивность окраски воды. Он измеряется в градусах по платиново-кобальтовой шкале, при этом исследуемая проба воды сравнивается по окраске с эталонными растворами. Цветность воды обуславливается присутствием в ней примесей как органической, так и неорганической природы. Сильно влияет на эту характеристику наличие в воде вымываемых из почвы органических веществ (гуминовых и фульвовых кислот, в основном); железа и других металлов прошедших окисление атмосферным воздухом ; техногенных загрязнений из промышленных сточных вод. Требование СанПиН2.1.4.1074-01 «Питьевая вода – цветность питьевой воды должна быть не более 20º. Отдельные виды промышленности ужесточают требования к величине цветности воды. Запах и привкус воды – эта характеристика определяется органолептическим (с помощью органов чувств), поэтому она достаточно субъективна. Запахи и привкус, которыми может обладать вода, появляются за счет присутствия в ней растворенных газов, органических веществ, минеральных солей, химических техногенных загрязнений. Интенсивность запахов и привкусов определяются по пятибалльной шкале или по «порогу разбавления» испытуемой пробы воды дистиллированной водой. При этом устанавливается кратность разбавления, необходимая для исчезновения запаха или привкуса. Определение запаха и вкуса происходит с помощью непосредственного дегустирования при комнатной температуре, а также при температуре 60º С, вызывающей их усиление. Питьевая вода при 60º С не должна иметь привкус и запах более 2-х баллов ( требования ГОСТ 2874-82). В соответствии с 5-ти бальной шкалой: при 0 баллов — запах и привкус не обнаруживается; при 1 балле вода имеет очень слабые запах или привкус, обнаруживаемые только опытным исследователем; при 2-х баллах имеются слабые запах или привкус, очевидные и для неспециалиста; при 3-х баллах легко обнаруживаются заметные запах или привкус (что и является причиной жалоб на качество воды); при 4-х баллах различаются отчётливые запах или привкус, могущие заставить воздержаться от употребления воды; при 5-ти баллах вода имеет такие сильные запах или привкус, что становится совершенно непригодной для питья. Вкус воды обусловлен наличием в ней растворенных веществ, придающий ей определенный привкус, который может быть солоноватым, горьковатым, сладковатым и кисловатым. Природные воды имеют, как правило, только солоноватый и горьковатый привкус. Причем солоноватый привкус появляется у воды, содержащей хлорид натрия, а горьковатый привкус дает избыток сульфата магния. Вода с большим количеством растворённой углекислоты (т.н. минеральные воды) имеет кислый вкус. Вода с чернильным или железистым привкусом насыщена солями железа и марганца; вяжущий привкус ей придает сульфат кальция, перманганат калия; щелочной привкус вызывается содержанием в воде соды, поташи, щелочи. Привкус может иметь естественное происхождение (присутствие марганца, железа, метана, сероводорода и т.д.) и искусственное происхождение (при сбросе промышленных стоков). Требования СанПиН 2.1.4. 1074-01 «Питьевая вода» — привкус не более 2 баллов. Запахи воде придают различные живущие и отмершие организмы, растительные остатки, специфические веществами, выделяемые некоторыми водорослями и микроорганизмами, а также присутствие в воде растворенных газов, таких как хлор, аммиак, сероводород, меркаптаны или органических и хлорорганических загрязнений. Запахи бывают природного (естественного) и искусственного происхождения. К первым относятся такие запахи, как древесный, ароматический, землистый, болотный, плесневый, гнилостный, травянистый, рыбный, неопределённый и сероводородный и др. Запахи искусственного происхождения получают свое название по определяющим их веществам: камфорный, фенольный, хлорный, смолистый, аптечный, хлор-фенольный, запах нефтепродуктов и т. д. Требования СанПиН 2.1.4. 1074-01 к питьевой воде — запах не более 2 баллов. Химические показатели качества воды Общая минерализация (сухой остаток). Общая минерализация — количественный показатель растворенных в 1 л воды веществ (неорганических солей, органических веществ — кроме газов). Этот показатель также называют общим солесодержанием. Его характеристикой является сухой остаток, получаемый в результате выпаривания профильтрованной воды и высушивании задержанного остатка до постоянной массы. Российскими нормативами допускается минерализация воды, используемой для хозяйственно-питьевых целей, не более 1000 — 1500 мг/л. Сухой остаток для питьевой воды не должен превышать 1000 мг/л. Активная реакция воды pH (степень её кислотности или щёлочности) определяется соотношением существующих в ней кислых (водородных) и щелочных (гидроксильных) ионов. При ее характеристике пользуются рН – водородным и гидроксильным показателями, определяющими, соответственно, кислотность и щелочность воды. Величина водородного показателя pH равна отрицательному десятичному логарифму концентрации водородных ионов в воде. При равном количестве кислотных и щелочных ионов, реакция воды нейтральная, а значение pH=7. При рН 7,0 – щелочную. Нормы СанПиН 2.1.4. 1074-01 требуют, чтобы значение рН питьевой воды находилось в пределах 6,0. 9,0. Большинство природных источников имеют значение рН в указанных пределах. Однако активная обработка воды реагентами может вызвать существенное изменение значения рН. Правильная оценка качества воды и точный выбор способа ее очистки предполагает знание рН воды источников в различные периоды года. Вода с низкими значениями рН оказывает сильное коррозирующее воздействие на сталь и бетон. Часто качество воды описывается через такой термин, как жесткость. Требования к качеству воды по показателю жесткости в России и Европе очень сильно различаются: 7 мг-экв/л (по российским нормам) и 1 мг-экв/л (директива Совета ЕС). Повышенная жесткость представляет собой самую распространенную проблему качества воды. Пример: Кронштадт, Ломоносов, Красное Село, Гатчина, высокое содержание кальция в воде и невозможность употребления такой воды не в технических не в пищевых целях без специальной фильтрации воды или использования ионообменных смол и полифосфатов. Жесткость воды – показатель, характеризующий содержание в воде солей жесткости (главным образом, кальция и магния). Он измеряется в миллиграмм-эквивалентах на литр (мг-экв/л). Различают такие понятия как карбонатная (временная) жесткость, не карбонатная (постоянная) жесткость и общая жесткость воды. Карбонатная жесткость (устранимая) – показатель наличия в воде гидрокарбоната кальция и магния. При кипячении воды происходит его разложение с образованием малорастворимых солей и углекислого газа. Некарбонатная или постоянная жесткость определяется содержанием в воде некарбонатных солей кальция и магния — сульфатов, хлоридов, нитратов. При кипячении воды они не выпадают в осадок и остаются в растворе. Общая жесткость – суммарная величина содержания в воде солей кальция и магния; представляет собой сумму карбонатной и некарбонатной жесткости. В зависимости от величины жесткости вода характеризуется как: Величина жесткости воды значительно варьирует в зависимости от того, какие типы пород и почв слагают бассейн водосбора; от погодных условий и сезона года. Так, в поверхностных источниках вода, как правило, относительно мягкая (3. 6 мг-экв/л) и зависит от расположения — чем южнее, тем выше жесткость воды. Жесткость подземных вод меняется в зависимости от глубины и расположения горизонта водоносного слоя и величины годового объема осадков. В слое известняка жесткость воды обычно составляет 6 мг-экв/л и более. Жесткость питьевой воды (по нормам СанПиН 2.1.4. 1074-01 )-не должна превышать 7,0 мг-экв/л. Жесткая вода из-за избытка кальция обладает неприятным вкусом. Опасность постоянного употребления воды с повышенной жесткостью — в снижении моторики желудка, накоплении солей в организме, риске заболевания суставов (артриты, полиартриты) и образования камней в почках и желчных путях. Правда, очень мягкая вода также не полезна. Мягкая вода, обладающая большой активностью, способна вымывать кальций из костей, что ведет к их ломкости; развитию рахита у детей. Еще одним неприятным свойством мягкой воды является ее способность при прохождении через пищеварительный тракт вымывать также полезные органические вещества, в том числе и полезные бактерии. Оптимальный вариант — вода жесткостью 1,5-2 мг-экв/л. Уже общеизвестно, что нежелательно использовать жесткую воду для хозяйственных целей. Такие последствия, как налет на сантехнических приборах и арматуре, образование накипи в водонагревательных системах и приборах – очевидны! Образование осадка кальциевых и магниевых солей жирных кислот при хозяйственно-бытовом использовании жесткой воды приводит к значительному росту расхода моющих средств и замедлению процесса приготовления пищи, что проблемно для пищевой промышленности. В ряде случаев использование жесткой воды в производственных целях (в текстильной бумажной промышленности, на предприятиях искусственного волокна, для питания паровых котлов и др.) запрещается из-за нежелательных последствий. Использование жесткой воды уменьшает срок службы водонагревательной техники (бойлеров, батарей центрального водоснабжения и др.). Отложение солей жесткости (гидрокарбонатов Ca и Mg) на внутренних стенках труб, накипные отложения в водонагревательных и охлаждающих системах уменьшают проходное сечение, снижают теплоотдачу. В системах оборотного водоснабжения не допускается использовать воду с высокой карбонатной жесткостью. Щёлочность воды. Общая щёлочность воды – это сумма содержащихся в ней гидратов и анионов слабых кислот (кремниевой, угольной, фосфорной и т.д.). При характеристике подземных вод в подавляющем большинстве случаев используют гидрокарбонатную щёлочность, то есть содержание в воде гидрокарбонатов. Формы щелочности: бикарбонатная, карбонатная и гидратная. Определение щелочности (мг-экв/л) производится в целях контроля качества питьевой воды; для определения пригодности воды для полива; для расчета содержания карбонатов, для последующей очистки сточных вод. ПДК по щелочности 0,5 — 6,5 ммоль / дм3. Содержание сульфатов и хлоридов. Сульфаты и хлориды кальция и магния образуют соли некарбонатной жесткости. Хлориды – их присутствие наблюдается практически во всех водах. Их наличие в воде объясняется вымыванием из горных пород хлорида натрия (поваренной соли), очень распространённой на Земле соли. Значительное количество хлоридов натрия содержится в морской воде, а также в воде некоторых озер и подземных источников. В зависимости от стандарта ПДК хлоридов в питьевой воде равняется 300. 350 мг/л. Повышенное содержание хлоридов с одновременным присутствием в воде нитритов, нитратов и аммиака встречается в случае загрязнённости источника бытовыми сточными водами. Сульфаты наличествуют в подземных водах, как результат растворения гипса, имеющегося в пластах. При избыточном содержании сульфатов в воде у человека возникает расстройство желудочно-кишечного тракта (эти соли обладают слабящим эффектом). ПДК сульфатов в питьевой воде составляет 500 мг/л. Содержание кремниевых кислот. Кремниевые кислоты различной формы (от коллоидной до ионодисперсной) встречаются в воде подземных и поверхностных источников. Кремний имеет малую растворимость, и его содержание в воде, как правило, невелико. Попадание кремния в воду происходит также с промышленными стоками предприятий, осуществляющих производство керамики, цемента, стекольных изделий, силикатных красок. ПДК кремния составляет 10 мг/л. Использование воды, содержащей кремниевые кислоты, запрещено для питания котлов высокого давления – из-за образования силикатной накипи на стенках. Фосфатов в воде обычно немного, поэтому их повышенное содержание сигналит о возможном загрязнении промышленными стоками или стоками с сельскохозяйственных полей. При повышенном содержании фосфатов усиленно развиваются сине-зелёные водоросли, выделяющие токсины в воду при отмирании. ПДК соединений фосфора в питьевой воде — 3,5 мг/л. Фториды и йодиды. Фториды и йодиды имеют некоторую схожесть. Недостаток или избыток этих элементов в организме человека приводит к серьёзным заболеваниям. Например, недостаток (избыток) йода провоцирует заболевания щитовидной железы («зоб»), развивающиеся, когда суточный рацион йода менее 0,003 мг или более 0,01 мг. Фториды содержатся в минералах — солях фтора. Содержание фтора в питьевой воде для сохранения здоровья человека должно находиться в пределах 0,7 — 1,5 мг/л (зависит от климата). Поверхностные источники имеют, преимущественно, низкое содержание фтора (0,3-0,4 мг/л). Содержание фтора в поверхностных водах повышается следствие сброса промышленных фторсодержащих сточных вод или при контакте вод с почвами, насыщенными соединениями фтора. Так, артезианские и минеральные воды, контактирующие со фторсодержащими водовмещающими породами, имеют максимальную концентрацию фтора 5-27 мг/л и более. Важной характеристикой для здоровья человека является количество фтора в его суточном рационе. Обычно содержание фтора в суточном рационе составляет от 0,54 до 1,6 мг фтора (усреднено — 0,81 мг). Стоит отметить, что в организм человека с пищевыми продуктами поступает в 4-6 раз меньше фтора, чем с питьевой водой, имеющей оптимальное его содержание (1 мг/л). При повышенном содержании фтора в воде (более 1,5 мг/л) появляется опасность развития у населения эндемического флюороза (т.н. «пятнистой эмали зубов»), рахита и малокровия. Эти заболевания сопровождаются характерным поражением зубов, нарушением процессов окостенения скелета, истощением организма. Поэтому в питьевой воде содержание фтора лимитируется. Фактом является и то, некоторое содержание фтора в воде необходимо для снижения уровня заболеваний, определяемых последствиями одонтогенной инфекции (сердечнососудистая патология, ревматизм, заболевания почек и др.). При употреблении воды с содержанием фтора менее 0,5 мг/л развивается кариес зубов, поэтому в таких случаях врачи рекомендуют пользоваться фторсодержащей зубной пастой. Фтор лучше усваивается организмом из воды. Исходя из вышеизложенного, оптимальной дозой фтора в питьевой воде является величина 0,7. 1,2 мг/л. ПДК фтора — 1,5 мг/л. Окисляемость Перманганатная – параметр, обусловленный присутствием в воде органических веществ; отчасти он может сигнализировать о загрязнённости источника сточными водами. Количественное значение этих показателей и их соотношение позволяет косвенно судить о природе присутствующих в воде органических соединениях, веществ, а так же способах и эффективности очистки воды. Этот показатель отражает общую концентрацию органики в воде. Природа органических веществ может быть самой разной — и гуминовые кислоты почв, и сложная органика растений, и химические соединения антропогенного происхождения. Для определения конкретных соединений используются другие методы. Перманганатная окисляемость выражается в миллиграммах кислорода, пошедшего на окисление этих веществ, содержащихся в 1 дм3 воды. Различают несколько видов окисляемости воды: перманганатную, бихроматную, иодатную. Наиболее высокая степень окисления достигается бихроматным методом. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах — как правило, бихроматную окисляемость (ХПК — «химическое потребление кислорода»). Величина окисляемости природных вод может варьироваться в широких пределах от долей миллиграммов до десятков миллиграммов О2 на литр воды. Поверхностные воды имеют более высокую окисляемость по сравнению с подземными. Это понятно — органика из почвы и растительного легче попадает в поверхностные воды, чем в грунтовые, чаще всего ограниченные глинистыми водоупорами. Вода равнинных рек как правило имеет окисляемость 5-12 мг О2 /дм3, рек с болотным питанием — десятки миллиграммов на 1 дм3. Подземные воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграмма О2 /дм3. Хотя подземные воды в районах нефтегазовых месторождений, и торфяников могут иметь очень высокую окисляемость. По требованиям СанПиН: величина перманганатной окисляемости воды не должна превышать 5,0 мг О2/л. Вода с перманганатной окисляемостью менее 5 мг О2/л считается чистой, так как СЭС оставляет определенные допуски по нормам для различных районов с превышениями, более 5 мг О2/л грязной. Но лучше по возможности снизить ее до минимума. Содержание соединений железа. В природных водах железо может встречаться в следующих видах: — в истинно растворённом виде (двухвалентное железо Fe2+). Содержится обычно в артезианских скважинах (отсутствует растворенный кислород). Вода прозрачная бесцветная. Если содержание такого железа в ней высокое, то при отстаивании или нагреве вода становится желтовато-бурой; — в нерастворённом виде (трёхвалентное железо Fe3+ ) содержится в поверхностных источниках водоснабжения. Вода прозрачная — с коричневато-бурым осадком или ярко выраженными хлопьями; — в коллоидном состоянии или виде тонкодисперсной взвеси. Вода мутная, окрашенная, желтовато-коричневая опалесцирующая. Коллоидные частицы, находясь во взвешенном состоянии, не выпадают в осадок даже при длительном отстаивании; — в виде так называемой железоорганики — солей железа и гуминовых и фульвокислот. Вода прозрачная, желтовато-коричневая; — железобактерии, образующие коричневую слизь на водопроводных трубах. Содержание железа в поверхностных водах средней полосы России — от 0,1 до 1,0 мг/дм 3 железа; в подземных водах эта величина достигает 15-20 мг/дм 3 и более. Важно проведение анализа на содержание железа в сточных водах. Особенно «засоряют» водоемы железом сточные воды предприятий металлообрабатывающей, металлургической, лакокрасочной промышленности, текстильной, а также сельскохозяйственные стоки. На концентрацию железа в воде влияют величина рН и содержание кислорода в воде. В колодезной и скважинной воде железо может находиться в окисленной и в восстановленной форме, двух и трех валентное, однако при отстаивании воды оно всегда окисляется и может выпадать в осадок. СанПиН 2.1.4. 1074-01 допускают общее содержание железа не более 0,3 мг/л. Считается, что железо не токсично для человеческого организма, но при длительном употреблении воды с избыточным содержанием железа может произойти отложение его соединений в тканях и органах человека. Вода, загрязненная железом, имеет неприятный вкус, приносит неудобства в быту. На ряде промышленных предприятий, использующих воду для промывки продукта при его изготовлении, например, в текстильной промышленности, даже небольшое содержание железа в воде значительно снижает качество продукции. Марганец Встречается в воде в аналогичных модификациях. Марганец – это металл, активизирующий ряд ферментов, участвующий в процессах дыхания, фотосинтеза, влияющий на кроветворение и минеральный обмен. При недостатке марганца в почве у растений наблюдаются хлорозы, некрозы, пятнистости. Поэтому почвы, бедные марганцем (карбонатные и пере известкованные), обогащаются марганцевыми удобрениями. Для животных недостаток этого элемента в кормах приводит к замедлению роста и развития, нарушению минерального обмена, развитию анемии. Человек страдает как от недостатка, так и от переизбытка марганца. Нормы СанПиН 2.1.4. 1074-01 допускают содержание марганца в питьевой воде не более 0,1 мг/л. Переизбыток марганца в воде может вызвать заболевание костной системы человека. Такая вода имеет неприятный металлический привкус. Ее длительное употребление приводит к отложению марганца в печени. Присутствие в воде марганца и железа способствует образованию железистых и марганцевых бактерий, продукты жизнедеятельности которых в трубах и теплообменных аппаратах вызывают уменьшение их сечения, иногда и полную их закупорку. Вода, используемая в пищевой, текстильной промышленности, при производстве пластмасс и др., должна содержать строго ограниченное количество железа и марганца. Также переизбыток марганца приводит к окрашиванию белья при стирке, образованию черных пятен на сантехнике и посуде. Натрий и калий — попадание этих элементов в подземные воды происходит в процессе растворения коренных пород. Основной источник натрия в природных водах — залежи поваренной соли NaCl, возникшие в местах нахождения древних морей. Калий в водах встречается реже – из-за его поглощения почвой и растениями. Натрий играет важную биологическую роль для большинства форм жизни на Земле, в том числе и для человека. Человеческий организм содержит примерно 100 г натрия. Ионами натрия выполняется задача активизации ферментативного обмена в организме человека. По нормам СанПиН 2.1.4. 1074-01 ПДК натрия — 200 мг/л. Избыток натрия в воде и пище провоцирует у человека развитие гипертензии и гипертонии. Калий способствует усилению выведения воды из организма. Это его свойство используется для облегчения функционирования сердечнососудистой системы при ее недостаточности, исчезновения или существенного уменьшения отеков. Недостаток калия в организме приводит к нарушениям функций нервно-мышечной (параличи и парезы) и сердечнососудистой систем и способствует депрессии, дискоординации движений, мышечной гипотонии, судорогам, артериальной гипотонии, изменениям на ЭКГ, нефритам, энтеритам и др. ПДК калия — 20 мг/л. Медь, цинк, кадмий, мышьяк, свинец, никель, хром и ртуть – попадание этих элементов в источники водоснабжения происходит преимущественно с промышленными стоками. Рост содержания меди и цинка может также являться следствием коррозии оцинкованных и медных водопроводных труб в случае повышенного содержания агрессивной углекислоты. По нормам СанПиН ПДК этих элементов составляет: для меди — 1,0 мг/л; цинка — 5,0 мг/л; свинца — 0,03 мг/л; кадмия — 0,001 мг/л; никеля — 0,1 мг/л (в странах ЕС — 0,05 мг/л), мышьяка — 0,05 мг/л; хрома Cr3+ — 0,5 мг/л, ртути — 0,0005 мг/л; хрома Cr4+ — 0,05 мг/л. Все эти соединения — тяжёлые металлы, обладающие кумулятивным действием, то есть они имеют свойство накапливаться в организме. Кадмий очень токсичен. Накопление кадмия в организме может приводить к таким заболеваниям, как анемия, поражение печени, почек и легких, кардиопатия, эмфизема легких, остеопороз, деформация скелета, гипертония. Избыток этого элемента провоцирует и усиливает дефицит Se и Zn. Симптомами кадмиевого отравления являются поражение центральной нервной системы, белок в моче, острые костные боли, дисфункция половых органов. Все химические формы кадмия представляют опасность. Алюминий – легкий металл серебристо-белого цвета. В первую очередь его попадание в воду происходит в процессе водоподготовки — в составе коагулянтов и при сбросе сточных вод переработки бокситов. В воде ПДК солей алюминия составляет 0,5 мг/л. При избытке алюминия в воде происходит повреждение центральной нервной системы человека. Бор и селен – присутствие этих элементов в некоторых природных водах обнаруживается в весьма незначительной концентрации. Необходимо помнить, что их повышенная концентрация приводит к серьёзному отравлению. Содержание газов. Вода природных источников содержит чаще всего следующие газы: кислород О2, диоксид углерода (углекислый газ) СО2 , сероводород Н2S. Кислород пребывает в воде в растворенном виде. В подземных водах растворенный кислород отсутствует. Его содержание в поверхностных водах зависит от температуры воды, а также определяется интенсивностью процессов обогащения или обеднения воды кислородом, достигая до 14 мг/л. Даже значительное содержание кислорода и двуокиси углерода не ухудшает качество питьевой воды, способствуя, в то же время, росту коррозии металла. Повышение температуры воды, а также ее подвижность усиливают процесс коррозии. Повышенное содержание в воде агрессивной двуокиси углерода делает подверженными коррозии также стенки бетонных труб и резервуаров. Присутствие кислорода не допустимо в питательной воде паровых котлов среднего и высокого давления. Сероводород имеет свойство придавать воде характерный неприятный запах и вызывать коррозию металлических стенок котлов, баков и труб. Из-за этого не допускается присутствие сероводорода в воде хозяйственно-питьевого назначения и в воде для большинства производственных нужд. Вещества, содержащиеся в воде и их свойства, ухудшающие качество питьевой воды и вредно влияющие на организм человека. Соединения азота. К азотосодержащим веществам относятся нитриты NO2 — , нитраты NO3 — и аммонийные соли NH4 + , почти всегда присутствующие во всех водах, в том числе подземных. Их наличие свидетельствует о том, что в воде имеются органические вещества животного происхождения. Эти вещества образуются в результате распада органических примесей, преимущественно — мочевины и белков, которые попадают в воду с бытовыми сточными водами. Рассматриваемая группа ионов находится в тесной взаимосвязи. Первый продукт распада — аммиак (аммонийный азот), образуется в результате распада белков и является показателем свежего фекального загрязнения. Окисление ионов аммония до нитратов и нитритов в природной воде осуществляется бактериями Nitrobacter и Nitrosomonas. Нитриты — лучший показатель свежего фекального загрязнения воды, особенно если одновременно повышенно содержание аммиака и нитритов. Нитраты -показатель более давнего органического фекального загрязнения воды. Содержание нитратов вместе с аммиаком и нитритами недопустимо. Таким образом, наличие, количество и соотношение в воде азотсодержащих соединений позволяет судить о том, как сильно и как давно вода заражена продуктами жизнедеятельности человека. При отсутствии в воде аммиака и, в то же время, наличии нитритов и особенно нитратов можно сделать вывод, что водоем подвергся загрязнению давно, и за это время произошло самоочищение воды. Если в водоеме присутствует аммиак и нет нитратов, значит, загрязнение воды органическими веществами случилось недавно. В питьевой воде не допускается содержание аммиака и нитритов. ПДК в воде: аммоний — 2,0 мг/л; нитриты — 3,0 мг/л; нитраты — 45,0 мг/л. Если концентрация иона аммония в воде превышает фоновые значения, значит, загрязнение произошло недавно, а источник загрязнения находится близко. Это могут быть животноводческие фермы, коммунальные очистные сооружения, скопления азотных удобрений, навоза, поселения, отстойники промышленных отходов и др. При употреблении воды с повышенным содержанием нитратов и нитритов у человека нарушается окислительная функция крови. Хлор вводится в питьевую воду при её обеззараживание. Обеззараживающее действие хлор проявляет, окисляя или хлорируя (замещая) молекулы веществ, входящие в состав цитоплазмы клеток бактерий, в результате чего бактерии гибнут. Чрезвычайно чувствительными к хлору являются возбудители дизентерии, брюшного тифа, холеры и паратифов. Сравнительно малые дозы хлора дезинфицируют даже сильно заражённую бактериями воду. Однако не происходит полной стерилизации воды из-за сохраняющих жизнеспособность отдельных хлоррезистентных особей. Свободный хлор — вредное для здоровья человека вещество, поэтому в питьевой воде централизованного водоснабжения гигиеническими нормами СанПиН строго регламентируется содержание остаточного свободного хлора. СанПиН устанавливает верхнюю и минимально-допустимую границы содержания свободного остаточного хлора. Проблема в том, что, хотя воду и обеззараживают на станции водоочистки, на пути к потребителю она подвергается риску вторичного заражения. Например, в стальной подземной магистрали могут быть свищи, через которые в магистральную воду попадают почвенные загрязнения. Поэтому нормы СанПиН2.1.4. 1074-01 предусматривают содержание остаточного хлора в водопроводной воде не менее 0,3 мг/л и не более 0,5 мг/л. Хлор токсичен и является сильным аллергиком, поэтому хлорированная вода оказывает неблагоприятное воздействие на кожу и слизистые оболочки. Это и покраснения различных участков кожи, и проявления аллергического конъюктевита (отек век, жжение, слезотечение, болевые ощущения в области глаз). Хлор также вредно воздействует на дыхательную систему: в результате пребывания в бассейне с хлорированной водой в течение нескольких минут у 60% пловцов наблюдается проявление бронхоспазма. Около 10% хлора, применяющегося при хлорировании воды, образуют хлорсодержащие соединения, такие как хлороформ, дихлорэтан, четырёххлористый углерод, тетрахлоэтилен, трихлорэтан. 70 — 90 % образующихся при водоподготовке хлорсодержащих веществ составляет хлороформ. Хлороформ способствует профессиональным хроническим отравлениям с преимущественным поражением печени и центральной нервной системы. Также при хлорировании существует вероятность образования диоксинов, являющихся чрезвычайно токсичными соединениями. Высокая степень токсичности хлорированной воды многократно увеличивает риск развития онкологии. Так, американские эксперты считают хлорсодержащие вещества в питьевой воде косвенно или непосредственно виновными в 20 онкозаболеваниях на 1 млн. жителей. Сероводород встречается в подземных водах и имеет преимущественно неорганическое происхождение. В природе происходит постоянное образование этого газа при разложении белковых веществ. Он имеет характерный неприятный запах; провоцирует коррозию металлических стенок баков, котлов и труб; является общеклеточным и каталитическим ядом. При соединении с железом образует черный осадок сернистого железа FeS. Все вышесказанное является основанием для полного удаления сероводорода из воды хозяйственно-питьевого назначения. Микробиологические показатели. Общее микробное число (ОМЧ) определяется количеством бактерий, содержащихся в 1 мл воды. Согласно требованиям ГОСТ, в питьевой воде не должно содержаться более 100 бактерий в 1 мл. Количество бактерий группы кишечной палочки представляет особую важность для санитарной оценки воды. Наличие в воде кишечной палочки — свидетельство загрязнении ее фекальными стоками и, как следствие, риска попадания в нее болезнетворных бактерий. Определение наличия патогенных бактерий при биологическом анализе воды затруднено, и бактериологические исследования сводятся к определению общего числа бактерий в 1 мл воды, растущих при 37ºС, и кишечной палочки — бактерии коли. Наличие последней сигнализирует о загрязнении воды выделениями людей, животных и т.п. Минимальный объем испытуемой воды, мл, приходящейся на одну кишечную палочку, называется колититром, а количество кишечных палочек в 1 л воды — коли-индексом. По ГОСТ 2874-82 допускается коли-индекс до 3, колититр — не менее 300, а общее число бактерий в 1 мл — до 100. По нормам СанПиН допустимо общее микробное число 50 КОЕ/мл, общие колиформные бактерии (ОКБ) КОЕ/100мл и термотолетарные колиформные бактерии (ТКБ) КОЕ/100мл — не допускаются.
Патогенные бактерии и вирусы, находящиеся в воде, могут вызвать заболевания дизентерией, брюшным тифом, паратифом, амебиазом, холерой, диареей, бруцеллезом, инфекционным гепатитом, туберкулезом, острым гастроэнтеритом, сибирской язвой, полиомиелитом, туляремией и др.
источник