Если вам скажут, что проточная вода может не содержать железа, не верьте. Металл попадает в колодцы и скважины из растворенных горных пород (их частицы содержатся в грунте), из сточных вод сельскохозяйственных и промышленных предприятий, накапливается при прохождении жидкости через центральную систему водоснабжения (состояние труб зачастую оставляет желать лучшего). В такой ситуации анализ воды на железо становится насущной необходимостью.
При этом ВОЗ до сих пор не установила рекомендованных норм: по мнению ученых, железо не окажет негативного влияния на здоровье человека, даже если злоупотреблять «насыщенной» водой. Допустимый порог (0,3 мг/л) был обозначен СанПином на основании вкусовых, а не медицинских показателей.
Это интересно: в организме взрослого человека содержится около 5 граммов железа, которое входит в состав гемоглобина, миоглобина и различных ферментов. Без этого элемента невозможен нормальный процесс кроветворения. Часть железа «складирована» в печени и селезенке – этот резерв используется в случае истощения организма.
В воде содержится одно или несколько соединений железа:
- Двухвалентное (растворенное);
- Трехвалентное (в состоянии взвеси);
- Органическое (соединенное с другими веществами);
- Бактериальное (продукт жизнедеятельности некоторых микроорганизмов);
- Коллоидное (с микроскопическими частицами).
Наличие «добавок» не всегда видно невооруженным глазом, зачастую выявить проблему может только экспресс-анализ воды на железо.
Определить наличие примеси можно самостоятельно. Первый тревожный звоночек – появление ярко выраженного металлического привкуса (при сильном превышении нормы этот вкус ощущается даже в кофе или чае). На стенках посуды и поверхности сантехники проступает желтоватый или рыжий налет, который сложно оттереть без абразивных средств. Белое белье после стирки приобретает грязноватый оттенок, а цветное быстро теряет яркость красок. При этом внешний вид воды может вовсе не вызывать подозрений.
Важно! Если вы обустроили скважину или колодец на участке, сделать анализ воды на железо нужно через 2-3 недели после начала ее эксплуатации. Впоследствии процедуру можно проводить раз в 2 года (либо при изменении цвета или вкуса воды).
Первичный анализ воды на железо в домашних условиях можно провести несколькими способами:
- Смешать 25 мл воды и по 1 мл сульфосалициловой кислоты, аммиака и нашатырного спирта. Если через 15-20 минут раствор окрасится в ярко-желтый цвет, в нем есть примесь железа.
- Смешать слабый раствор марганцовки с пробой воды. Тревожный «звоночек» – изменение цвета на желтовато-бурый оттенок.
- Использовать экспресс-анализ воды на железо («набор аквариумиста»). Смешайте реагент с пробами жидкости по инструкции и определите степень загрязнения по интенсивности цвета.
- Трехвалентное железо можно выявить простой процедурой – отстаиванием воды. Железо вступает в реакцию с кислородом и выпадает в виде красновато-бурого осадка.
Более подробный анализ воды на железо (общее либо двухвалентное) можно сделать в аккредитованных лабораториях. В идеале эту процедуру нужно проводить на месте – при транспортировке может начаться процесс окисления, что исказит результаты. Если такой возможности нет, нужно провести забор проб по всем правилам:
- Используйте чистую пластиковую или стеклянную посуду объемом не менее 1,5 литра (можно взять бутылку от негазированной минералки).
- Наполняйте емкость до самого верха и тщательно закручивайте пробку, чтобы перекрыть доступ воздуха.
- Доставьте образцы в течение 2 часов. Этот срок критичен при выявлении ионов железа – именно они влияют на образование накипи.
Анализ на общее железо выявляет остаток металла в воде (то, что остается после реакции элемента с кислородом). Именно этот осадок отвечает за ржавые потеки на сантехнике и желтоватый налет на посуде.
В воде из скважин и колодцев чаще всего выявляется двухвалентное (растворенное) железо. Избавиться от него можно с помощью довольно сложной системы фильтров. На входе устанавливают ионообменные картриджи, в которых происходит процесс окисления металла и образование твердого осадка. Получившийся «песок» собирается в фильтре (картриджи нужно периодически менять). Более дорогая и эффективная система – фильтры с обратным осмосом – под высоким давлением прогоняет загрязненную воду через специальные мембраны, а все загрязнения и отходы утилизирует в канализацию.
От трехвалентного железа можно избавиться с помощью аэратора – открытого резервуара, в котором отстаивается вода. Для ускорения процесса окисления жидкость насыщают кислородом при помощи компрессора. Простым аналогом системы может стать обычное ведро: наберите воду, а через сутки аккуратно слейте примерно две трети.
Для бытовой очистки воды можно использовать активированный уголь. Заверните таблетки в вату и пропустите жидкость сквозь импровизированный фильтр.
Важно! Не забывайте, что домашние процедуры очистки могут носить лишь временный характер. Чтобы не подвергать здоровье риску, своевременно проводите анализ воды на железо и используйте профессиональные системы фильтрации.
источник
Цель работы: оптическим методом анализа, используя ФЭК, определить концентрацию Fe 2+ , Fe 3+ , общее содержание железа в исследуемой пробе воды и контрольном растворе.
В природных водах железо может находиться в растворенном, коллоидном и взвешенном состоянии, может входить в состав минеральных и органических соединений. В подземных водах преобладают соединения двухвалентного железа Fe(HCO3)2, FeSO4, образующиеся при растворении железосодержащих пород. Эта форма содержания железа устойчива в присутствии растворенного CO2 и в отсутствии кислорода. При выходе подземных вод на поверхность наблюдается окисление Fe 2+ в Fe 3+ , сопровождающееся образованием трудно растворимого Fe(OH)3 : 4Fe 2+ + 3 O2 + 6 H2O = 4 Fe(OH)3
Гидроксид железа (III) может содержаться в поверхностных водах в виде коллоидного раствора, но под влиянием растворенных электролитов он коагулирует. Поэтому содержание железа в поверхностных водах незначительно(сотые или десятые доли мг/л). Воды северных районов (болотистые) содержат органическую форму железа – гуматы, обусловливающие их цветность.
Содержание железа в питьевой воде не должно превышать 0,3 мг/л, т.к. при большей концентрации появляется неприятный (железистый) привкус и бурый оттенок. Нежелательно железо во многих производственных водах. Так, при содержании железа в охлаждающей воде наблюдается массовое развитие железобактерий, вызывающих обрастание и закупорку труб. Вода, используемая для питания паровых котлов, не должна содержать железа более 100 мкг/л. Концентрация железа выше 1 мг/л губительны для рыб.
Выбирая метод обезжелезивания, следует предварительно определить форму содержания железа.
Концентрацию железа в воде определяют колориметрическим методом.
Качественное определение железа.
Растворы солей железа (II) окрашены в бледно – зеленый цвет.
Рассмотренная реакция наиболее характерна для Fe 2+
Растворы солей железа (III) имеют желтую окраску.
1. Роданид аммония NH4SCN или калия KSCN дает с ионами Fe 3+
кроваво – красное окрашивание роданидов железа.
Fe 3+ + 3 SCN — = Fe(SCN)3 или [Fe(SCN)6] 3-
Интенсивность окраски пропорциональна концентрации ионов Fe 3+ . Состав продуктов реакции зависит от концентрации роданида.
Это одна из важнейших и наиболее чувствительных реакций на Fe 3+ . Роданидным методом можно определить 0,05 – 2,00 мг Fe 3+ в 1 л воды. Предел обнаружения 0,05 мг/л.
Однако она не всегда надежна, так как ряд веществ, в частности ионы F — , образуют более прочные комплексы, которые мешают появлению окраски. (Кнест.[Fe(SCN)6] 3- = 5,9 ∙ 10 — 4 , Кнест .[FeF4] — = 4,8 ∙ 10 — 16 )
Качественные определения с приближенной количественной оценкой.
Ход работы: В пробирку наливают 10 мл исследуемой воды, 2 капли концентрированной HCl, несколько кристаллов персульфата аммония (NH4)2S2O8 и 0,2 мл 50%-ного NH4SCN. После внесения каждого реактива содержимое пробирки перемешивают. Приближенную массовую концентрацию общего содержания железа в воде определяют в соответствии с таблицей №1.
Окрашивание при рассмотрении сбоку
Окрашивание при рассмотрении сверху вниз
Едва заметное желтовато – розовое
Очень слабое желтовато – розовое
Очень слабое желтовато – розовое
Слабое желтовато – розовое
Слабое желтовато – розовое
Светло желтовато – розовое
Светло – желтовато – розовое
Сильное желтовато – розовое
Светло – желтовато – красное
Результаты опытов записать в виде таблицы:
источник
Региональной особенностью состава вод Тюменской области является повышенное содержание железа. Ограничение на содержание железа в питьевой воде введено в СанПиН и по органолептическим признакам имеет ПДК равным 0,3 мг/л. На большинстве территории региона зарегистрированы высокие концентрации железа в питьевой воде (от 0,32 до 2,38 мг/л), в наиболее неблагоприятном положении находится северо-восточный район области. Повышенное содержание железа в водах Тюменской области отмечается на протяжении всего года, максимальная концентрация регистрировалась в зимний период и составляла 3,0 мг/л, что превышало ПДК в 10 раз, а в осенний период обнаруживалось до 5ПДК, что соответствовало годовому минимуму [1].
Вода, в которой железо содержится в концентрациях 1,0–1,5 мг/л и более, имеет желтовато-бурую окраску, повышенную мутность, выраженный привкус железа, поэтому является непригодной для питья. Но даже в менее низких концентрациях железо может причинить значительный вред бытовой и промышленной технике. Так уже при содержании общего железа 0,5 мг/л начинается интенсивное образование рыхлого шлама из хлопьевидных осадков в системах водоснабжения. Употребление воды с избыточным содержанием железа приводит к неблагоприятному воздействию на кожу, влияет на морфологический состав крови и может являться причиной возникновения аллергических реакций. При длительной перегрузке организма железом происходит его отложение в тканях, которое носит очаговый или генерализованный характер (гемосидероз). Если общее содержание железа в организме превышает 15 г, то поражаются внутренние органы. Такое состояние называется гемохроматозом [2]. Именно поэтому проблема загрязнения источников централизованного водоснабжения и обеспечение населения качественной питьевой водой на данный момент является одной из наиболее сложных современных проблем.
Главным источником железа в поверхностных водах являются процессы выветривания горных пород. К числу пород, подверженных процессам выветривания, относятся песчано-гравийные и глинистые материалы, содержащие большое количество железистых соединений. Для определения наиболее рационального метода удаления железа, необходимо выявить формы его существования в природных водах [3].
Железо в природных водах может находиться в виде двух- и трехвалентных ионов, коллоидов органического и неорганического происхождения, таких как ?Fe(OH)?_3, FeS, ?Fe(OH)?_2, комплексных соединений с гуматами и фульвокислотами, а также в виде тонкодисперсной взвеси.
Итак, в природных водах встречается несколько форм железа, к каждой из которых необходимо применять свою специфику очистки:
Элементарное железо (Fe0). Нерастворимо в воде, в присутствии кислорода воздуха или влаги окисляется до Fe2O3, образуя ржавчину.
Железо двухвалентное (Fe2+). Преимущественно встечается там, где нет кислорода воздуха и довольно высокое содержание углекислоты, т.е. главным образом в подземных водах. Его соединения хорошо растворимы. При окислении выпадает в красно-бурый осадок.
Гидроксид железа (III). При нейтральном pH и выше не растворяется в воде, может находиться как в коллоидном состоянии, так и выпадать в осадок красно-бурого цвета.
Хлорид железа (FeCl3), сульфат железа (Fe2(SO4)3) – соли железа III, хорошо растворимы в воде [4].
Органическое железо. Наибольшую роль в образовании органического железа играют гумусовые вещества, образуя с ним сложные комплексы и коллоидные структуры. Очистка от коллоидного железа является наиболее трудной задачей из всех прочих.
Определение ионов железа (III) методом титрования основано на взаимодействии их с SCN–, сопровождающимся образованием железороданидных комплексов, окрашивающих раствор в кроваво-красный цвет, тем более интенсивный, чем больше содержалось в растворе. К недостаткам этого метода относится то, что в зависимости от содержания в растворе состав комплексов может быть различным.
Эта реакция весьма чувствительна и позволяет определить железо при содержании его в растворе 10–7 г/мл.
Нами в лабораторных условиях был проведен количественный анализ пробы питьевой воды на содержание ионов железа. Проба была взята по адресу: г. Тобольск мкр. Левобережье.
В коническую колбу поместили 100 мл исследуемой пробы воды, прибавили 2мл концентрированной соляной кислоты, 2 мл роданида калия, 1 г персульфата аммония и тщательно взболтали. В ходе реакции наблюдалось изменение цвета раствора на красный.
В другой такой же колбе был приготовлен контрольный раствор. Для этого в колбу налили 100 мл дистиллированной воды, прибавили 2 мл концентрированной соляной кислоты, 2 мл роданида калия, 1 г персульфата аммония и также тщательно взболтали. Изменение окраски раствора не наблюдалось, вследствие отсутствия в нем ионов железа.
К контрольному раствору, содержащему все употребляемые реактивы, но не содержащему железа, добавили из микробюретки по каплям, при энергичном помешивании, стандартный раствор ионов железа. Титрование вели до тех пор, пока окраска контрольного раствора не сравнялась с окраской анализируемого раствора. Количество добавленного из микробюретки стандартного раствора ионов железа составило 21 мл [5].
Зная количество добавленного из микробюретки стандартного раствора ионов железа, вычислили содержание ионов железа в анализируемом растворе. Расчет проводили по формуле:
,
где VT – объем стандартного железа; V1 – объем исследуемой воды.
мг/л.
Таким образом, по результатам анализа можно сделать вывод, что концентрация железа в исследуемой пробе превышает ПДК в 70 раз. Полученные в результате анализа данные свидетельствуют о том, что проблема загрязнения источников централизованного водоснабжения и обеспечение населения качественной питьевой водой является актуальной в г. Тобольске и Тюменской области в целом. Население вынуждено употреблять питьевую воду, несоответствующую нормативным требованиям, что может негативно сказаться на состоянии здоровья.
источник
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Методы измерения массовой концентрации
Methods for determination
Настоящий стандарт распространяется на питьевую воду и устанавливает колориметрические методы измерения массовой концентрации общего железа.
1.1. Пробы воды отбирают по ГОСТ 2874 и ГОСТ 24481.
1.2. Объем пробы воды для измерения массовой концентрации железа должен быть не менее 200 см 3 .
1.3. Способы консервирования, сроки и условия хранения проб воды, предназначенных для измерения массовой концентрации общего железа, — по ГОСТ 24481.
(Измененная редакция, Изм. № 2).
Метод основан на взаимодействии ионов железа в щелочной среде с сульфосалициловой кислотой с образованием окрашенного в желтый цвет комплексного соединения. Интенсивность окраски, пропорциональную массовой концентрации железа, измеряют при длине волны 400-430 нм. Диапазон измерения массовой концентрации общего железа без разбавления пробы 0,10-2,00 мг/дм 3 . В этом интервале суммарная погрешность измерения с вероятностью Р=0,95 находится в пределах 0,01-0,03 мг/дм 3 .
Фотоколориметр любого типа с фиолетовым светофильтром ( 
Кюветы с толщиной рабочего слоя 2-5 см.
Весы аналитические лабораторные, класс точности 1, 2 по ГОСТ 24104.
Колбы мерные 2-го класса, вместимостью 50, 100, 1000 см 3 по ГОСТ 1770.
Пипетки мерные без делений вместимостью 50 см 3 и пипетки мерные с ценой наименьшего деления 0,1-0,05 см 3 , вместимостью 1, 5 и 10 см 3 2-го класса по нормативно-техническому документу.
Колбы стеклянные лабораторные конические номинальной вместимостью 100 см 3 , типа Кн по ГОСТ 25336.
Аммоний хлористый по ГОСТ 3773.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Квасцы железоаммонийные по нормативно-техническому документу.
Кислота соляная по ГОСТ 3118.
Кислота сульфосалициловая по ГОСТ 4478.
Вода дистиллированная по ГОСТ 6709.
Все реактивы, используемые для анализа, должны быть квалификации химически чистые (х. ч.) или чистые для анализа (ч.д.а).
2.3.1. Приготовление основного стандартного раствора железо-аммонийных квасцов
0,8636 г железоаммонийных квасцов FeNH 4 ( SO 4 )2 × 12 H 2 O взвешивают с точностью, не превышающей 0,0002 г по шкале весов, растворяют в мерной колбе вместимостью 1 дм 3 в небольшом количестве дистиллированной воды, добавляют 2,00 см 3 соляной кислоты плотностью 1,19 г/см 3 и доводят до метки дистиллированной водой. 1 см 3 раствора содержит 0.1 мг железа.
Срок и условия хранения раствора — по ГОСТ 4212.
2.3.2. Приготовление рабочего стандартного раствора железоаммонийных квасцов
Рабочий раствор готовят в день проведения анализа разбавлением основного раствора в 20 раз. 1 см 3 раствора содержит 0,005 мг железа.
2.3.3. Приготовление раствора сульфосалициловой кислоты
20 г сульфосалициловой кислоты растворяют в мерной колбе вместимостью 100 см 3 в небольшом количестве дистиллированной воды и доводят этой водой до метки.
2.3.4. Приготовление раствора хлористого аммония молярной концентрации 2 моль/дм 3
107 г NH 4 Cl растворяют в мерной колбе вместимостью 1 дм 3 в небольшом количестве дистиллированной воды и доводят этой водой до метки.
2.3.5. Приготовление раствора аммиака (1:1)
100 см 3 25 %-ного раствора аммиака приливают к 100 см 3 дистиллированной воды и перемешивают.
При массовой концентрации общего железа не более 2,00 мг/дм 3 отбирают 50 см 3 исследуемой воды (при большей массовой концентрации железа пробу разбавляют дистиллированной водой) и помещают в коническую колбу вместимостью 100 см 3 . Если проба при отборе не консервировалась кислотой, то к 50 см 3 добавляют 0,20 см 3 соляной кислоты плотностью 1,19 г/см 3 . Пробу воды нагревают до кипения и упаривают до объема 35-40 см 3 . Раствор охлаждают до комнатной температуры, переносят в мерную колбу вместимостью 50 см 3 , ополаскивают 2-3 раза по 1 см 3 дистиллированной водой, сливая эти порции в ту же мерную колбу. Затем к полученному раствору прибавляют 1,00 см 3 хлористого аммония, 1,00 см 3 сульфосалициловой кислоты, 1,00 см 3 раствора аммиака (1:1), тщательно перемешивая после добавления каждого реактива. По индикаторной бумаге определяют значение рН раствора, которое должно быть 
Объем раствора в мерной колбе доводят до метки дистиллированной водой, оставляют стоять 5 мин для развития окраски. Измеряют оптическую плотность окрашенных растворов, используя фиолетовый светофильтр ( 
Для построения градуировочного графика в ряд мерных колб вместимостью 50 см 3 наливают 0,0; 1,0; 2,0; 5,0. 10,0; 15,0; 20,0 см 3 рабочего стандартного раствора, доводят до метки дистиллированной водой, перемешивают и анализируют, как исследуемую воду. Получают шкалу растворов, соответствующих массовым концентрациям железа 0,0; 0,1; 0,2; 0,5; 1,0; 1,5; 2,0 мг/дм 3 .
Строят градуировочный график, откладывая по оси абсцисс массовую концентрацию железа, а по оси ординат — соответствующие значения оптической плотности. Построение градуировочного графика повторяют для каждой партии реактивов и не реже одного раза в квартал.
Массовую концентрацию железа (X) в анализируемой пробе, мг/дм 3 с учетом разбавления вычисляют по формуле
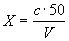
где с — концентрация железа, найденная по градуировочному графику, мг/дм 3 ;
V — объем воды, взятый для анализа, см 3 ;
50 — объем, до которого разбавлена проба, см 3 .
За окончательный результат анализа принимают среднее арифметическое результатов двух параллельных измерений, допустимое расхождение между которыми не должно превышать 25 % при массовой концентрации железа на уровне предельно допустимой. Результат округляют до двух значащих цифр.
Сходимость результатов анализа ( А) в процентах вычисляют по формуле
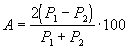
где Р1 — больший результат из двух параллельных измерений;
Р 2 — меньший результат из двух параллельных измерений.
Разд. 2. (Измененная редакция, Изм. № 2).
Метод основан на реакции ортофенантролина с ионами двухвалентного железа в области рН 3-9 с образованием комплексного соединения, окрашенного в оранжево-красный цвет. Интенсивность окраски пропорциональна концентрации железа. Восстановление железа до двухвалентного проводится в кислой среде гидроксиламином. Окраска развивается быстро при рН 3,0-3,5 в присутствии избытка фенантролина и устойчива в течение нескольких дней. Диапазон измерения массовой концентрации общего железа без разбавления пробы 0,05-2,0 мг/дм 3 . В этом интервале суммарная погрешность измерения с вероятностью Р = 0,95 находится в пределах 0,01-0,02 мг/дм 3 .
(Измененная редакция, Изм. № 2).
3.2. Аппаратура, материалы и реактивы
Фотоэлектроколориметр различных марок.
Кюветы с толщиной рабочего слоя 2-5 см.
Колбы мерные 2-го класса точности по ГОСТ 1770, вместимостью 50 и 1000 см 3 .
Пипетки мерные без делений, вместимостью 10, 25 и 50 см 3 и пипетки мерные с делениями 0,1-0,01 см 3 вместимостью 1, 2 и 5 см 3 2-го класса точности по нормативно-техническому документу.
Колбы плоскодонные по ГОСТ 25336, вместимостью 150-200 см 3 .
Аммоний уксуснокислый по ГОСТ 3117.
Гидроксиламин солянокислый по ГОСТ 5456.
Квасцы железоаммонийные по нормативно-техническому документу.
Кислота соляная по ГОСТ 3118.
Кислота уксусная по ГОСТ 61.
Вода дистиллированная по ГОСТ 6709.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.).
3.3.1. Приготовление раствора ортофенантролина
0,1 г моногидрата ортофенантролина ( C 12 Н8 N 2 × H 2 O ), взвешенного с погрешностью не более 0,01 г, растворяют в 100 см 3 дистиллированной воды, подкисленной 2-3 каплями концентрированной соляной кислоты. Реактив сохраняют на холоде в темной склянке с притертой пробкой. 1 см 3 этого реактива связывает в комплекс 0,1 мг железа.
3.3.2. Приготовление 10%-ного раствора солянокислого гидроксиламина
10 г солянокислого гидроксиламина ( NH 2 OH × HCl ), взвешенного с погрешностью не более 0,1 г, растворяют в дистиллированной воде и доводят объем до 100 см 3 .
3.3.3. Приготовление буферного раствора
250 г уксуснокислого аммония ( N Н4С2Н3 O 2 ), взвешенного с погрешностью не более 0,1 г, растворяют в 150 см 3 дистиллированной воды. Добавляют 70 см 3 уксусной кислоты и доводят объем до 1 дм 3 дистиллированной водой.
(Измененная редакция, Изм. № 2).
3.3.4. Приготовление основного стандартного раствора железоаммонийных квасцов — по п. 2.3.1.
3.3.5. Приготовление рабочего стандартного раствора железоаммонийных квасцов — по п. 2.3.2.
3.3.4; 3.3.5. (Измененная редакция, Изм. № 2).
Определению мешают цианиды, нитриты, полифосфаты; хром и цинк в концентрации, превышающей в 10 раз массовую концентрацию железа; кобальт и медь в концентрации более 5 мг/дм 3 и никель в концентрации 2 мг/дм 3 . Предварительное кипячение воды с кислотой превращает полифосфаты в ортофосфаты, добавлением гидроксиламина устраняется мешающее влияние окислителей. Мешающее влияние меди уменьшается при рН 2,5-4.
При отсутствии полифосфатов исследуемую воду тщательно перемешивают и отбирают 25 см 3 (или меньший объем, содержащий не более 0,1 мг железа, разбавленный, до 25 см 3 дистиллированной водой) в мерную колбу вместимостью 50 см 3 . Если при отборе пробы вода была подкислена, то ее нейтрализуют 25 %-ным раствором аммиака до рН 4-5, контролируя потенциометрически или по индикаторной бумаге. Затем добавляют 1 см 3 солянокислого раствора гидроксиламина, 2,00 см 3 ацетатного буферного раствора и 1 см 3 раствора ортофенантролина. После прибавления каждого реактива раствор перемешивают, затем доводят объем до 50 см 3 дистиллированной водой, тщательно перемешивают и оставляют на 15-20 мин для полного развития окраски.
Окрашенный раствор фотометрируют при сине-зеленом светофильтре ( 
Массовую концентрацию железа находят по градуировочному графику.
В присутствии полифосфатов 25 см 3 исследуемой пробы помещают в плоскодонную колбу вместимостью 100-150 см 3 , прибавляют 1 см 3 концентрированной соляной кислоты, нагревают до кипения и упаривают до объема 15-20 см 3 . После охлаждения раствора его переносят в мерную колбу вместимостью 50 см 3 , добавляют дистиллированную воду до объема примерно 25 см 3 и доводят 25 %-ным раствором аммиака до рН 4-5, контролируя потенциометрически или по индикаторной бумаге.
Далее прибавляют реактивы и проводят анализ, как указано выше (при отсутствии полифосфатов).
Для построения градуировочного графика в мерные колбы вместимостью 50 см 3 вносят 0,0; 0,5; 1,0; 2,0; 3.0; 4,0; 5,0; 10,0; 20,0 см 3 рабочего стандартного раствора, содержащего в 1 см 3 0,005 мг железа, доводят объем дистиллированной водой приблизительно до 25 см 3 и анализируют так же, как и исследуемую воду. Получают шкалу стандартных растворов с массовой концентрацией железа 0,0; 0,05; 0,1; 0,2; 0,3; 0,4; 0,5; 1,0 и 2,0 мг/дм 3 . Фотометрируют в тех же условиях, что и пробу. Строят градуировочный график, откладывая по оси абсцисс массовую концентрацию общего железа в мг/дм 3 а на оси ординат — соответствующие значения оптической плотности.
(Измененная редакция, Изм. № 2).
3.5. Массовую концентрацию общего железа вычисляют по п. 2.5.
(Измененная редакция, Изм. № 2).
Метод основан на взаимодействии ионов двухвалентного железа с 2,2-дипиридилом в области рН 3,5-8,5 с образованием окрашенного в красный цвет комплексного соединения. Интенсивность окраски пропорциональна массовой концентрации железа. Восстановление трехвалентного железа до двухвалентного проводится гидроксиламином. Окраска развивается быстро и устойчива в течение нескольких дней. Диапазон измерения массовой концентрации общего железа без разбавления пробы 0,05-2,00 мг/дм 3 .
В этом интервале суммарная погрешность измерения с вероятностью Р=0,95 находится в пределах 0,01-0,03 мг/дм 3 .
(Измененная редакция, Изм. № 2).
4.2. Аппаратура, материалы, реактивы
Фотоэлектроколориметр любой марки.
Кюветы с толщиной оптического слоя 2-5 см.
Колбы мерные 2-го класса точности по ГОСТ 1770, вместимостью 50, 100 и 1000 см 3 .
Пипетки мерные без делений, вместимостью 25 см 3 н пипетки мерные с делениями 0,1-0,01 см 3 , вместимостью 1, 5 и 10 см 3 2-го класса точности по нормативно-техническому документу.
Аммоний уксуснокислый по ГОСТ 3117.
Гидроксиламин солянокислый по ГОСТ 5456.
2,2-дипиридил ( 
Квасцы железоаммонийные по нормативно-техническому документу.
Кислота уксусная по ГОСТ 61.
Спирт этиловый ректификованный по ГОСТ 18300, высшего сорта.
Вода дистиллированная по ГОСТ 6709.
Все реактивы, используемые для анализа, должны быть квалификации химически чистые (х. ч.) или чистые для анализа (ч. д. а.).
(Измененная редакция, Изм. № 2).
4.3.1. Приготовление основного стандартного раствора железоаммонийных квасцов — по п. 2.3.1.
4.3.2. Приготовление рабочего стандартного раствора железоаммонийных квасцов — по п. 2.3.2.
4.3.1; 4.3.2. (Измененная редакция, Изм. № 2).
4.3.3. Приготовление 10 %-ного раствора солянокислого гидроксиламина — по п. 3.3.2.
4.3.4. Приготовление ацетатного буферного раствора — по п. 3.3.3.
4.3.5. Приготовление 0,1 %-ного раствора 2,2-дипиридила.
0,1 г 2,2-дипиридила, взвешенного с погрешностью не более 0,01 г, растворяют в 5,00 см 3 этилового спирта и разбавляют в 100 см 3 дистиллированной воды.
Для определения массовой концентрации общего железа исследуемую воду тщательно перемешивают и отбирают 25 см 3 (или меньший объем, содержащий не более 0,1 мг железа) в мерную колбу вместимостью 50 см 3 . Прибавляют 1 см 3 раствора гидроксиламина солянокислого, 2,00 см 3 ацетатного буферного раствора, 1,00 см 3 раствора 2,2-дипириднла и доводят до метки дистиллированной водой. После добавления каждого реактива содержимое колбы перемешивают. Раствор оставляют на 15-20 мин для полного развития окраски. Окрашенный раствор фотометрируют, применяя зеленый светофильтр ( 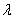
Массовую концентрацию железа находят по градуировочному графику.
Для построения градуировочного графика в мерные колбы вместимостью 50 см 3 вносят 0,0; 2,0; 5,0; 10,0; 15,0; 20,0 см 3 рабочего стандартного раствора железоаммонийных квасцов. Добавляют дистиллированной воды до объема примерно 25 см 3 . Далее растворы проводят через весь ход анализа так же, как исследуемую воду. Получают шкалу стандартных растворов с массовой концентрацией железа 0,0; 0,2; 0,5; 1,0; 1,5; 2,0 мг/дм 3 . Оптическую плотность измеряют в тех же условиях, что и пробы. Строят градуировочный график, откладывая по оси абсцисс массовую концентрацию железа в мг/дм 3 , а по оси ординат — соответствующие значения оптической плотности.
Массовую концентрацию общего железа вычисляют по п. 2.5.
4.3.5; 4.4; 4.5. (Измененная редакция, Изм. № 2).
1. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 09.10.72 № 1855
3. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
источник
Ржавые потеки на раковине, унитазе или пластиковом трубопроводе свидетельствуют о том, что в воде присутствует железо, которое, окисляясь на воздухе, оставляет после себя следы соответствующего цвета.
Железо присутствует в природной воде изначально и человек употребляет его с водой. Плохо это или хорошо, когда «хорошо» переходит в «плохо», как определить этот предел количественно – ответы на эти и другие вопросы вы узнаете из этой статьи.
Врачи давно обратили внимание на то обстоятельство, что причиной усталости и плохого настроения, как правило, является дефицит железа в организме.
Дефицит этого важного для здоровья микроэлемента наблюдается у людей обоих полов в разные периоды жизни. Поэтому если вы замечаете, что у вас часто меняется настроение, и для этого нет видимых причин, то необходимо начать прием железосодержащих продуктов или препаратов.
Помимо того, что железо влияет на трудоспособность и настроение человека, оно имеет ряд других преимуществ:
- Железо является наиважнейшим элементом, участвующим в процессе формирования гемоглобина. Учитывая, что ежедневно происходит потеря большого количества железа в виде пота, мочи и кровотечений (например, менструальные выделения или порезы во время бритья), становится понятным, что это сказывается на качестве и количестве крови. Кроме того, железо участвует в транспортировки кислорода в клетки организма, что важно для правильного функционирования органов.
- Если в организме чувствуется недостаток железа, то мышцы становятся слабыми и дряблыми. Для спортсменов железо является важной составляющей эффективной тренировки. Железо помогает мышцам восстановиться в кратчайшие сроки.
- Мозг, так же как и мышцы, зависит от количества получаемого организмом железа. Если его недостаточно, то кровь не получает необходимого количества кислорода, от чего в первую очередь страдают мозговые клетки. Если же кислорода достаточно, то улучшается память, появляется стремление к новым знаниям. Врачи убеждены, что дефицит железа может повлиять на психическое здоровье человека.
- Крепкий иммунитет напрямую зависит от железа. Частые заболевания простудой и гриппом, сопровождающиеся упадком сил и вялостью, свидетельствуют о том, что организму не хватает этого микроэлемента. Чем ниже уровень железа, тем чаще приходится бороться за свое здоровье.
- Модницы давно поняли, что невозможно считаться красивой без ухоженных волос, чистой кожи и крепких ногтей. И если кератин временно делает волосы блестящими, то кожа и ногти будут выглядеть тусклыми и безжизненными без необходимого для их красоты железа.
- Железо помогает тем, кто хочет избавиться от лишнего веса либо желает держать его под контролем. Если его недостаточно, то организм не будет тратить энергию на сжигание жира, и ни диеты, ни тренировки не приведут к нужному результату.
Поэтому важно вовремя выявить этот избыток и устранить его. Как это сделать самостоятельно — читайте далее.
При высоком содержании в воде серной и соляной кислоты на вымытой посуде остаются зеленые или бурые пятна. Также о неудовлетворительном качестве воды говорит ее запах: рыбный, землистый или древесный. Это значит, что в своем составе она содержит органические соединения.
Если на серебряной посуде и на раковине остаются темноватые пятна, то вода из вашего крана содержит сероводород.
Возникновение пены при наливании воды в алюминиевую посуду говорит об избыточной концентрации щелочных соединений в ней.
Довольно часто встречающийся признак загрязненной воды – ее металлический привкус, показывающий высокое содержание в ней железа. А вода с красноватым и бурым оттенком свидетельствует о том, что ваш водопровод ржавый и старый, поэтому в трубах происходит окисление воды железом.
Мутная и грязная вода означает, что в ней содержится большое количество воздуха или метана.
Во многих городах существуют СЭС или мобильные лаборатории, изучающие качество воды, имеющие возможность проводить экспресс анализ воды на железо. Вы можете связаться с такой лабораторией и заказать анализ воды в вашем доме. Вам будет дан полный и точный ответ по этому вопросу.
В аккредитованных лабораториях проводится анализ воды на железо по ГОСТ 4011, который регламентирует порядок определения в воде двухвалентного железа (которое окисляется до ржавчины F2O3) и на общее железо.
Анализ воды на железо из скважины лучше всего производить непосредственно на месте, так как хранение и транспортировка образцов для анализа может привести к окислению железа при доступе воздуха и к выпадению окисла в осадок.
Если необходимо выполнить анализ воды на железо в лаборатории, отбираются пробы. Для проведения анализа потребуется не менее полутора литров воды, которые должны быть отобраны в чистую стеклянную или пластиковую тару. Очень важно, чтобы тара была чистой и не содержала остатков (даже запаха) жидкостей, которые в ней хранились. Хорошей посудой для отбора проб для анализа будет пластиковая бутылка от негазированной минеральной воды. Образец доставляется в лабораторию в течении двух часов.
Наиболее существенным в практическом значении является анализ воды на железо-ионы, потому что именно они влияют на образование накипи на посуде и нагревательных ТЭНах. И потеки ржавчины на сантехнике, в большей степени, зависят от активного железа, которое окисляется в воздушной среде.
Польза железа в воде для организма неоспорима, поэтому полностью избавляться от него с помощью фильтрации так же не стоит. Идеально очищенную с помощью обратного осмоса воду для этого специально минерализуют. Остаток железа в воде определяет анализ воды на общее железо.
Смягчать воду для бытовых нужд, безусловно, нужно (борьба с накипью, солями тяжелых металлов и азотными соединениями), но к содержанию в воде железа следует относиться бережно. Выдержать паритет в этом вопросе поможет своевременный и качественный анализ воды на железо, произведенный аккредитованной лабораторией.
источник
Настоящий документ устанавливает методику измерений общего железа в питьевых, поверхностных и сточных водах фотометрическим методом с сульфосалициловой кислотой.
Диапазон измерений от 0,05 до 10 мг/дм 3 без разбавления и концентрирования пробы.
Если массовая концентрация железа общего в анализируемой пробе превышает 10,0 мг/дм 3 , необходимо разбавлять пробу таким образом, чтобы массовая концентрация железа общего соответствовала регламентированному диапазону.
Если массовая концентрация железа общего в анализируемой пробе ниже 0,1 мг/дм 3 , пробу необходимо концентрировать путем упаривания.
Мешающие влияния, обусловленные присутствием в пробе органических веществ, нитритов, полифосфатов и др. устраняется специальной подготовкой пробы (см. п. 9.1).
При наличии в анализируемой пробе ионов хрома и цинка в количествах, превышающих в 10 раз концентрацию железа общего; меди и кобальта при массовых концентрациях, превышающих 2,0 мг/дм 3 , следует использовать другую методику.
Значения показателя точности измерений 1 — расширенной относительной неопределенности измерений по настоящей методике при коэффициенте охвата 2 приведены в таблице 1. Бюджет неопределенности измерений приведен в Приложении А.
1 В соответствии с ГОСТ Р 8.563-2009 (п. 3.4) в качестве показателя точности измерений использованы показатели неопределенности измерений).
Значения показателя точности методики используют при:
— оформлении результатов измерений, выдаваемых лабораторией;
— оценке качества проведения испытаний в лаборатории;
— оценке возможности использования настоящей методики в конкретной лаборатории.
Таблица 1 — Диапазон измерений, показатели неопределенности измерений
Суммарная стандартная относительная неопределенность, и, %
Расширенная относительная неопределенность 2 , U при коэффициенте охвата k = 2, %
2 Соответствует характеристике погрешности при доверительной вероятности Р = 0,95.
При выполнении измерений должны быть применены следующие средства измерений, оборудование и материалы:
3.1 Средства измерений, вспомогательное оборудование
Спектрофотометр или фотоэлектроколориметр, позволяющий измерять оптическую плотность при длине волны l = 425 и l = 500 нм.
Кюветы с толщиной поглощающего слоя 10 и 50 мм.
Весы лабораторные специального класса точности с ценой деления не более 0,1 мг, наибольшим пределом взвешивания не более 210 г по ГОСТ Р 53228-2008.
Плитка электрическая лабораторная с регулятором температуры и закрытой спиралью по ГОСТ 14919-83.
Сушильный шкаф электрический.
Государственные стандартные образцы (ГСО) состава раствора ионов железа с массовой концентрацией 1 мг/дм 3 . Относительная погрешность аттестованных значений массовой концентрации не более 1 % при Р = 0,95.
1 Допускается использование других средств измерений утвержденных типов, обеспечивающих измерения с установленной точностью.
2 Допускается использование другого оборудования с метрологическими и техническими характеристиками, аналогичными указанным.
3 Средства измерений должны быть поверены в установленные сроки.
Колбы мерные 2-(2)-25 (50, 100, 1000)-2, ГОСТ 1770-74.
Бутыли из стекла или полиэтилена с притертыми или винтовыми пробками вместимостью 250 — 500 см 3 для отбора и хранения проб.
1 Допускается использование других средств измерений, вспомогательного оборудования, посуды и материалов с метрологическими и техническими характеристиками не хуже указанных.
2 Средства измерений должны быть поверены в установленные сроки.
Бумага индикаторная универсальная, ТУ 6-09-1181-89.
1 Все реактивы, используемые для измерений, должны быть квалификации ч.д.а. или х.ч.
2 Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных.
Фотометрический метод определения массовой концентрации общего железа основан на образовании сульфосалициловой кислотой или ее натриевой солью с солями железа окрашенных комплексных соединений, причем в слабокислой среде сульфосалициловая кислота реагирует только с солями железа ( III ) (красное окрашивание), а в слабощелочной среде — с солями железа (II) и железа (III) (желтое окрашивание).
Оптическую плотность окрашенного комплекса для железа общего измеряют при длине волны l = 425 нм, для железа (III) — при длине волны l = 500 нм.
При выполнении измерений необходимо соблюдать следующие требования техники безопасности.
5.1 При выполнении измерений необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007-76.
5.2 Электробезопасность при работе с электроустановками по ГОСТ Р 12.1.019-2009.
5.3 Организация обучения работающих безопасности труда по ГОСТ 12.0.004-90.
5.4 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83.
5.5 Содержание вредных веществ в воздухе не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005-88.
Выполнение измерений может производить химик-аналитик, владеющий техникой фотометрического анализа, изучивший инструкцию по эксплуатации спектрофотометра или фотоэлектроколориметра и получивший удовлетворительные результаты при выполнении контроля процедуры измерений.
Измерения проводятся в следующих условиях: температура окружающего воздуха (20 ± 5) ° С; атмосферное давление (84,0 — 106,7) кПа (630 — 800 мм рт.ст); относительная влажность не более 80 % при t = 25 °C; напряжение сети (220 ± 22) В; частота переменного тока (50 ± 1) Гц.
При подготовке к выполнению измерений должны быть проведены следующие работы: подготовка посуды для отбора проб, отбор проб, подготовка прибора к работе, приготовление вспомогательных и градуировочных растворов, установление и контроль стабильности градуировочной характеристики.
8.1 Подготовка посуды для отбора проб
Бутыли для отбора и хранения проб воды обезжиривают раствором CMC, промывают водопроводной водой, хромовой смесью, опять водопроводной водой, а затем 3 — 4 раза дистиллированной водой.
8 .2.1 Отбор проб питьевых вод производится в соответствии с требованиями ГОСТ Р 51593-2000 «Вода питьевая. Отбор проб».
Отбор проб поверхностных и сточных вод производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб», ПНД Ф 12.15.1-08 «Методические указания по отбору проб для анализа сточных вод».
8 .2.2 Пробы воды отбирают в бутыли из полимерного материала или стекла, предварительно ополоснутые отбираемой водой. Объем отбираемой пробы должен быть не менее 250 см 3 .
8 .2.3 Если анализ выполняется в течение суток, пробу отбирают не консервируя. При невозможности выполнения измерений в указанные сроки пробу консервируют одним из следующих способов:
— если необходимо определять сумму растворенной и нерастворенной форм железа, к пробе добавляют 2 см 3 концентрированной соляной кислоты или 2,5 см 3 концентрированной азотной кислоты на каждые 100 см 3 пробы;
— если необходимо определять железо растворенное, то отобранную пробу сразу фильтруют через мембранный фильтр (0,35 — 0,45 мкм), поместив в приемную колбу 1 см 3 концентрированной соляной кислоты на каждые 100 см 3 пробы.
8 .2.4 При отборе проб составляется сопроводительный документ по утвержденной форме, в котором указываются:
цель анализа, предполагаемые загрязнители;
должность, фамилия отбирающего пробу, дата.
Подготовку спектрофотометра или фотоэлектроколориметра к работе проводят в соответствии с рабочей инструкцией по эксплуатации прибора.
8.4 Приготовление растворов
20,0 г сульфосалициловой кислоты помещают в колбу и растворяют в 80 см 3 дистиллированной воды.
Смешивают равные части концентрированного аммиака и дистиллированной воды.
Навеску хлорида аммония (107 г) помещают в мерную колбу вместимостью 1000 см 3 , растворяют в дистиллированной воде и доводят до метки дистиллированной водой.
3 Приготовление градуировочных растворов из соли железа приведено в Приложении Б.
Раствор готовят в соответствии с прилагаемой к образцу инструкцией. 1 дм 3 раствора должен содержать 100 мг железа.
Срок хранения — один месяц.
Рабочий раствор готовят в день проведения измерений путем разбавлением основного раствора в 10 раз дистиллированной водой в мерной колбе. Раствор готовят в день проведения измерений.
8.5 Построение градуировочных графиков
Для построения градуировочных графиков необходимо приготовить образцы для градуировки с массовой концентрацией железа общего от 0,1 до 10,0 мг/дм 3 . Условия измерений и ход проведения анализа должны соответствовать п.п. 7 и 9.
Состав и количество образцов для построения градуировочных графиков приведены в таблице 2. Неопределенность, обусловленная процедурой приготовления образцов для градуировки, не превышает 2,5 %.
Таблица 2 — Состав и количество образцов для градуировки
Массовая концентрация ионов железа в градуировочных растворах в мг/дм 3
Аликвотная часть раствора (см 3 ), помещаемая в мерную колбу вместимостью 100 см 3
Рабочий градуировочный раствор с концентрацией 10 мг/дм 3 (градуировочный график 1, кювета 50 мм)
Основной градуировочный раствор с концентрацией 100 мг/дм 3 (градуировочный график 2, кювета 10 мм)
Анализ образцов для градуировки проводят в порядке возрастания их концентрации. Для построения градуировочного графика каждую искусственную смесь необходимо фотометрировать 3 раза с целью исключения случайных результатов и усреднения данных.
При построении градуировочного графика по оси ординат откладывают значения оптической плотности, а по оси абсцисс — величину концентрации вещества в мг/дм 3 .
Контроль стабильности градуировочной характеристики проводят не реже одного раза в квартал, а также при смене партий реактивов, после поверки или ремонта прибора. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в п. 8.6).
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
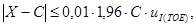
где X — результат контрольного измерения массовой концентрации железа в образце для градуировки;
С — аттестованное значение массовой концентрации железа;
u I(TOE) — стандартное отклонение результатов измерений, полученных в условиях промежуточной прецизионности, %.
Значения u I(TOE) приведены в Приложении А.
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
9.1.1 Измерению массовой концентрации железа с применением раствора сульфосалициловой кислоты мешает собственная окраска пробы. Если окраска пробы сохраняется после проведения пробоподготовки (п. 9.1.2), то окрашенную пробу обрабатывают по п. 9.2, но без добавления сульфосалициловой кислоты. Измеряют оптическую плотность и найденную величину вычитают из полученного результата.
9 .1.2 Для устранения мешающего влияния органических веществ пробу озоляют. При озолении пробы, в стакан из термостойкого стекла вместимостью 100 см 3 помещают аликвоту пробы в зависимости от содержания в ней железа (0,1 — 10,0 мг/дм 3 ). Последовательно прибавляют 2,0 и 5,0 см 3 концентрированной серной и азотной кислоты соответственно, накрывают часовым стеклом и кипятят смесь в вытяжном шкафу до появления густого белого дыма, после чего нагревание прекращают. Раствор охлаждают до комнатной температуры, разбавляют дистиллированной водой и нагревают до кипения для растворения труднорастворимых солей, фильтруют (в случае необходимости), переносят в мерную колбу вместимостью 100 см 3 и проводят измерения по п.п. 9.2 , 9.1 .
Если в обработке пробы по п. 9.1.2 нет необходимости, то к отобранному объему (100 см 3 и менее) добавляют 0,5 см 3 концентрированной азотной кислоты и упаривают раствор до 1 /3 объема.
Полученный раствор с концентрацией железа от 0,1 до 10,0 мг/дм 3 фильтруют через фильтр «белая лента» в мерную колбу вместимостью 100 см 3 , приливают 2,0 см 3 аммония хлористого (п. 8.4.3), 2,0 см 3 сульфосалициловой кислоты (п. 8.4.1), 2,0 см 3 аммиака (п. 8.4.2), рН раствора должен составлять 7 — 8 (по индикаторной бумаге). Доводят до метки дистиллированной водой. Тщательно перемешивают и оставляют на 5 минут до развития окраски. Оптическую плотность полученного раствора измеряют при длине волны l = 425 нм в кювете с длиной поглощающего слоя 50 или 10 мм по отношению к холостому раствору, проведенному с дистиллированной водой через весь ход анализа. По градуировочному графику находят содержание железа общего.
9.3 Определение железа (III)
Определение можно проводить только в тех случаях, когда пробу не обрабатывали с целью разрушения органических компонентов, не кипятили и не консервировали, т.к. при этом железо (II) окисляется до железа (III).
Пробу объемом 80,0 см 3 и менее, в зависимости от концентрации, помещают в мерную колбу вместимостью 100 см 3 , нейтрализуют раствором аммиака или соляной кислоты до рН 3 — 5 по индикаторной бумаге, прибавляют 2 см 3 сульфосалициловой кислоты (п. 8.4.1), доводят до метки дистиллированной водой. Тщательно перемешивают и оставляют на 5 мин до полного развития окраски.
Оптическую плотность полученного раствора измеряют при длине волны l = 500 нм в кювете с длиной поглощающего слоя 10 или 50 мм по отношению к холостому раствору, проведенному с дистиллированной водой через весь ход измерений. По градуировочному графику находят массовую концентрацию железа общего.
Массовую концентрацию железа рассчитывают по формуле:
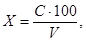
где X — массовая концентрация железа в анализируемой пробе, мг/дм 3 ;
С — массовая концентрация железа, найденная по градуировочному графику, мг/дм 3 ;
100 — объем, до которого была разбавлена проба, см 3 ;
V — объем, взятый для измерений, см 3 .
При необходимости за результат измерений Хср принимают среднее арифметическое значение двух параллельных определений Х1 и Х2
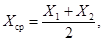
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 3.
Таблица 3 — Значения предела повторяемости при вероятности Р = 0,95
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
При невыполнении условия (4) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно раздела 5 ГОСТ Р ИСО 5725-6-2002.
Результат измерений в документах, предусматривающих его использование, может быть представлен в виде: X ± = 0,01 × U × X, мг/дм 3 ,
где X — результат измерений массовой концентрации, установленный по п. 10, мг/дм 3 ;
U — значение показателя точности измерений (расширенная неопределенность измерений с коэффициентом охвата 2).
Значение U приведено в таблице 1.
Допускается результат измерений в документах, выдаваемых лабораторией, представлять в виде: Х ± 0,01 × U л × X , мг/дм 3 , Р = 0,95, при условии U л U , где U л — значение показателя точности измерений (расширенной неопределенности с коэффициентом охвата 2), установленное при реализации методики в лаборатории и обеспечиваемое контролем стабильности результатов измерений.
При представлении результата измерений в документах, выдаваемых лабораторией, указывают:
— количество результатов параллельных определений, использованных для расчета результата измерений;
— способ определения результата измерений (среднее арифметическое значение или медиана результатов параллельных определений).
Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
— оперативный контроль процедуры измерений;
— контроль стабильности результатов измерений на основе контроля стабильности среднего квадратического отклонения (СКО) повторяемости, СКО промежуточной (внутрилабораторной) прецизионности и правильности.
Периодичность контроля исполнителем процедуры выполнения измерений и алгоритмы контрольных процедур, а также реализуемые процедуры контроля стабильности результатов измерений регламентируют во внутренних документах лаборатории.
Ответственность за организацию проведения контроля стабильности результатов измерений возлагают на лицо, ответственное за систему качества в лаборатории.
Разрешение противоречий между результатами двух лабораторий проводят в соответствии с 5.3.3 ГОСТ Р ИСО 5725-6-2002.
12.2 Оперативный контроль процедуры измерений с использованием метода добавок
Оперативный контроль процедуры измерений проводят путем сравнения результата отдельно взятой контрольной процедуры K к с нормативом.
Результат контрольной процедуры Кк рассчитывают по формуле:
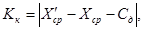
где 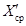
X ср — результат измерений массовой концентрации железа в исходной пробе — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (4).
Норматив контроля К рассчитывают по формуле
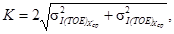
где 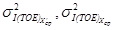
Процедуру измерений признают удовлетворительной, при выполнении условия:
При невыполнении условия (7) контрольную процедуру повторяют. При повторном невыполнении условия (7) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
12.3 Оперативный контроль процедуры измерений с использованием образцов для контроля
Оперативный контроль процедуры измерений проводят путем сравнения результата отдельно взятой контрольной процедуры Кк с нормативом контроля К.
Результат контрольной процедуры Кк рассчитывают по формуле:
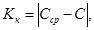
где Сср — результат измерений массовой концентрации железа в образце для контроля — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (4);
С — аттестованное значение образца для контроля.
Норматив контроля К рассчитывают по формуле
где s I(TOE) — стандартное отклонение промежуточной прецизионности, соответствующие массовой концентрации железа в образце для контроля, мг/дм 3 .
Процедуру измерений признают удовлетворительной, при выполнении условия:
При невыполнении условия (10) контрольную процедуру повторяют. При повторном невыполнении условия (10) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Расхождение между результатами измерений, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата измерений, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 4.
Таблица 4 — Значения предела воспроизводимости при вероятности Р = 0,95
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов измерений согласно раздела 5 ГОСТ Р ИСО 5725-6-2002.
Таблица А.1 — Бюджет неопределенности измерений
Стандартная относительная неопределенность 4 , %
Приготовление градуировочных растворов, u1, %
Степень чистоты реактивов и дистиллированной воды, и2, %
Подготовка проб к анализу, и3, %
Стандартное отклонение результатов измерений, полученных в условиях повторяемости 5 , иr ( s r), %
Стандартное отклонение результатов измерений, полученных в условиях промежуточной прецизионности 5 , uI(TOE) ( s I(TOE)), %
Стандартное отклонение измерений полученных в условиях воспроизводимости, uR( s R), %
Суммарная стандартная относительная неопределенность, ис, %
Расширенная относительная неопределенность, (Uomн.) при k = 2, %
1 Оценка (неопределенности) типа А получена путем статистического анализа ряда наблюдений.
2 Оценка (неопределенности) типа В получена способами, отличными от статистического анализа ряда наблюдений.
4 Соответствует характеристике относительной погрешности при доверительной вероятности Р = 0,95.
5 Согласно ГОСТ Р ИСО 5725-3-2002 учтено при расчете стандартного отклонения результатов измерений, получаемых в условиях воспроизводимости.
Б.1 Приготовление основного градуировочного раствора из соли железа с концентрацией 100 мг/дм 3
Навеску железоаммонийных квасцов 0,8634 г помещают в мерную колбу вместимостью 1 дм 3 , растворяют в дистиллированной воде, прибавляют 2 см 3 концентрированной соляной кислоты и доводят дистиллированной водой до метки.
Срок хранения — один месяц.
Б.2 Приготовление рабочего стандартного раствора с концентрацией 10 мг/дм 3 из основного градуировочного раствора
Рабочий градуировочный раствор готовят в день проведения измерений разбавлением основного стандартного раствора в 10 раз дистиллированной водой.
источник