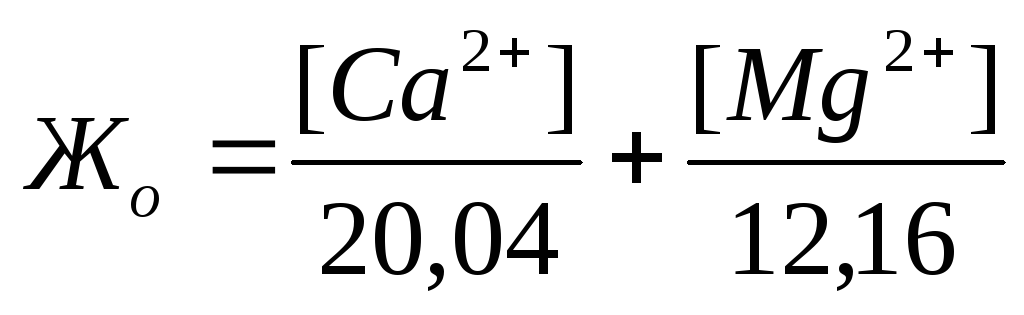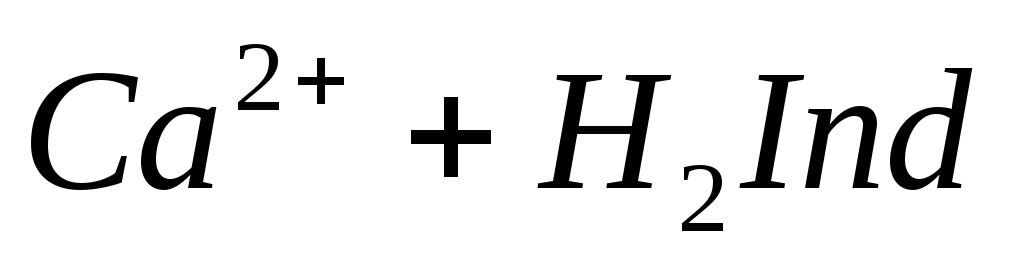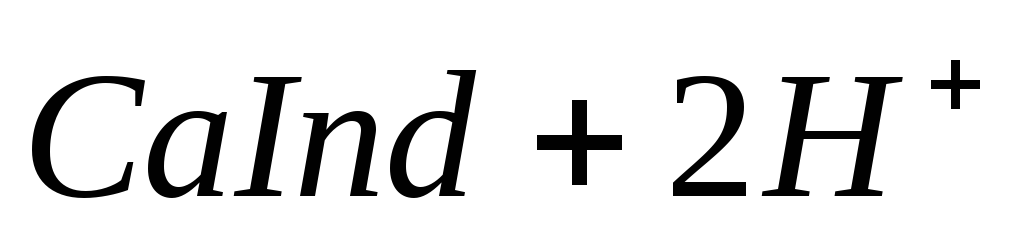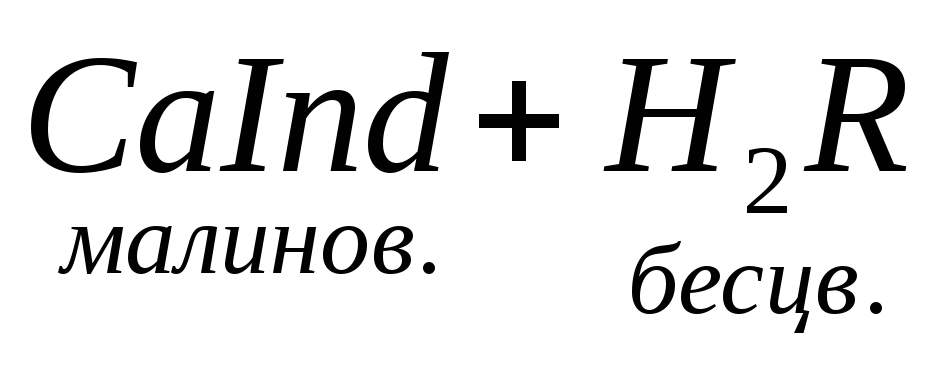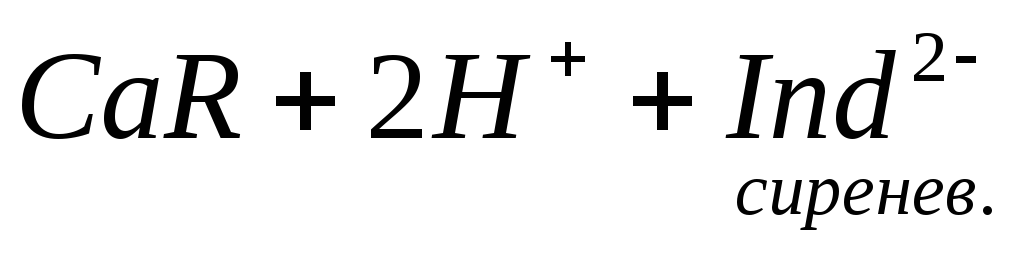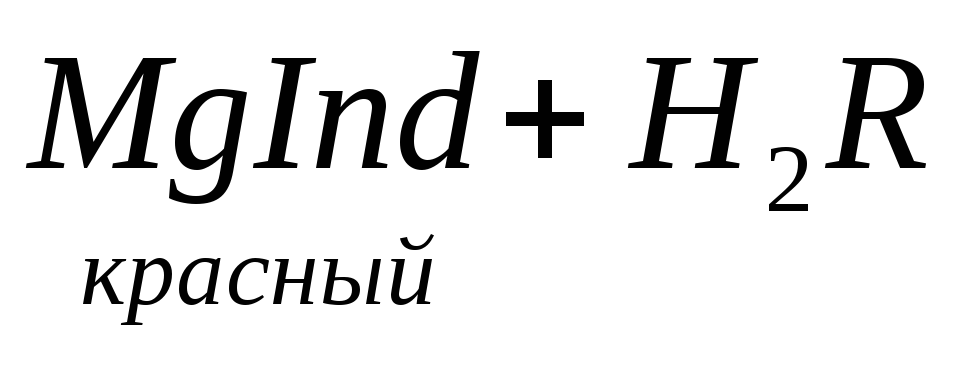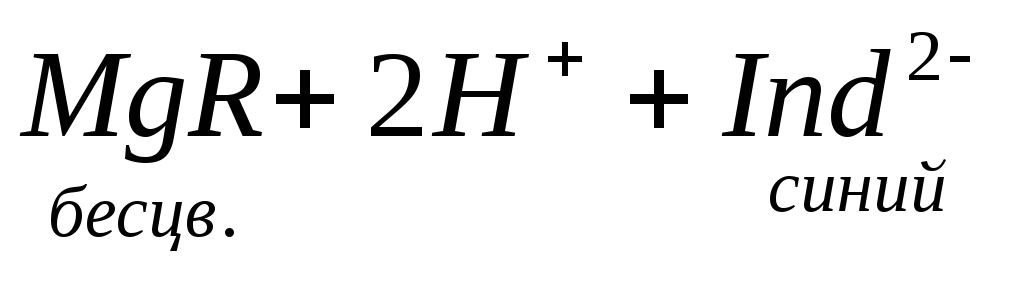Вода – это самое необходимое, что нужно человеку, да и не только ему, для жизни. А чистая вода – это, в первую очередь, наше здоровье. Развитие цивилизации привело к тому, что чистая вода становится дефицитом.
Устраивая загородный дом наподобие городской квартиры, с водопроводом и канализацией, мало кто задумывается об очистке канализационных стоков, и зря.
Ведь сточные воды, попадая в землю, поступают в водоносные слои, откуда мы берем питьевую воду. И кто знает, что находится в такой воде? Если домовладелец заботится о своем здоровье и здоровье близких людей, он должен периодически делать анализ сточных вод.
Сточные воды частного дома по общему определению – это воды, загрязненные в процессе деятельности человека, а также воды, проникающие в грунт, в результате выпадения атмосферных осадков.
Попадая в землю, сточные воды способны изменить состав подземных вод, которые мы употребляем в качестве питьевой воды. Вода может приобрести неприятный запах, изменяется чистота воды, т.е. в ней могут появиться различные примеси и осадок. Кроме этого изменяется и химический состав воды.
Характер загрязнения грунтовых вод можно разделить на такие виды:
- Механическое – когда в сточных водах высокое содержание нерастворимых частиц;
Загрязненные сточные воды представляют опасность для здоровья не только владельца участка, но и для соседних участков.
Проведение химического анализа полного типа является первоочередной задачей каждого владельца местной канализационной системы.
В настоящее время существует возможность как провести любой анализ, так и принять все меры к очистке сточных вод, сохраняя при этом не только свое здоровье, но и окружающую природу.
Чтобы с полной уверенностью в безопасности сточных вод пользоваться своей автонономной канализационной системой в загородном доме, необходимо знать состав этих вод.
Определяется это путем проведения многочисленных анализов:
Полный химический анализ сточных вод необходим для выбора оптимальной системы водоочистки. Но иногда возможен и анализ сокращенного типа. Вообще, анализы, даже проводимые несколько десятков раз, не могут представить полной и точной картины сточных вод. Все выводы, в принципе, условны.
При проведении полного химического анализа сточных вод определяют:
- Окраску сточных вод, Обычно бытовые сточные воды имеют слабую окраску. Если она изменяется на сильно выраженную, значит, сточные воды нуждаются в сильной очистке;
- Запах сточных бытовых вод своеобразен. Получается от распада органических соединений и фекалий;
- Температуру. Это показатель говорит о том, насколько быстро происходит биологическая очистка стоков;
- Прозрачность, которая служит показателем степени загрязнения стоков;
- Уровень pH в сточных водах, отвечающих нормам, должен быть нейтральным;
- Плотный осадок, который не должен превышать 10г/л;
- Значения ХБК и БПК (химическая потребность в кислороде и биологическая потребность в кислороде);
- Токсичность сточных вод, что является отрицательным показателем, так как при превышении нормы бактерии плохо справляются с очисткой стоков. К токсичным веществам, относятся многие моющие вещества, красители, медь, ртуть, кадмий, сульфиды, цианиды и другие вещества;
- Взвешенные вещества, которые в норме должны составлять 100-500мг/л;
- Формы азота, фосфор;
- Хлориды, сульфаты;
- Растворенный кислород, который необходим для жизнедеятельности бактерий;
- Биологические загрязнения.
При проведении анализов на сточные воды ГОСТ полученные результаты разделяет на два вида: предельно допустимые концентрации и недопустимые, т. е. именно то, чего не должно быть, и что является поводом для немедленного принятия соответствующих мер.
К недопустимым концентрациям загрязнения сточных вод относятся цианиды, некоторые щелочи и соли, соляная и серная кислоты.
Естественно, что такие анализы могут сделать только специализированные лаборатории, которые имею лицензию на проведение таких анализов для населения.
Многие владельцы загородных домов не задумываются о последствиях своей экономии, когда решают сделать вместо септика простую выгребную яму. Им стоит сделать анализ своей питьевой воды, если она поступает из скважины или колодца, расположенных в непосредственной близости от выгребной ямы. В этом случае можно с уверенностью сказать, что анализ питьевой воды будет далек от нормативных показателей. Есть риск заражения глистными инвазиями и другими инфекционными болезнями.
Кроме этого, водоносный слой, который подвергся заражению сточными водами, потребует десятилетних усилий по его очистке
И напротив, тем, у кого на участке оборудован по всем правилам канализационный септик, не стоит опасаться отрицательного анализа сточных вод, поскольку продуманная система устройства септика, в комплексе с применением биологической очистки сточных вод, даст положительные результаты в анализах питьевой воды.
Это объясняется тем, что сточные воды, находясь длительное время в первой камере септика, освобождаются от взвешенных частиц, которые выпадают в осадок.
Во второй камере происходит дальнейшая очистка и фильтрация стоков. И сбрасываемые воды в дренажный колодец или в грунт, уже, практически, безопасны для окружающей природы. По статистике проведенных анализов, лучшие показатели у владельцев септиков, нежели у владельцев выгребных ям.
В настоящее время существует достаточно много способов биологической очистки сточных вод. Это и препараты, которые непосредственно выливаются в септики и станции биологической очистки, средства, где микробы выпускаются в септик по достижениию определенного уровня сточных вод в септике.
Но чтобы все эти способы работали безотказно, нужно знать, что в септике должен быть нормальный уровень кислорода для нормальной жизнедеятельности анаэробных бактерий.
В септике должен быть постоянно органический субстрат для микробов. При длительном отсутствии владельцев, микробы, не получая свежей порции органики, могут просто погибнуть.
Вывод напрашивается такой – сделать современный септик дело конечно сложное, но наше здоровье важнее, чем вложенные средства и физические усилия.
источник
| № исследования: | 2.1.12 |
| Срок выполнения: | 7 рабочих дней |
| Тип исследования: | Химический комплексный |
| Исследуемый материал: | Вода |
Испытательная лаборатория Лаб24 проводит исследования сточной воды на максимально допустимые значения нормативных показателей общих свойств сточных вод и концентраций загрязняющих веществ в сточных водах, установленных в целях предотвращения негативного воздействия на работу централизованных общесплавных и бытовых систем водоотведения, а также централизованных комбинированных систем водоотведения (применительно к сбросу в общесплавные и бытовые системы водоотведения) и состоит из 31 показателя, так же Вы можете дополнить данный комплекс любым показателем из Прайс-листа лаборатории, либо выбрать необходимые из списка.
Испытательная лаборатория ЛАБ 24 выполняет исследования сточной воды, в соответствии с ГОСТ и СанПиН, на современном аналитическом оборудовании, результатом является Протокол исследований, внесенный в Реестр протоколов испытаний ФГИС Росаккредитации. Протокол анализа имеет юридическую силу для предоставления в государственные органы и истребования доказательств в Суде .
11 вода приобретает характерную мылкость, неприятный запах, способна вызывать раздражение глаз и кожи. Низкий pH»>Водородный показатель (pН) в воде
Стоимость исследования не включает выезд специалиста и отбор проб.
Состав воды, наполняющей питьевой водопровод, и ее безопасность для здоровья, во многом зависит от качества стоков. Ведь они попадают на очистные сооружения, где важно правильно выбрать реактивы, эффективные для борьбы с именно теми веществами, концентрация которых превышает допустимые нормы. Анализ проб сточных вод, выполнить который можно в исследовательском центре «Лаб24», помогает успешно решать подобные проблемы.
Периодичность, с которой производятся анализы сточных вод, устанавливает принимающий их водоканал. Эта организация определяет и перечень показателей, на которые должна быть исследована проба. А вот ее отбор проводит уже предприятие, осуществляющее сбросы. Оно же заказывает анализ сточных вод в аккредитованной на это лаборатории.
Химический анализ сточных вод представляет собой комплекс испытаний предъявленных заказчиком образцов отбора по следующим показателям:
- Концентрации неорганических веществ в свободной форме или соединениях
- Уровню химического и биохимического потребления кислорода
- Содержанию взвесей
- Загрязненностью нефтепродуктами и жирами
- Температуре
Сделать анализ сточных вод на современном оборудовании, гарантирующем минимальный уровень погрешности исследований, предлагает «Лаб24». Его стоимость можно уточнить на сайте. После проведения испытаний станет абсолютно ясен химический состав стоков в образце. Результаты анализа будут отражены в итоговом заключении, принимаемом государственными разрешительными органами.
Несмотря на достаточно высокую стоимость, анализ сточной воды является одной из самых востребованных услуг, предоставляемых нашим центром. При необходимости, за дополнительную плату, мы можем произвести и отбор проб с выездом на место.
Результаты исследований можно получить одним из представленных ниже вариантов:
- в «личном кабинете» на сайте www.lab-24.ru;
- по электронной почте, указанной в заявке при сдаче проб в лабораторию;
- в офисе лаборатории;
- доставка курьером (дополнительная оплата);
- доставка курьерской службой (дополнительная оплата);
- получить результат можно на английском языке (перевод оплачивается дополнительно).
Результаты анализов доступны для получения любым указанным способом только с момента полной готовности всех заказанных лабораторных исследований
Компания «Лаб24», аккредитованная в Федеральной службе по аккредитации «Росаккредитация» имеет широкую область компетенций, что позволяет комплексно решать задачи, связанные с оценкой и анализом исследуемых объектов. Современное оборудование, а так же использование передовых методик, способные обеспечивать низкие пределы обнаружения, выдающееся качество данных и беспрецедентное обслуживание клиентов, является основополагающими принципами работы нашей компании. Наша миссия — предоставить аналитические услуги высшего качества, чтобы удовлетворить потребностям наших клиентов. Наша работа направлена на улучшение экологии, здоровья человека и принятие точных решений.
источник
Величина рН в воде водоемов хозяйственно-питьевого водопользования регламентируется в пределах 6,5 — 8,5. В большинстве природных вод рН составляет от 6,5 до 8,5 и зависит от соотношения концентраций свободного оксида углерода (IV) и HCO3 — . Более низкие значения рН могут наблюдаться в кислых болотных водах за счет повышенного содержания гуминовых и фульвокислот. Летом при интенсивном фотосинтезе рН может повышаться до 9. На величину рН влияет содержание карбонатов, гидроокисей, солей, подверженных гидролизу, гуминовых веществ и др.
В результате происходящих в воде химических и биологических процессов и потерь углекислоты рН воды может быстро меняться, поэтому рН следует измерять сразу же.
Для ориентировочного определения рН можно пользоваться универсальным бумажным индикатором.
Потенциометрический метод определения рН отличается большой точностью (0,02). Определению не мешают окраска, мутность, свободный хлор, окислители, восстановители, повышенное содержание солей.
После проверки потенциометра ополосните дистиллированной водой стаканчик и электроды. Налейте в стаканчик анализируемую воду и измеряйте рН 2 – 3 раза с интервалом 2 – 3 мин. Последние два показания прибора должны быть одинаковыми. Если исследуемая вода имеет низкую температуру (около 0 0 С), то она должна быть нагрета до комнатной температуры.
Определение цветности воды
Цветность природных вод обусловлена главным образом присутствием гуминовых веществ и комплексных соединений железа (III). Количество этих веществ зависит от геологических условий, водоносных горизонтов, характера почв, наличия болот и торфяников в бассейне реки и т.д.
Цветность воды определяют визуально. Результаты выражают в градусах цветности. Цветность от 0 до 50 0 выражается с точностью до 2 0 , от 51 до 100 0 – до 5 0 , от 101 до 250 0 – до 10 0 , от 251 до 500 0 до 20 0. . При цветности выше 80 0 воду необходимо разбавлять.
Приготовление стандартных растворов
Раствор 1: 0,0875 г K2Cr2O7, 2 г CoSO4×7H2O и 1 мл серной кислоты (пл. 1,84 г/см 3 ) растворите в дистиллированной воде в мерной колбе на 1 л, доведите объем раствора до метки дистиллированной водой. Этот раствора соответствует цветности 500 0 .
Раствор 2: 1 мл серной кислоты (пл. 1,84 г/см 3 ) растворите в дистиллированной воде в мерной колбе на 1 л, доведите объем раствора до метки дистиллированной водой.
Подготовка шкалы стандартных растворов. Смешивая растворы 1 и 2 в соотношениях, указанных в таблице, приготовьте шкалу цветности.
| Раст-вор | Градусы цветности |
| N1,мл N2,мл |
В цилиндр, однотипный с теми, в которых приготовлена шкала, налейте 100 мл исследуемой воды. Просматривая сверху на белом фоне, подберите раствор шкалы с тождественной окраской.
Запах воды водоемов не должен превышать 2 баллов, обнаруживаемых непосредственно в воде. Определение основано на органолептическом исследовании характера и интенсивности запаха воды при 20 0 и 60 0 С.
Запах воды обусловлен наличием в ней летучих и пахнущих веществ, которые попадают в неё естественным путем или сточными водами. По характеру запахи делятся на две группы.
Запахи естественного происхождения описываются по следующей терминологии.
| Символ | Характер запаха | Примерный род запаха |
| А | Ароматический | Огуречный, цветочный |
| Б | Болотный | Илистый, тинистый |
| Г | Древесный | Запах мокрой щепы, древесный |
| З | Землистый | Прелый, свежевспаханной земли |
| Р | Рыбный | Рыбы, рыбьего жира |
| С | Сероводород | Тухлых яиц |
| Т | Травянистый | Сена, скошенной травы |
| Н | Неопределенный | Не подходящий под предыдущие определения |
Чистые природные воды запахов не имеют.
Запахи искусственного происхождения (от промышленных выбросов, для питьевой воды – от обработки воды реагентами на водопроводных сооружениях и т.п.) называют по соответствующим веществам: хлорфенольный, камфорный, бензиновый, хлорный и т.п.
Интенсивность запаха оценивают по пятибалльной системе, приведенной в таблице.
| Балл | Интенсивность запаха | Описание определения |
| Никакого | Отсутствие ощутимого запаха. | |
| Очень слабый | Запах, обнаруживаемый опытным исследователем. | |
| Слабый | Запах, не привлекающий внимания, но такой, который можно заметить, если указать на него. | |
| Отчетливый | Запах, обращающий на себя внимание и делающий воду непригодной для питья. | |
| Заметный | Запах, легко обнаруживаемый и могущий дать повод относиться к воде с неодобрением. | |
| Очень сильный | Запах настолько сильный, что делает воду непригодной для питья |
Водой, не имеющей запаха, считается такая, запах которой не превышает 2 балла.
100 мл исследуемой воды при 20 0 С налейте в колбу вместимостью 150 – 200 мл с широким горлом, накройте часовым стеклом или притертой пробкой, встряхните вращательным движением, откройте пробку или сдвиньте часовое стекло и быстро определите характер и интенсивность запаха. Затем колбу нагрейте до 60 0 С на водяной бане и также оцените запах.
Определение прозрачности воды
Прозрачность воды обусловлена ее цветом и мутностью, т.е. содержанием в ней различных окрашенных и взвешенных органических и минеральных веществ. Мерой прозрачности служит высота столба воды, при котором можно различать на белой бумаге стандартный шрифт определенного размера и типа. Прозрачность по шрифту выражают в см и определяют с точностью 0,5 см. Стандартный шрифт имеет высоту букв 3,5 мм.
В цилиндр с внутренним диаметром 2,5 см и высотой 30 см налейте исследуемую воду и поместите его неподвижно над шрифтом на высоте 4 см. Сливая и доливая исследуемую воду, найдите высоту столба, еще позволяющую читать шрифт. Исследование проводите в хорошо освещенном помещении, но не на прямом свету, на расстоянии 1 м от окна. Измерение повторите 2 – 3 раза.
Определение перманганатной окисляемости
Окисляемость – общее количество содержащихся в воде восстановителей (неорганических и органических), реагирующих с сильными окислителями, например, бихроматом или перманганатом калия. Результаты определения окисляемости выражают в миллиграммах кислорода на 1 л воды (мг О/л).
Все методы определения окисляемости условны, а полученные результаты сравнимы только в том случае, когда точно соблюдены все условия анализа.
Наиболее полное окисление достигается бихроматом калия, поэтому бихроматную окисляемость нередко называют «химическим потреблением кислорода» (ХПК). Большинство соединений окисляется при этом на 95 – 100%. Нормативы ХПК воды водоемов хозяйственно-питьевого назначения – 15 мг О/л, культурно – бытового – 30 мг О/л.
Метод перманганатометрической окисляемости основан на окислении веществ, присутствующих в воде, 0,01 н. раствором KMnO4 в сернокислой среде при кипячении. Без разбавления можно определять окисляемость до 10 мг кислорода в 1 л.
При определении перманганатной окисляемости после реакции должно остаться не менее 40% введенного перманганата калия, так как степень окисления зависит от его концентрации. При большом расходе реагента пробу необходимо разбавлять.
В колбу поместите 100 мл исследуемой воды (или разбавленной до 100 мл), несколько капилляров или кусочков пемзы, прилейте 5 мл разбавленной серной кислоты (1:3) и 10 мл 0,01 н. раствора KMnO4. Смесь нагревайте так, чтобы она закипела не ранее, чем через 5 мин, и кипятите точно 10 мин, закрыв колбу маленькой конической воронкой для уменьшения испарения. К горячему раствору прибавьте 10 мл 0,01 н. раствора щавелевой кислоты. Обесцвеченную горячую (80-90 0 С) смесь титруйте 0,01 н. раствором KMnO4 до слабо розового окрашивания.
Если в процессе кипячения содержимое колбы потеряет розовую окраску или побуреет, то определение необходимо повторить, разбавив исследуемую воду. Определение также необходимо повторить, если при обратном титровании щавелевой кислоты израсходовано более 7 мл или менее 2 мл 0,01 н. раствора KMnO4.
Одновременно проведите холостой опыт со 100 мл дистиллированной воды, обрабатывая ее так же, как и анализируемую воду. Расход перманганата калия не должен превышать 0,3 мл.
;
где Х – перманганатная окисляемость, мг О/л;
V1 – объем перманганата калия, пошедший на титрование исследуемой воды, мл;
V2 – объем перманганата калия, пошедший на титрование холостой пробы воды, мл;
N – нормальность раствора перманганата калия;
V – объем пробы, взятой для анализа, мл.
Определение биологического потребления кислорода (БПК)
БПК — количество кислорода (мг), требуемое для окисления находящихся в 1 л воды органических веществ в аэробных условиях при 20 0 С в результате протекающих в воде биохимических процессов за определенный период времени (БПК за 3, 5, 10, 20 т.д. суток).
Установлено, что при загрязнении водоемов преимущественно хозяйственно-бытовыми сточными водами с относительно постоянным составом и свойствами БПК5 (5-суточное) составляет 70% БПК полного.
Нормативы БПК воды водоемов хозяйственно-питьевого назначения – 3 мг/л кислорода, культурно – бытового – 6 мг/л кислорода.
Среди различных методов определения БПК наиболее распространено определение по разности содержания кислорода до и после инкубации при стандартных условиях (при 20 0 С в аэробных условиях без дополнительного доступа воздуха и света).
БПК определяют в натуральной, тщательно перемешанной воде.
Проба для анализа БПК должна быть обработана в день отбора (или при условии хранения пробы в холодильнике на следующий день). Для отбора проб воды необходимо использовать посуду с притертыми пробками и следить, чтобы при отборе проб воды она переливалась через край склянок.
РН воды при определении БПК должна быть в пределах 6,5 – 8,5. Температура исследуемой воды должна быть 20 0 С. Для аэрации воды необходимо перед анализом встряхивать воду в колбе, заполненной водой на ¾ объема, в течение 1 мин. и затем быстро перенести воду в специальные колбы с притертыми крышками, заполняя колбы до самых краев.
Для фиксации кислорода введите в 8 колб емкостью 100 мл с анализируемой водой по 1 мл хлорида или сульфата марганца (400 г MnSO4×2H2O или 425 г MnCl2×2H2O растворите в 1 л дистиллированной воды) и по 1 мл щелочного раствора йодида калия (150 г KI растворите в 100 мл дистиллированной воды, 500 г NaOH растворите в 500 мл свежеприготовленной дистиллированной воды, оба раствора смешайте и доведите общий объем в мерной колбе до 1л). Пипетки на 1 мл следует погружать до дна колбы, часть жидкости при этом будет выливаться. После введения реактивов закройте склянки пробками, перемешайте резким перевертыванием. В таком виде оставьте склянки соответственно две на 3, две на 5 и две на 10 сут. Содержимое двух склянок проанализируйте сразу же.
Перед титрованием (осадок должен хорошо осесть) прибавьте в каждую склянку по 5 мл соляной кислоты (2:1), при этом часть жидкости будет переливаться через край. Каждую склянку закройте пробкой и содержимое её перемешайте, осадок гидроксида марганца при этом растворится и окислит йодистые соединения, а выделившийся йод окрасит раствор в желтый цвет. После перемешивания каждую пробу перенесите в колбу для титрования на 250 – 300 мл и быстро титруйте 0,02 н. раствором тиосульфата натрия в присутствии индикатора крахмала до исчезновения окраски.
;
где Х – содержание растворенного кислорода, мг/л;
V – объем тиосульфата натрия, пошедший на титрование исследуемой воды, мл;
V1 – объем кислородной склянки, мл;
V2 – объем всех реактивов, внесенных в воду для фиксации кислорода, мл;
N – нормальность раствора тиосульфата натрия;
где Х1 – содержание растворенного кислорода в пробе до начала инкубации (нулевой день);
Х2 – содержание растворенного кислорода в пробе после инкубации.
Определение щелочности или кислотности воды
После определения рН воды можно приступить к определению щелочности (если рН>7) или кислотности (если рН — , анионами слабых кислот (например, карбонаты и гидрокарбонаты). Щелочность определяется количеством сильной кислоты, необходимой для замещения этих анионов. Расход кислоты эквивалентен их общему содержанию и выражает общую щелочность воды. Щелочность выражают в мг-экв/л.
В обычных природных водах щелочность зависит в основном от присутствия гидрокарбонатов щелочноземельных металлов, в меньшей степени щелочных. В этом случае значение рН воды не превышает 8,3. Растворимые карбонаты и гидроксиды повышают значение рН.
Отберите 100 мл исследуемой воды, добавьте 2-3 капли индикатора метилоранжа и титруйте 0,1 н раствором соляной кислоты в присутствии контрольного раствора до перехода окраски из желтой в оранжевую.
;
где Щ – щелочность воды, мг-экв/л;
V – объем соляной кислоты, пошедший на титрование исследуемой воды, мл;
VП – объем пробы, взятый для анализа, мл;
N – нормальность раствора соляной кислоты;
Кислотностью называется содержание в воде веществ, вступающих в реакцию с гидроксил — ионами. Расход щелочи, пошедшей на реакцию, выражает общую кислотность воды. В обычных природных водах кислотность в большинстве случаев зависит только от содержания свободного CO2. Естественную часть кислотности создают также гуминовые и другие слабые органические кислоты. В этих случаях рН воды не бывает ниже 4,5. Кислотность выражают в мг-экв/л.
Отберите 100 мл исследуемой воды, добавьте 2-3 капли индикатора фенолфталеина и титруйте 0,1 н раствором гидроксида натрия до появления розовой окраски, не исчезающей в течение 30 секунд.
;
где К – кислотность воды, мг-экв/л;
V – объем гидроксида натрия, пошедший на титрование исследуемой воды, мл;
VП – объем пробы, взятый для анализа, мл;
N – нормальность раствора гидроксида натрия.
Определение жесткости воды
Определение карбонатной жесткости воды
Жесткость воды изучают, чтобы выяснить её пригодность для растениеводства, животноводства, а также для технических целей. Под жесткостью понимают суммарное содержание в воде солей кальция и магния. Общую жесткость определяют комплексонометрическим методом, а карбонатную или временную жесткость – методом нейтрализации. Карбонатная жесткость зависит от содержания в воде гидрокарбонатов кальция и магния. Она почти полностью устраняется кипячением, при котором гидрокарбонаты разлагаются:
Поэтому карбонатную жесткость называют также устранимой, или временной. Карбонатная жесткость отвечает той части катионов кальция и магния, которая эквивалентна содержащимся в воде анионам гидрокарбонатов этих металлов. Жесткость принято выражать в ммоль экв/л.
Поместите 100 мл исследуемой воды в коническую колбу. Прибавьте 2-3 капли индикатора метилоранжа, перемешайте и титруйте раствором HCl до перехода желтой окраски индикатора в оранжевую. Титрование повторите не менее трех раз, до получения хорошо сходимых результатов.
Результаты рассчитайте в ммоль экв/л.
Определение общей жесткости воды
Под общей жесткостью понимают суммарное содержание ионов кальция и магния в воде, выраженное в ммоль экв/л. Она складывается из карбонатной (временной) и некарбонатной (постоянной) жесткости воды. Некарбонатная жесткость обусловлена наличием в воде сульфатов, хлоридов, силикатов, нитратов и фосфатов этих металлов.
Жесткость воды колеблется в широких пределах: от 0,1-0,2 ммоль экв/л в реках и озерах, расположенных в зонах тайги и тундры, до 80 ммоль экв/л и более — в подземных водах, морях и океанах. Различают воду мягкую (общая жесткость до 2 ммоль экв/л), средней жесткости (2-10 ммоль экв/л) и жесткую (более 10 ммоль экв/л). В поверхностных водоисточниках преобладает, как правило, карбонатная жесткость (70-80% от общей). Наибольшего значения жесткость воды достигает в конце зимы, а наименьшего – в период паводка. Так, в реке Волге (г. Нижний Новгород) максимальная жесткость бывает в марте (4,3 ммоль экв/л), а минимальная — в мае (0,5 ммоль экв/л). В подземных водах жесткость воды наиболее постоянна и меньше изменяется в течение года.
Повышенная жесткость способствует усиленному образованию накипи в паровых котлах, отопительных приборах и бытовой металлической посуде, что значительно снижает интенсивность теплообмена. В воде с высокой жесткостью плохо развариваются овощи и мясо, так как катионы кальция образуют с белками пищевых продуктов нерастворимые соединения. Большая магниевая жесткость придает воде горький привкус, поэтому содержание магния не должно превышать 100 мг/л. Общая жесткость питьевой воды во избежание ухудшения ее органолептических свойств должна быть не более 7 ммоль экв/л.
Для устранения или уменьшения жесткости воды применяют специальные методы. Из реагентных методов наиболее распространен известково-содовый, а при комбинировании его с ионообменными методами можно получить глубоко умягченную воду.
Поместите 100 мл исследуемой воды в коническую колбу. Прибавьте 20 мл аммонийного буферного раствора (рН = 10) и на кончике шпателя — несколько кристалликов индикатора эриохрома черного Т или кислотного хром темно-синего. Раствор перемешайте, после появления винно-красной окраски титруйте 0,05 н. раствором трилона Б до перехода окраски в синюю. Титрование повторите не менее трех раз, до получения хорошо сходимых результатов.
Результаты рассчитайте в ммоль экв/л.
Определение нитратов потенциометрическим методом
с ион-селективным электродом
Предельно допустимая концентрация нитратов в воде водоемов 45 мг/л, лимитирующий показатель вредности санитарно-токсикологический.
Массовую долю нитратов в миллионных долях находят по величине рС(NO3 — ) с помощью данных, приведенных в ниже представленной таблице.
Для проведения анализа необходим иономер типа ЭВ-74, рН-милливольтметр рН-340 или рН-121 (с ион-селективным нитратным электродом и электродом сравнения хлорсеребряным).
Подготовка электрода к работе. До начала работы заполните электрод водным раствором, содержащим нитрат калия и хлорид калия (10,11 г KNO3 и 0,37 г KCl растворите в мерной колбе на 1 л и доведите до метки дистиллированной водой). После этого электрод сутки выдерживайте в 0,1 М растворе KNO3. Перед началом работы нитратный электрод поместите на 10 минут в стаканчик с дистиллированной водой.
50 мл воды поместите в стаканчик и измеряйте концентрацию иона нитрата. Перед измерением ион — селективный электрод тщательно ополосните дистиллированной водой и выдерживайте его в дистиллированной воде 10 мин. Измерения повторите три раза и возьмите среднеарифметическое значение трех измерений.
Измерение концентрации иона нитрата проводите непосредственно в логарифмических единицах рС(NO3 — ) = -lgС(NO3 — ) по шкале иономера, предварительно отградуированного по растворам сравнения.
Определение активного хлора
Хлор активный (суммарное содержание свободного хлора, хлорноватистой кислоты, гипохлорит — ионов и хлораминов) в воде водоемов должен отсутствовать, лимитирующий показатель вредности общесанитарный.
Метод основан на том, что свободный хлор, хлорноватистая кислота, гипохлорит — ионы и хлорамины в кислой среде выделяют из йодида калия йод, который оттитровывают тиосульфатом в присутствии крахмала.
Дата добавления: 2014-01-07 ; Просмотров: 762 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
состав растворенных газов.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей.
Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или
12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO32 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO32 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общаяжесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам:
Общая жесткость
Карбонатная жесткость равна концентрации (мг/л) [HCO3– ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:
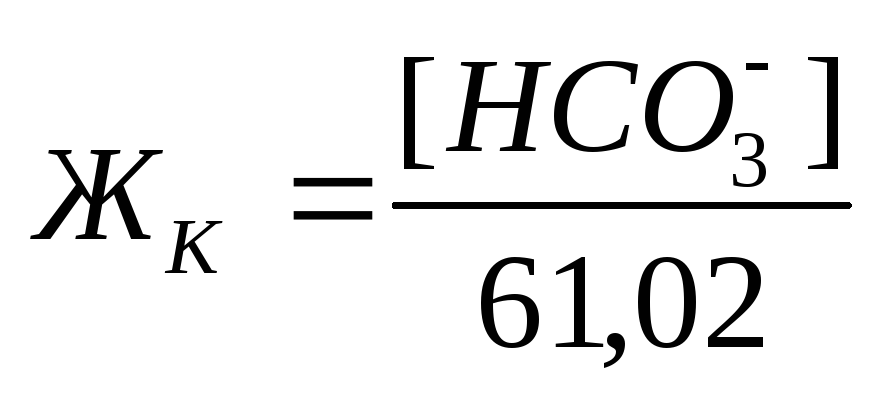
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК= ЖО– ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Окисляемость характеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества.
Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме
требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л.
При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Определение иона Cl – . В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO42– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO42– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO42– .
Определение ионов CO32– и HCO3– . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии.
Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO32 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО32– и НСО3– , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния:
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)
N
образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет.
Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:
Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна:
С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка.
Растворенные в воде газы определяют химическими методами или газовой хроматографией.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
Определение растворенного кислорода производится йодометрическим методом.
Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом:
Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе:
Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия:
I2+ 2Na2S2O3
Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II):
Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску.
В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания.
Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом.
В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом:
К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе.
источник
Классификация и состав сточных вод. Химико-спектральное определение тяжелых металлов в природных водах. Очистка сточных вод от ионов тяжелых металлов методом натрий-катионирования. Мониторинг сбросов сточных вод в бассейны рек Западная Двина и Свислочь.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Кафедра аналитической химии
Химический анализ и очистка сточных и природных вод от ионов тяжелых металлов
Проблема качества воды затрагивает очень многие стороны жизни человеческого общества в течение всей истории его существования. В настоящее время проблемы загрязнения воды, в том числе питьевой и подземных вод — это проблемы социальные, политические, медицинские, географические, а также инженерные и экономические.
Согласно Всеобщей декларации прав человека, право на чистую воду, её охрану и информацию о качестве воды — основные права человека, защищающие не только его здоровье, но и жизнь.
Несмотря на то, что вода — самое распространённое на Земле вещество, запасы пресной воды довольно ограничены. По существующим оценкам, в 2100 г., когда население планеты предположительно достигнет 20 млрд. человек, запасов пресной воды на планете станет недостаточно. К 2025 г. две трети населения планеты будет испытывать умеренную или серьёзную нехватку воды.
Основные потребители пресной воды — сельское хозяйство, промышленность, включая энергетику, и коммунальное хозяйство.
В мире 70 % пресной воды используется для сельскохозяйственных нужд. Например, при выращивании 1 т пшеницы расходуется 1,5 тыс. т воды, а 1 т риса — 7 тыс. т.
В среднем городской житель в доме со всеми удобствами расходует 200— 300 л воды в день. Примерная структура расхода воды на бытовые нужды составляет: питьё и приготовление пищи — 6 %, в смывном бачке туалета — 44 %, для ванны и душа — 35 %, мытьё посуды — 7 %, стирка — 5 %, уборка помещения — 3 %.
В промышленной добыче 1 т нефти расходуется 18 т воды, в производстве 1 т бумаги — 200 т воды, 1 т синтетического волокна — 3,5 тыс. т воды. При этом большая часть вод, участвующих в производстве, полной очистке не подвергается. 90—95 % сточных вод и 70 % производственных отходов попадают в воду в необработанном виде. Ежегодно в мире сбрасываются более 420 км3 сточных вод, которые делают непригодными около 7 тыс. км3 воды.
По оценке экспертов ООН, до 80 % химических соединений, поступающих во внешнюю среду, рано или поздно попадают в водоисточники.
3,5 млрд человек пользуются источниками воды, не проходящей даже минимальной очистки. Следствием этому является ряд заболеваний, таких как диарея, гепатит А, малярия и др. По имеющимся данным, 80 % всех инфекционных заболеваний в мире связано с неудовлетворительным качеством питьевой воды и нарушением санитарно-гигиенических норм водоснабжения. В мире 2 млрд человек имеют хронические заболевания в связи с использованием загрязнённой воды. В результате использование некачественной воды приводит к ежегодной гибели 5 млн. человек, большинство из которых составляют дети. С учётом этого Всемирная организация здравоохранения объявила текущее десятилетие десятилетием питьевой воды. [7]
Сточные воды, воды, загрязнённые бытовыми отбросами и производственными отходами и удаляемые с территорий населённых мест и промышленных предприятий системами канализации. К С. в. относят также воды, образующиеся в результате выпадения атмосферных осадков в пределах территорий населённых пунктов и промышленных объектов. Содержащиеся в С. в. органические вещества, попадая в значительных количествах в водоёмы или скапливаясь в почве, могут быстро загнивать и ухудшать санитарное состояние водоёмов и атмосферы, способствуя распространению различных заболеваний. Поэтому вопросы очистки, обезвреживания и утилизации С. в. являются неотъемлемой частью проблемы охраны природы, оздоровления окружающей человека среды и обеспечения санитарного благоустройства городов и др. населённых мест.
1.1 Классификация и состав сточных вод
В зависимости от происхождения, состава и качественных характеристик загрязнений (примесей) Сточные воды подразделяются на 3 основных категории: бытовые (хозяйственно-фекальные), производственные (промышленные) и атмосферные. [3]
К бытовым сточным водам относят воды, удаляемые из туалетных комнат, ванн, душевых, кухонь, бань, прачечных, столовых, больниц. Они загрязнены в основном физиологическими отбросами и хозяйственно-бытовыми отходами. [3]
Производственными сточными водами являются воды, использованные в различных технологических процессах (например, для промывки сырья и готовой продукции, охлаждения тепловых агрегатов и т.п.), а также воды, откачиваемые на поверхность земли при добыче полезных ископаемых. Производственные сточные воды ряда отраслей промышленности загрязнены главным образом отходами производства, в которых могут находиться ядовитые вещества (например, синильная кислота, фенол, соединения мышьяка, анилин, соли меди, свинца, ртути и др.), а также вещества, содержащие радиоактивные элементы; некоторые отходы представляют определенную ценность (как вторичное сырьё). В зависимости от количества примесей производственные сточные воды подразделяют на загрязнённые, подвергаемые перед выпуском в водоём (или перед повторным использованием) предварительной очистке, и условно чистые (слабо загрязнённые), выпускаемые в водоём (или вторично используемые в производстве) без обработки. [5]
Атмосферные сточные воды — дождевые и талые (образующиеся в результате таяния льда и снега) воды. По качественным характеристикам загрязнений к этой категории относят также воды от поливки улиц и зелёных насаждений. Атмосферные сточные воды, содержащие преимущественно минеральные загрязнения, менее опасны в санитарном отношении, чем бытовые и производственные сточные воды. Также они содержат растворенные газы: кислород, азот, углекислый газ и органические вещества, поглощаемые из воздуха. Атмосферные осадки, выпадающие над большими промышленными городами, содержат сероводород, сернистую кислоту, частицы пыли. Общее число растворенных веществ в атмосферных водах обычно не превышает 50 мг/л.
Степень загрязнённости сточных вод оценивается концентрацией примесей, т. е. их массой в единице объёма (в мг/л или г/м.3). [3]
Состав бытовых сточных вод более или менее однообразен; концентрация загрязнений в них зависит от количества расходуемой (на одного жителя) водопроводной воды, т. е. от нормы водопотребления. Загрязнения бытовых сточных вод обычно подразделяют на: нерастворимые, образующие крупные взвеси (в которых размеры частиц превышают 0,1 мм) либо суспензии, эмульсии и пены (в которых размеры частиц составляют от 0,1 мм до 0,1 мкм), коллоидные (с частицами размером от 0,1 мкм до 1 нм), растворимые (в виде молекулярно-дисперсных частиц размером менее 1 нм).
Различают загрязнения бытовых сточных вод минеральные, органические и биологические.
К минеральным загрязнениям относятся песок, частицы шлака, глинистые частицы, растворы минеральных солей, кислот, щелочей и многие др. вещества. [3]
Органические загрязнения бывают растительного и животного происхождения. К растительным относятся остатки растений, плодов, овощей, бумага, растительные масла и пр. Основной химический элемент растительных загрязнений — углерод. Загрязнениями животного происхождения являются физиологические выделения людей и животных, остатки тканей животных, клеевые вещества и пр. Они характеризуются значительным содержанием азота. [3]
К биологическим загрязнениям относятся различные микроорганизмы, дрожжевые и плесневые грибки, мелкие водоросли, бактерии, в том числе болезнетворные (возбудители брюшного тифа, паратифа, дизентерии, сибирской язвы и др.). Этот вид загрязнений свойствен не только бытовым сточным водам, но и некоторым видам производственных сточных вод, образующимся, например, на мясокомбинатах, бойнях, кожевенных заводах, биофабриках и т.п. По своему химическому составу они являются органическими загрязнениями, но их выделяют в отдельную группу ввиду санитарной опасности, создаваемой ими при попадании в водоёмы. [3]
В бытовых сточных водах минеральных веществ содержится около 42% (от общего количества загрязнений), органических — около 58%; осаждающиеся взвешенные вещества составляют 20%, суспензии — 20%, коллоиды — 10%, растворимые вещества — 50%. Количество бытовых сточных вод зависит в основном от нормы водоотведения, которая, в свою очередь, определяется степенью благоустройства зданий. [3]
Состав и степень загрязнённости производственных сточных вод весьма разнообразны и зависят главным образом от характера производства и условий использования воды в технологических процессах. [3]
Количество атмосферных вод меняется в значительных пределах в зависимости от климатических условий, рельефа местности, характера застройки городов, вида покрытия дорог и др. [3]
1.2 Методы очистки сточных вод
В реках и других водоемах происходит естественный процесс самоочищения воды. Однако он протекает медленно. Пока промышленно-бытовые сбросы были невелики, реки сами справлялись с ними. В наш индустриальный век в связи с резким увеличением отходов водоемы уже не справляются со столь значительным загрязнением. Возникла необходимость обезвреживать, очищать сточные воды и утилизировать их.
Очистка сточных вод — обработка сточных вод с целью разрушения или удаления из них вредных веществ. Освобождение сточных вод от загрязнения — сложное производство. В нем, как и в любом другом производстве имеется сырье (сточные воды) и готовая продукция (очищенная вода). [13]
Во всех случаях очистки первой стадией является механическая очистка для удаления грубодисперсных примесей (отстаивание, процеживание, центробежное фильтрование и др.). Последующая очистка от коллоидно-дисперсных и растворённых примесей осуществляется различными методами в зависимости от природы загрязнителей: химическими (реагентное осаждение, коагуляция, флокуляция и др.), физико-химическими (абсорбция, ионный обмен, обратный осмос и др.), электрохимическими (электродиализ, электрофлотация, электрокоагуляция, электрохимическое окисление), биохимическими.
Сущность механического метода состоит в том, что из сточных вод путем отстаивания и фильтрации удаляются механические примеси. Грубодисперсные частицы в зависимости от размеров улавливаются решетками, ситами, песколовками, септиками, навозоуловителями различных конструкций, а поверхностные загрязнения — нефтеловушками, бензомаслоуловителями, отстойниками и др. Механическая очистка позволяет выделять из бытовых сточных вод до 60-75% нерастворимых примесей, а из промышленных до 95%, многие из которых как ценные примеси, используются в производстве. [5]
Химический метод заключается в том, что в сточные воды добавляют различные химические реагенты, которые вступают в реакцию с загрязнителями и осаждают их в виде нерастворимых осадков. Химической очисткой достигается уменьшение нерастворимых примесей до 95% и растворимых до 25%.
При физико-химическом методе обработки из сточных вод удаляются тонко дисперсные и растворенные неорганические примеси и разрушаются органические и плохо окисляемые вещества, чаще всего из физико-химических методов применяется коагуляция, окисление, сорбция, экстракция и т.д. Широкое применение находит также электролиз. Он заключается в разрушении органических веществ в сточных водах и извлечении металлов, кислот и других неорганических веществ. Электролитическая очистка осуществляется в особых сооружениях — электролизерах. Очистка сточных вод с помощью электролиза эффективна на свинцовых и медных предприятиях, в лакокрасочной и некоторых других областях промышленности.
Загрязненные сточные воды очищают также с помощью ультразвука, озона, ионообменных смол и высокого давления, хорошо зарекомендовала себя очистка путем хлорирования. [5]
Среди методов очистки сточных вод большую роль играет биологический метод, основанный на использовании закономерностей биохимического и физиологического самоочищения рек и других водоемов. Есть несколько типов биологических устройств по очистке сточных вод: биофильтры, биологические пруды и аэротенки. [5]
В биофильтрах сточные воды пропускаются через слой крупнозернистого материала, покрытого тонкой бактериальной пленкой. Благодаря этой пленке интенсивно протекают процессы биологического окисления. Именно она служит действующим началом в биофильтрах.
В биологических прудах в очистке сточных вод принимают участие все организмы, населяющие водоем.
Аэротенки — огромные резервуары из железобетона. Здесь очищающее начало — активный ил из бактерий и микроскопических животных. Все эти живые существа бурно развиваются в аэротенках, чему способствуют органические вещества сточных вод и избыток кислорода, поступающего в сооружение потоком подаваемого воздуха. Бактерии склеиваются в хлопья и выделяют ферменты, минерализующие органические загрязнения. Ил с хлопьями быстро оседает, отделяясь от очищенной воды. Инфузории, жгутиковые, амебы, коловратки и другие мельчайшие животные, пожирая бактерии, неслипающиеся в хлопья, омолаживают бактериальную массу ила.
Сточные воды перед биологической очисткой подвергают механической, а после нее для удаления болезнетворных бактерий и химической очистке, хлорированию жидким хлором или хлорной известью. Для дезинфекции используют также другие физико-химические приемы (ультразвук, электролиз, озонирование и др.)
Биологический метод дает большие результаты при очистке коммунально-бытовых стоков. Он применяется также и при очистке отходов предприятий нефтеперерабатывающей, целлюлозно-бумажной промышленности, производстве искусственного волокна. [5]
1.3 Принципы очистки сточных вод
На рисунке 1 приведена типовая схема очистки промышленных сточных вод.
Размещено на http://www.allbest.ru/
Рис. 1. Типовая схема очистки промышленных сточных вод
А на рисунке 2 — классификация основных методов очистки сточных вод химических производств.
Размещено на http://www.allbest.ru/
Рис. 2. Классификация основных методов обезвреживания сточных вод химических производств.
1.4 Обработка непромышленных сточных вод
Эти воды содержат в основном вещества органического происхождения: белки, жиры, углеводы, амиды, детергенты и др., а также минеральные растворённые и нерастворённые примеси, бактерии и вирусы. Обработка сточных вод включает 3 этапа: первичную, вторичную и третичную обработку. Обычно первичную и вторичную обработку совмещают.
Первичная и вторичная обработка Сначала в течение недели воды отстаиваются, затем проходят через решётчатый фильтр грубой очистки, освобождаясь от кусочков древесины, коры и других твёрдых предметов. Затем воды снова отстаиваются для удаления жиров и масел в специальных сооружениях — танках, после чего — в цилиндрических отстойниках для снятия пены и удаления осадка. Из отстойников воды поступают на предприятие биохимической очистки. После этого их уже можно сбрасывать в реку. [7]
Третичная обработка Если воды после первичной и вторичной обработки необходимо вернуть в городское водное хозяйство, проводят их третичную обработку. Обычно воду осветляют на активированном угле и затем стерилизуют.
Существуют следующие методы третичной обработки: сорбция активированным углём, микрофильтрация, коагуляция, аэрация, осаждение фосфатов, удаление соединений азота, очистка от органических питательных веществ, электрохимическая обработка и стерилизация. Кратко рассмотрим данные методы. [7]
1. Сорбция активированным углём. Уголь хорошо адсорбирует органические вещества, причём ароматические адсорбируются лучше алифатических, а вещества с разветвленными молекулами — лучше, чем с неразветвленными. После обработки углём воду стерилизуют и могут использовать в качестве питьевой. Схема обработки воды углём показана на рисунке 3. Вода подаётся в колонну со скоростью до 5л/с*м2.
Гранулы угля от 1,5 до 1,7 мм, удельная поверхность около 1000 м2/г, плотность 420 кг/м . Сорбент регенерируют водяным парок при 030 °С.
Рис. 3. Схема обработки воды углём
Таблица 1. Сорбенты, используемые в водоочистке и водоподготовке
Поглотители органического загрязнения на основе минерального сырья (уголь, шунгит, искусственные волокна)
Разнообразие исходного сырья для производства, возможность многократного использования, большая емкость поглощения
Не очищают воду до норм ПДК, не поглощают ионы тяжелых металлов
Поглотители органического загрязнения на основе растительных отходов (солома, шелуха зерновых культур и др.)
Широкие возможности для улучшения поглощающих свойств, большая емкость поглощения
То же, одноразовое использование
Природные иониты и глинистые минералы (цеолиты, бентониты, диатомиты, монтмориллониты)
Относительно невысокая стоимость, возможности для модификации, хорошие сорбционные характеристики
Малая химическая стойкость, низкая механическая прочность, отсутствие сырьевой базы
Большая емкость поглощения, возможность глубокой сорбции, вплоть до полного удаления поллютантов, возможность регенерации
Без дополнительных приемов обработки воды не поглощают ионы металлов, химическая нестойкость к кислороду, высокая стоимость.
Высокие селективные свойства, большая емкость поглощения, широкий спектр поглощаемых веществ, многократное использование
Высокая стоимость, большие водо — и энергозатраты на регенерацию, в питьевом водоснабжении поглощаются макроэлементы
Комплексные сорбенты на основе органоминеральньгх веществ и углеродной | составляющей
Универсальные поглощающие свойства, хорошие сорбционные характеристики, относительно невысокая стоимость
Низкая механическая прочность, сложность регенерации
2. Микрофильтрация. Промышленный микрофильтратор имеет вращающийся барабан, покрытый металлической тканью, внутрь которого подаётся загрязнённая вода. Ткань изготовлена из нержавеющей стальной проволоки. Размер ячейки 65 мкм, число ячеек — 250/мм2. Такие волокна могут задерживать даже микроорганизмы размером 7—12 мкм после оседания на ячейках более крупных твёрдых частиц. [7]
3. Коагуляция — сложный физико-химический процесс разрушения коллоидных систем. Это укрупнение и отделение от растворителя (или дисперсионной среды) частиц вещества коллоидной степени дисперсности (дисперсной фазы, размер частиц 1—100 нм) под влиянием коагулянтов, а также некоторых физических факторов (интенсивное перемешивание, нагревание, охлаждение и др.).
В процессе коагуляционной очистки воды внесённый коагулянт вначале подвергается гидролизу. При этом образуется неустойчивая коллоидная система. Она распадается с выделением фазы гидроксидов, основных солей, а также продуктов их взаимодействия с примесями (ионами, молекулами, клеточными структурами). Наконец, продукты коагуляции оседают, образуя легко отделимый осадок. Важно отметить, что удаление примесей основано на их соосаждении с частицами образующейся твёрдой фазы.
В качестве коагулянтов для очистки воды используют некоторые неорганические соли (сульфаты алюминия, железа (II) и (III), меди, алюминат натрия, смесь сульфата железа(II) и перманганата калия), а также искусственные и природные полимеры (полиспирты, полиамиды, карбоксилаты и др.). Из них наиболее широко используется полиакриламид. Органические коагулянты образуют «мосты» между соседними частицами и способствуют их осаждению.
Применение смеси сульфата железа(II) и перманганата калия основано на протекании в растворе сложных окислительно-восстановительных и гидролитических процессов. Реакцию можно упрощённо записать в виде:
3FeS04+KMn04 + 7Н20 = v3Fe(OH)3 +Mn02+KHS04+2H2S04
Образующиеся хлопья гидроксида железа(III) осаждают различные примеси, а избыток перманганата калия окисляет органические вещества. [7]
4. Аэрация — процесс нагнетания воздуха под давлением. После сброса давления поднимаются пузырьки воздуха, к которым прилипают твёрдые частицы примесей. Пузырьки воздуха также насыщаются растворёнными в воде газами. Удаление из воды дурнопахнущих газов называется дезодорацией. [7]
5. Осаждение фосфатов. Фосфаты благоприятны для развития бактерий и водорослей. Фосфат-ионы осаждают при добавлении сульфата алюминия или хлорида кальция, затем осадки фосфатов отфильтровывают. [7]
6. Удаление соединений азота. Как и фосфаты, соединения азота ускоряют рост водорослей. Аммиак удаляют аэрацией, нитраты — коагуляцией с последующим отделением осадка или адсорбцией анионообменными смолами. [7]
7. Очистка от органических питательных веществ с помощью бактериальных фильтров или водорослей. Бактериальный фильтр — это смесь определённых бактерий, нанесённая на пористый носитель, обычно кирпич. Для очистки от органических веществ используют также определённые водоросли (Ankystrodesmus, Pharmidium, Pediastrum). [7]
8. Электрохимическая обработка. Основана на пропускании через раствор постоянного электрического тока и протекающих при этом окислительно-восстановительных и других процессов, ведущих к устранению примесей. По одной из схем обработки в ряд параллельно расположенных электролитических ячеек подаются сточные воды, смешанные с морской водой в соотношении 3:1. Как известно, морская вода содержит много солей. Для электрохимической очистки от фосфатов имеют значение катионы магния морской воды. В результате электролиза среда становится щелочной. В этих условиях хорошо растворимые дигидро- и гидрофосфаты превращаются в нерастворимый фосфат магния. [8] Происходящие при этом процессы:
2НР042- + 3Mg2+ + 20Н- = v Mg3(P04)2 + 2H20;
2Н2Р04- + 3Mg2+ + 40Н- = = v Mg3(P04)2+ 4H20.
Схема электролитической ячейки приведена на рисунке 4.
Рис. 4. Схема электролитической ячейки
9. Стерилизация. В сточных водах, прошедших очистку и готовых к сбросу в реки, могут содержаться дизентерийные бактерии, палочки Коха, бациллы тифа, вирусы полиомиелита и гепатита, аденовирусы, вызывающие глазные и прочие инфекции, и другие болезнетворные микроорганизмы.
Стерилизацию проводят методами хлорирования, озонирования, УФ-облучения и электролиза. [7]
Хлорирование. Для стерилизации хлорированием используют газообразный хлор, а также гипохлориты натрия или кальция. Применение хлора требует строгого контроля его содержания в воздухе. Кроме того, возможно образование в растворе вредных хлорсодержащих органических соединений. Вирусы погибают при концентрации хлора выше 0,4 мг/л в течение 30 мин, палочки Коха — при концентрации 1 мг/л в течение 1 ч, а более крупные организмы — амёбы — при концентрации выше 10 мг/л в течение 1 ч. [7]
Озонирование. Озон эффективнее хлора, однако он хуже растворим в воде, поэтому необходимо интенсивное перемешивание раствора.
Ультрафиолетовое облучение. Максимальным бактерицидным действием обладают УФ-лучи с длиной волны 260 нм, которые обычно получают с помощью ртутной лампы. УФ-лучи хорошо поглощаются многими растворёнными в воде веществами, а также диспергированными твёрдыми частицами, поэтому вода должна быть достаточно «прозрачной» для ультрафиолета. [7]
Электролиз. Стерилизация с помощью электролиза основана на применении анода из серебра и катода из углерода или нержавеющей стали. При пропускании тока происходит частичное растворение анода и переход ионов серебра в раствор. Ионы серебра реагируют с бактериями, после чего продукты реакции удаляются. Обычно требуется 1 г серебра для обработки 20 м3 воды. [8]
2. Современные методы очистки сточных вод от ионов тяжелых металлов
2.1 Характеристика тяжелых металлов
Основными загрязнителями окружающей среды являются тяжелые металлы. К ним относятся химические элементы с относительной атомной массой свыше 40 и плотностью более 1 г/см3, хотя некоторые к тяжелым металлам относят химические элементы с атомной массой свыше 50 и плотностью более 6 г/см3 .[1]
Термин «тяжелые металлы» заимствован с технической литературы, где металлы делятся на тяжелые и легкие. В растениях тяжелые металлы входят в группу микроэлементов наряду с физиологически необходимыми, такими как цинк, медь, железо, марганец, молибден, кобальт и др. Все без исключения микроэлементы могут оказывать отрицательное влияние на растения, если концентрация их доступных форм превышает определенные пределы. Это связано с тем, что действие любых химических веществ носит строго дозовый характер. Поэтому термин «тяжелые металлы» следует применять в негативном плане по отношению к более токсичным, не нужным растению элементам, а термин микроэлементы — по отношению к физиологически полезным. [1]
Известны «металлические ряды», расположенные по степени их токсичности для растений. Несмотря на некоторые их различия, можно констатировать, что наиболее ядовитыми как для высших растений, так и для микроорганизмов являются Hg, Pb, Cd, Cu, Zn, Ni, Co. К этому ряду, вероятно, также следует добавить Sn, Be, Ag.
Из большого разнообразия тяжелых металлов: наибольшую опасность представляют кадмий, свинец, ртуть, цинк и медь, что связано с их высокой токсичностью.
Свинец — один из главных компонентов загрязнения окружающей среды. Это давно уже известный яд, и даже среди многочисленных современных токсикантов это вещество наиболее заметно. Еще в Древнем Риме были известны свинцовые трубы для водопроводов и свинцовые сплавы для кухонной посуды и сосудов для вина. Химическое обнаружение свинца в останках захоронений древних римлян указывает на то, что в их организме было слишком много этого металла. Может быть, в этом и кроется одна из причин упадка империи. Типичные признаки хронического отравления свинцом — малокровие, кишечные колики, темная «свинцовая кайма» по краям десен. Субклиническое отравление человека свинцом — проявляется неспецифическими симптомами: вначале повышенная возбудимость и бессонница, позже утомленность и депрессия. В медицинской практике такое отравление диагностируется часто неверно, иногда его лечат как психическое заболевание. Свинец используется для производства аккумуляторных пластин, обкладок электрических кабелей, защитных экранов от лучей высокой энергии, ряда сплавов. В современном мире основными источниками загрязнения этим металлом окружающей среды является нитроэтилсвинец и тетраметилсвинец, которые добавляют в бензин в качестве антидетонатора. Более 95% свинца, содержащегося в атмосфере, поступает с выхлопными газами автомобилей. Примерно половина свинцовой пыли, попав в легкие, остается там, переходит в кровь и откладывается в костях, печени, почках. Свинец, попавший в желудочно-кишечный тракт с пищей, в отличие от свинца, попавшего в легкие, более чем на 90% выводится из организма. [1]
Свинец не участвует в обменных процессах организма человека и животных и при введении даже очень малых доз накапливается в печени, почках, костях, частично замещает кальций костного скелета, образует комплексы с белками. Токсическое действие его при попадании в организм связано с инактивацией ферментов. Взаимодействуя с сульфогидрильными группами белков, образует устойчивые соединения, блокирующие ферментные системы. Кроме того, он влияет на биосинтез гемоглобина, нуклеиновых кислот и различных гормонов. Около 90 — 95% содержащегося в организме человека свинца сконцентрировано в костях, что создает большую опасность хронической интоксикации. Он способен переходить в молоко матери. При потреблении ежегодно не менее 2 г свинца проявляется его канцерогенное действие. Свинец обладает слабой фитотоксичностью, что объясняется его способностью активно реагировать с почвенными компонентами и переходить в трудноусвояемую форму. [1]
Свинец концентрируется в почве и воздухе. Он считается металлом с низкой биологической доступностью и больше накапливается в кормах. В растение поступает через корни и путем некорневого поглощения листьями. Растения с широкими листьями содержат свинца больше, чем с узкими. Зерно злаковых, клубни картофеля и корни сахарной свеклы не накапливают свинца. [1]
Естественные уровни содержания свинца в растениях лежат в пределах 0,1 —¦ 10 мг/кг (в среднем 2 мг/кг), в сельскохозяйственных культурах, используемых в пищу — 1 — 5 мг/кг сухой массы. Предельно допустимая концентрация (ПДК) свинца в бытовой воде 0,1 мг/л, в почвах республики — 32 мг/кг сухой почвы. По нормам ФАО ежедневное поступление свинца не должно превышать 0,04 мг на 1 кг массы человека. Согласно стандартам Европейского экономического сообщества ПДК свинца в фураже составляет 10 мг/кг сухой массы, в почве — 20 мг/кг. [1]
В нейтральной и слабощелочной почве подвижность свинца примерно в 100 раз меньше, чем кадмия. [1]
Кадмий — опасный токсикант (считается даже токсичнее свинца). Этот металл отнесен Всемирной организацией здравоохранения к числу наиболее вредных для здоровья. Поскольку в природной среде кадмий встречается в очень малых количествах, его вредное действие выявлено лишь недавно. Дело в том, что последние два десятилетия этот металл стал находить все большее техническое применение. Кадмий содержится в мазутах (10-3— 10-4%) и других тяжелых нефтяных остатках, в каменном угле, его используют для кадмирования неблагородных металлов. Источниками загрязнения кадмием являются электронная и лакокрасочная промышленность, осадки сточных вод, сапропели, фосфорные удобрения (содержат от 5 до 100 мг/кг), он выделяется в атмосферу с выхлопными газами автотранспорта, при плавке руд и сгорании топлива. Основное потребление кадмия промышленностью связано с производством щелочных аккумуляторов и получением различных сплавов. [1]
Содержание кадмия в организме человека составляет 10-4% от массы. Он концентрируется в почках, печени и костной ткани. Биологическая роль кадмия заключается в регулировании обмена сахара в крови, При избыточном поступлении в организм он, в силу высокой химической активности, замещает кальций в костной ткани, при этом кости становятся непрочными и крошатся. Повышенное содержание этого металла в пище приводит к массовому заболеванию зубов у детей. Кадмий может замещать кальций в ферментах и разрушать эритроциты. Он обладает канцерогенным и мутагенным действием. Тяжелое отравление вызывается сотыми долями грамма соединений кадмия, принятая внутрь повышенная доза (30 — 40 мг) уже оказывается смертельной. Кадмий выводится из организма очень медленно (0,1% в сутки), единовременное отравление может перейти в хроническое. Для острых отравлений обычен более или менее длительный скрытый период. Начальными признаками токсикоза являются сухость слизистых оболочек, сладкий вкус во рту, головная боль в области неба, белок в моче, дисфункция половых органов, нарушение нервной системы, острые костные боли в спине и ногах, снижение обоняния и так называемая «кадмиевая кайма» — золотистое окрашивание десен в области зубных шеек. К сожалению, вещество почти невозможно изъять из природной среды. Металл все больше накапливается в ней, а потому и попадает разными путями в пищевые цепи человека и животных. Дело еще и в том, что кадмий легко переходит из любого типа почв в растения, последние поглощают его из почвы (до 70%) и из воздуха (до 80%). Известна история, как цинковый рудник в Японии загрязнил кадмием реку Дэинцу. Около полутораста человек умерло от атрофии костного скелета. Этот случай вошел в историю эндемических отравлений тяжелыми металлами под названием «болезнь итай-итай», и фармакологическим предприятиям пришлось специально разработать реагент (бета-2 микроглобулин) для определения кадмия в моче.
В водоемах кадмий почти исключительно встречается в виде двухвалентного катиона, в виде органических соединений его нет. Токсичность кадмия в водоемах зависит от жесткости воды, кислотности, а также от содержания ионов и металлов. Кальций и магний понижают в жесткой воде токсичность кадмия, а цинк, наоборот, повышает. В первую очередь кадмий попадает в водоемы при поверхностной обработке металлов для защиты от коррозии и при переработке руд, которые не содержат железа. В бытовых сточных водах также может содержаться много кадмия. ПДК для кадмия в бытовой воде 0,01 мг/л. [1]
Ртуть. В природных объектах содержание ртути значительно ниже, чем кадмия и свинца. Источником загрязнения могут быть ртутьсодержащие фунгициды, компосты из бытового мусора и осадки сточных вод. Ртутные препараты используются при производстве целлюлозы на целлюлозно-бумажных комбинатах. Не следует сбрасывать со счетов ртуть, содержащуюся b медицинских и лабораторных термометрах. В городе с населением 300 тыс. человек ежегодно покупается около 400 тыс. медицинских термометров, следовательно, столько же их разбивается. А это 200 кг ртути, идущей в воздух, воду, почву. Сюда же стоит добавить ртуть из бьющихся в быту и на производстве люминесцентных ламп. Назрела необходимость полной замены содержащих ртуть пестицидов, медицинских и лабораторных приборов более безопасными. [1]
В организме человека ртуть находится в количестве 10-6 % от массы и участвует в образовании ДНК. Концентрируется она преимущественно в печени и почках. Опасное содержание ртути в крови 0,2 — 0,5 мг/л. При избытке в организме человека и животных она блокирует сульфогидрильные группы тканевых белков и ферментов, может накапливаться в тканях, богатых липидами, включая и головной мозг. У человека ежедневное поступление этого металла в количестве от 0,3 до 1 мг нарушает работу центральной нервной системы, вызывает мутагенное и канцерогенное действие. При остром отравлении солями ртути появляется рвота, распухают губы, происходит сильное воспаление десен, наступает упадок сердечной деятельности. Хроническое отравление сопровождается металлическим вкусом во рту, образуются язвы на деснах, выпадают зубы, поражается нервная система. Ежедневная допустимая норма поступления, по данным ФАО, составляет 0,04 мг/кг, по данным Минздрава для взрослых — 0,03, для детей — 0,02 мг/кг массы человека. [1]
Потребление человеком рыбы, даже при относительно низкой концентрации в ней ртути (0,8 мг/кг у окуня, 1,6 мг/кг у щуки), приводит к отложению металла в волосах (50 мг/кг), и начинают проявляться отчетливые признаки отравления. Когда содержание ртути в волосах велико (300 мг/кг), то это уже прямая опасность для жизни! Поскольку волосы — индикатор ртутного отравления, именно по ним стало возможным судить о реабилитации человеческого организма после прекращения потребления загрязненной пищи. [1]
Ртуть легко образует большое количество неорганических и органических соединений, причем органические соединения относятся к опаснейшим, высокотоксичным веществам. Металлическая ртуть и ее неорганические соединения действуют в основном на печень, почки, кишечный тракт. В обычных условиях они сравнительно быстро выводятся из организма. Гораздо опаснее ртутьсодержащие соединения. Поступив в организм, метилртуть переносится потоком крови. В желудочно-кишечном тракте наблюдается почти полное (на 95%) ее всасывание.
Высокая токсичность ртути связана чрезвычайно высоким химическим сродством с сульфогидрильными группами белков. [1]
Цинк принадлежит к числу весьма важных в биологическом отношении элементов. В промышленности большая часть добываемого металла используется для изготовления сплавов, оцинкованного железа и сухих гальванических элементов. В почву он поступает с удобрениями, пестицидами и промышленными отходами. Обогащение ландшафта цинком может произойти при систематическом использовании в качестве органического удобрения осадков сточных вод городов, а также при сжигании на полях отходов резины, в состав которой он входит как элемент, улучшающий вулканизацию. [1]
Человеческий организм содержит около 0,001 % цинка, причем особенно богаты им зубы, поджелудочная железа, гипофиз, кожа. Суточная потребность человека в этом элементе составляет 15 мг и полностью покрывается обычно пищей. Цинк входит в состав более 80 ферментов человека. Его недостаток вызывает сухость и шершавость кожи, приводит к различным биохимическим нарушениям в организме. [1]
При отравлении цинком появляются раздражительность, ноющие боли в мышцах, тошнота, поражаются легкие, слизистая оболочка глаз, нарушаются вкусовые ощущения.
Для растений цинк является микроэлементом.
Вынос его урожаем полевых культур составляет от 75 до 2300 г/га. Содержания цинка в зерне колеблется от 5 до 200 мг/кг. Если концентрация доступного растениям цинка в Нечерноземной зоне менее 0,2 — 0,1, а в Черноземной зоне менее 0,3 — 0,2 мг/кг почвы, рекомендуют вносить цинковые удобрения. Допустимая норма поступления цинка, по данным ФАО, составляет 15 мг/кг, по данным Минздрава для взрослых и детей — 50 мг/кг массы человека в сутки. Цинк не токсичен для воды, но при содержании 5 мг/л вода приобретает неприятный вкус.
Медь, как и цинк, является важным компонентом многих ферментов человека, животных и растений. Она участвует в синтезе гемоглобина, развитии костей, функционировании центральной нервной системы. Недостаток этого металла в организме человека снижает образование гемоглобина и приводит к ослаблению памяти. [1]
В промышленности медь используется главным образом для изготовления электрических проводов и сплавов с другими металлами. В окружающую среду она попадает с удобрениями, пестицидами, промышленными отходами из медных изделий. Различные сельскохозяйственные культуры выносят с 1 га 10 — 330 г меди, причем она концентрируется в семенах. Медные удобрения применяют в Нечерноземной зоне, если содержание доступной для растений меди менее 1,5 — 2,U, в Черноземной зоне — менее 2,0 — 5,0 мг/кг почвы. [1]
По норме ВОЗ/ФАО смертельной дозой солей меди для человека является 200 мг/кг массы тела. Симптомы острого отравления: тошнота, рвота, головная боль. В тяжелых случаях возможны тахикардия, желтуха и смерть. Хроническое отравление солями этого металла сопровождается заболеваниями печени и желудочно-кишечными расстройствами. В зерне медь встречается в количестве 0,5 — 36 мг/кг. Она может накапливаться в семенах гречихи и масличных культур. Допустимая норма поступления, по данным ФАО — 5 мг/кг, по данным Минздрава —10 мг/кг массы человека в сутки. Повышенное содержание этого загрязнителя в сельскохозяйственных культурах наблюдается при многолетнем применении медьсодержащих фунгицидов. Особенно велико содержание меди в почвах старых виноградников и хмельников. [1]
Опасность загрязнения окружающей среды тяжелыми металлами сводится к следующему:
1. Попадая в почву, тяжелые металлы усиливают минерализацию органического вещества, вызывая негативные изменения в почвенно-поглощающем комплексе, вследствие замещения кальция и магния. Сложное влияние они оказывают на биоту почвы и ее ферментативную активность. В ней снижается численность полезных микроорганизмов, увеличивается количество грибов, подавляется активность многих ферментов (пероксидаза, каталаза и др.). Это приводит к деградации плодородия почвы и снижает ее способность к самоочищению;
2. Проникая в растения, они могут активно участвовать в метаболических процессах, но могут сохраняться и в виде неактивных соединений в клетках и на клеточных мембранах. В результате снижается продуктивность растений и качество продукции, происходят изменения в направленности физиолого-биохимических процессов и реализации генетической программы растений, нарушаются естественно сложившиеся фитоценозы;
3. Тяжелые металлы, накапливаясь в растениях, по трофическим цепям с кормом и продуктами питания попадают в организм животных и человека, вызывая различные заболевания. Опасность увеличивается еще и потому, что высшие растения без видимых признаков отравления могут накапливать токсичные для человека и животных концентрации тяжелых металлов. В связи с этим особую актуальность приобретают исследования превращения тяжелых металлов по всей экологической цепи почва — растение — животное — человек с целью улучшения гигиенического качества продукции и среды обитания человека. Тяжелые металлы могут усваиваться живыми организмами также непосредственно из воды и воздуха. Причины токсичного действия тяжелых металлов на растения и другие живые организмы, по-видимому, заключаются в следующем:
во-первых, все тяжелые металлы обладают сильным денатурирующим действием и вызывают снижение активности ферментов и других метаболически важных белков клетки: они могут повреждать мембраны клетки, нарушая тем самым их проницаемость;
во-вторых, возможна конкуренция тяжелых металлов с необходимым растению элементом питания, что может привести к дефициту последнего и нарушить нормальный ход метаболических процессов. Так, кадмий замещает цинк, барий и стронций замещают кальций, цезий замещает калий. [1]
2.2 Методы определения металлов
Содержание металлов (химических элементов) в различных средах может определяться рядом методов химического и физико-химического анализа — весовым, спектральными, электрохимическими и др. В зависимости от количества анализируемого вещества содержание металлов может определяться методами макро-, полумикро- и микроанализа.
Содержание металлов весовым методом определяется путем перевода пробы в раствор — за счет химического растворения в подходящем растворителе (воде, водных растворах кислот, реже щелочей) или сплавления с подходящим флюсом из числа щелочей, оксидов, солей с последующим выщелачиванием водой. После этого соединение искомого металла переводится в осадок добавлением раствора соответствующего реагента — соли или щелочи, осадок отделяется, высушивается или прокаливается до постоянного веса, и содержание металлов (металла) определяется взвешиванием на аналитических весах и пересчетом на исходное содержание в пробе. При квалифицированном применении метод дает наиболее точные значения содержания металлов, но требует больших затрат времени.
Для определения содержания металлов электрохимическими методами пробу также необходимо перевести в водный раствор. После этого содержание металлов определяется различными электрохимическими методами — полярографическим (вольтамперометрическим), потенциометрическим, кулонометрическим, кондуктометрическим и другими, а также сочетанием некоторых из перечисленных методов с титрованием. В основу определения содержания металлов указанными методами положен анализ вольт-амперных характеристик, потенциалов ион-селективных электродов, интегрального заряда, необходимого для осаждения искомого металла на электроде электрохимической ячейки (катоде), электропроводности раствора и др., а также электрохимический контроль реакций нейтрализации и др. в растворах.
Эта группа методов позволяет определять содержание различных металлов в широком диапазоне концентраций с удовлетворительной точностью, но трудоемкость указанных методов также довольно высока.
Достаточно разнообразна группа спектральных методов определения содержания металлов. В нее входят, в частности, различные методы определения содержания металлов из анализа характеристических спектров электромагнитного излучения атомов — атомный эмиссионный анализ, атомный абсорбционный анализ, спектрофотометрия, масс-спектрометрия, рентгеноспектральный анализ.
Содержание металлов в очень малых (примесных) концентрациях — чаще радиоактивных изотопов соответствующих элементов, но и не радиоактивных тоже — определяется рядом методов ядерной спектрометрии (бета-, гамма-спектрометрии, а также нейтронно-активационного анализа).
В некоторых случаях содержание металлов определяется комплексными методами, сочетающими спектральные и электрохимические например, спектрополяриметрией.
2.2.2 Колориметрическое определение иона окисного железа родановым методом поп пленочной шкале [5]
Предварительная обработка пробы воды
Металлы в воде могут быть в различных формах: в виде ионов, коллоидов и комплексных соединений с органическими и неорганическими веществами. Для разрушения органических веществ и перевода всех форм металлов в простую ионную форму необходима предварительная обработка проб исследуемой воды.
Разрушение органических веществ можно вести несколькими способами:
1. Способом мокрого озоления с использованием смеси серной и азотной кислот.
При этом или вся проба обрабатывается, а затем на определение отдельных металлов отбираются аликвотные части раствора, или аликвотная часть пробы обрабатывается отдельно для каждого металла.
Способ мокрого озоления. 100 мл или более (до 500 мл) исследуемой воды помещают в коническую круглодонную колбу с оттянутым горлышком из термостойкого стекла емкостью (в зависимости от исследуемой пробы) 200, 500, или 1000 мл. в колбу осторожно приливают 2 мл концентрированной серной кислоты, 5 мл концентрированной азотной кислоты и кипятят, пока не появятся густые белые пары серного ангидрида в результате испарения воды и серной кислоты. После этого нагревание следует прекратить. При большом содержании в пробе воды труднорастворяемых органических веществ процесс озоления ведут до полного осветления жидкости в колбе. Если не удалось добиться осветления добавлением одной порции смеси кислот, добавляют еще 5 мл концентрированной азотной кислоты и нагревание повторяют до появления паров серного ангидрида. Затем раствор охлаждают до комнатной температуры, разбавляют бидистиллятом до 50 мл и снова нагревают до кипения для растворения труднорастворимых солей. Если после растворения солей раствор не осветлился и содержит осадок, его фильтруют через фильтр (белая лента) в чистую колбу (если в пробе воды присутствуют металлы, которые могут адсорбироваться на осадке, то его необходимо несколько раз промыть раствором соляной кислоты 1:1). Колбу ополаскивают два раза 5-10 мл бидистиллята, подкисленного соляной кислотой, и смывают остаток на фильтр. Фильтрат переносят в мерную колбу, доводят бидистиллятом в мерной колбе до метки и перемешивают. Разводят в зависимости от концентрации определяемого металла и чувствительности применяемого метода. Весь раствор ли аликвотные его части берут на определение металлов. При обработке проб кислотами, помимо разрушения органических веществ, устраняются и другие мешающие анализу вещества: цианиды, нитриты, персульфаты улетают, другая часть примесей окисляется.
Способ персульфатного окисления. 100 мл ил более исследуемой воды помещают в коническую колбу из термостойкого стекла, прибавляют 2-3 мл серной кислоты (1:3), около 1 г персульфата аммония и кипятят не менее 20 мин. Затем охлаждают, доводят до первоначального объема. Весь объем или аликвотную часть его берут на определение металлов.
При определении металлов: цинка, серебра, меди, кадмия, хрома, кобальта — необходимо пробу воды озолять.
Определение свинца и никеля лучше проводить без озоления, так как при этом частично теряется свинец и никель.
Метод основан на взаимодействии в сильно кислой среде окисного железа и роданида с образованием окрашенного в красный цвет соединения по следующей схеме:
При дальнейшем повышении концентрации роданида происходит образование комплексов с большим количеством координированных групп, причем максимальное число их равно шести:
Интенсивность окраски зависит от концентрации железа. Кроме того, интенсивность окраски комплексов с различным количеством координированных роданид-ионов неодинакова; она тем больше, чем больше роданид-ионов содержится в комплексной группе, однако отдельные комплексные группы мало отличаются по своей устойчивости и поэтому ни при каких условиях железо не образует какого-либо одного роданидного комплекса; наряду с одной формой всегда находится значительное количество других форм роданидных комплексов железа с иным количеством координированных ионов родана.
Поэтому очень важно, чтобы концентрация роданида была достаточно большой и строго одинаковой как в анализируемом, так и в стандартном растворе. В противном случае при одном и том же количестве железа окраска обоих растворов будет неодинакова, так как они будут содержать комплексы различного состава.
Необходимо, чтобы раствор был заметно подкислен, так увеличение рН приводит к гидролизу соли железа и образованию основных солей или гидроокиси.
Мешающие влияния. Определению мешает целый ряд металлов, например, медь, висмут, кобальт. Мешающее влияние высокого содержания органических веществ и трудноразлагаемых комплексов железа устраняется выпариванием пробы с азотной и серной кислотой. Для этого 50 мл пробы выпаривают с 1 мл концентрированной серной кислоты и 1 мл концентрированной азотной кислоты до появления густых белых паров серного ангидрида. Пробу разбавляют, доводя дистиллированной водой до 50 мл. в этих случаях рекомендуется проводить определение только общего содержания железа.
Ход определения. В одну из стандартных колориметрических пробирок наливают 5 мл исследуемой воды, прибавляют для подкисления полную стеклянную лопаточку кислого сернокислого калия (размер лопаточки должен быть таким, чтобы при ее заполнении вес реактива составлял около 0,1 г и 0,5 мл 10%-ного раствора роданистого калия или роданистого аммония). При наличии иона окисного железа окраска раствора будет от слабо-розовой до ярко-оранжевой.
Раствор взбалтывают до растворения кристаллов кислого сернокислого калия. В другую стандартную пробирку наливают до метки исследуемую воду без реактива. Вставляют пробирку в компаратор и колориметрируют, рассматривая пробирки сверху. Если окраска жидкости окажется интенсивнее самого яркого эталона, раствор колориметрируют, рассматривая содержимое пробирки сбоку. Полученный результат при этом утраивают. Для колориметрирования используется пленочная шкала эталонов. Определение окисного железа делается возможно быстрее по взятии пробы, чтобы предупредить окисление закисного железа до окисного.
В условиях прописи метода без разбавления можно определить от 0,05 до 15 мг/л железа.
2.2.3 Определение содержания ионов тяжелых металлов в воде методом инверсионной вольтамперометрии (цинк, кадмий, свинец, медь)
Количественный химический анализ проб воды, пищевых продуктов и продовольственного сырья на содержание ионов токсичных элементов (Cu2+, Cd2+, Pb2+, Zn2+) основан на инверсионно-вольтамперомерическом (ИВ) методе определения массовых концентраций элементов в растворе подготовленной пробы. Метод ИВ-измерений основан на способности элементов электрохимически осаждаться на индикаторном электроде из анализируемого раствора при задаваемом потенциале предельногодиффузионного тока, а затем растворяться в процессе анодной поляризации при определенном потенциале, характерном для каждого элемента. Процесс электроосаждения элементов на индикаторном электроде проходит при заданном потенциале электролиза в течение заданного времени электролиза. Электрорастворение элементов с поверхности электрода проводят в режиме меняющегося потенциала (линейном или другом) при заданной чувствительности прибора. Регистрируемая вольтамперограмма содержит аналитические сигналы (максимальные анодные токи) определяемых элементов. Аналитический сигнал элемента прямо пропорционально зависит от концентрации определяемого по методу добавок аттестованной смеси определяемых элементов.
источник